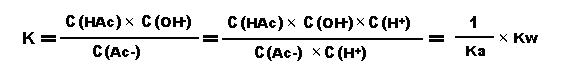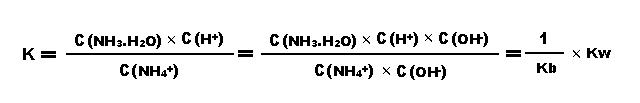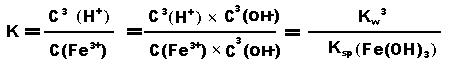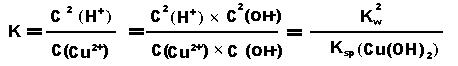水解平衡常数的计算 |
您所在的位置:网站首页 › 铵根离子水解平衡常数 › 水解平衡常数的计算 |
水解平衡常数的计算
|
一.醋酸钠溶液的水解(强碱弱酸盐水解) Ac-+H2O⇋HAc+OH- 平衡常数:
(Kw是水的离子积,Ka是醋酸的电离常数) 二.氯化铵溶液的水解(强酸弱碱盐水解) NH4++H2O ⇋ NH3·H2O + H+ 平衡常数:
(Kw是水的离子积,Kb是氨水的电离常数) 三.醋酸铵溶液的水解(弱酸弱碱盐水解) Ac- + H2O ⇋ HAc + OH- NH4+ + H2O ⇋ NH3·H2O + H+ 由于生成的H+和OH-会结合生成水,所以促进醋酸铵的水解,两式相加得醋酸铵总的水解方程:Ac- + NH4+ + H2O ⇋ HAc + NH3·H2O 平衡常数: (Kw是水的离子积,Ka是醋酸的电离常数,Kb是氨水的电离常数) 四.对于氯化铁溶液的水解(无电离常数的强酸弱碱盐水解) Fe3++ 3H2O ⇋ Fe(OH)3 + 3 H+这个平衡的常数表达式为:K=c3(H+)/c(Fe3+),液态水和固体氢氧化铁的浓度不变看待。 当加入浓度更大的铁离子,意思就是提高了铁离子浓度,氢离子浓度基本不变(溶液体积的变化忽略不计)为了使K不变(温度不变,平衡常数不变),水解平衡必须往右移动,氢离子浓度增加,酸性增强。 当加水稀释时,则氢离子和铁离子浓度基本上是同倍减少,则为了使K不变,平衡必须往右移动,氢离子浓度和铁离子浓度都减少,酸性减弱。 由于存在氢氧化铁的沉淀溶解平衡和水的电离平衡,所以存在以下关系:所以铁离子水解的平衡常数: (Kw是水的离子积,Ksp是溶度积常数) 若为氯化铜Cu2++ 2H2O ⇋ Cu(OH)2 + 2H+,则平衡常数:
|
【本文地址】
今日新闻 |
推荐新闻 |