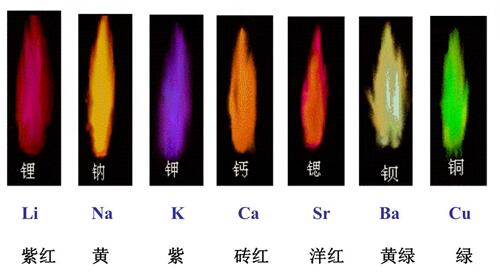
焰色反应的本质、原理及实验 |
您所在的位置:网站首页 › 金属离子显色的原因 › 焰色反应的本质、原理及实验 |
焰色反应的本质、原理及实验
|
焰色反应的本质、原理及实验
推荐访问
化学反应
许多金属或它们的化合物在燃烧时火焰呈特殊的颜色,这在化学上叫做焰色反应,是一种物理变化,是元素的性质而不仅是化合物的性质,相应金属不管是离子还是单质灼烧时都会呈现其焰色。 什么是焰色反应焰色反应可以从以下3种角度理解: ①本质:焰色反应是元素的一种物理性质,某些金属元素及金属离子均能发生焰色反应。焰色反应属于物理变化。 ②范围:不是所有金属都能发生焰色反应,只有碱金属元素及钙、锶、钡、铜等少数金属能发生焰色反应。 ③辨析:焰色反应的显色过程与气态物质燃烧时产生各种颜色的火焰的过程有本质区别。例如,钠在空气中燃烧呈黄色火焰和灼烧氯化钠呈黄色焰色有本质区别,前者属于燃烧产生的火焰颜色,生成过氧化钠,而后者发生焰色反应,没有生成新物质,仍然是氯化钠。钠在空气中燃烧分两段:先气化,焰色呈黄色;后钠蒸气燃烧呈黄色火焰。
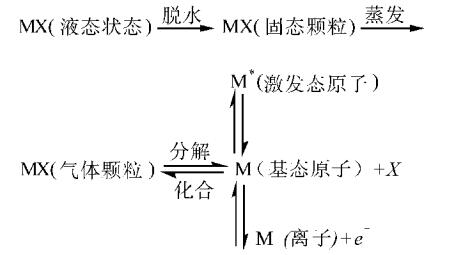
与焰色反应相似的概念: “燃烧”是发光、发热的剧烈的氧化反应,其反应必须具备2个条件:温度达到可燃物着火点;可燃物与具有强氧化性物质(如氧气等)充分接触。 “火焰”是气态可燃物在燃烧时形成的一个发光、散热的区域,是气态可燃物燃烧时产生的现象。 “发光”是可燃物燃烧时发生的现象,但是有发光现象不一定发生燃烧,例如,电灯泡发光。 “焰色”是指碱金属、钙、锶、钡等金属或它们的化合物在灼烧时使火焰呈现的特殊颜色(没有氧化剂参加反应)。例如,钾、钠的焰色分别呈紫色、黄色。 焰色反应的原理火焰中金属元素的物理化学历程是很复杂的,一般认为,试液雾粒在火焰中有如下图所示的复杂的反应历程。
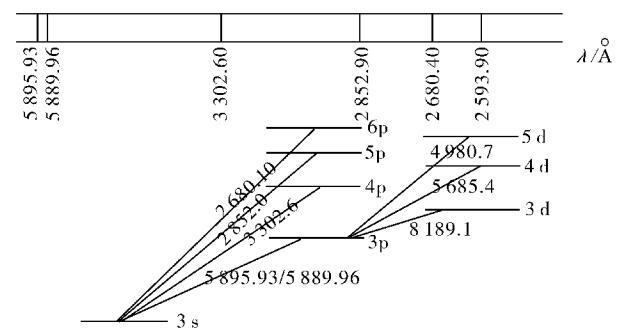
对于蘸在铂丝表面的NaCl(aq)而言,上图表明NaCl(aq)经过脱水、蒸发、分解等物理化学变化形成基态Na原子,基态Na原子再被热能激发。激发的结果使Na原子的Z外层电子吸收一定的能量而离开原来的能级,跳跃到较高的能级,处于较高能级的电子是不稳定的,跃迁回基态或低能态,产生不同波长的辐射,从而得到不同的焰色。其中辐射光的频率满足如下公式: v=(E2-E1)/h E1、E2表示电子在低能级或高能级时的能量,h为普朗克常数。钠光谱的一个光谱系和钠原子的简单能级图如下图所示。
上图表明了钠原子[Na]3s1中3s1电子在不同能级的跃迁情况。在这些光谱线中,Z强的是3s→3p的跃迁,波长分别是589.0~589.6nm双线,它是钠的特征双线,称作D线(黄色),而事实上人眼感知的可见光的波长范围见下表。
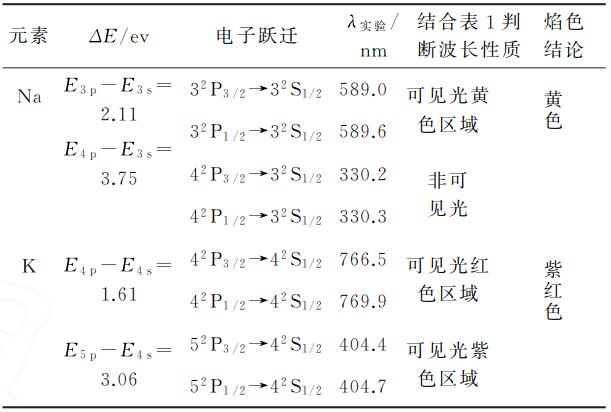
由上表可以看到,钠元素的3s→3p跃迁对应的波长处于可见光黄色区域,因此钠元素的焰色反应为黄色。对钾元素的焰色反应原理也进行了类似钠元素焰色反应的研究,具体情况见下表。
通过上表,可以进一步理解钠元素电子跃迁的情况,同时也可以清晰地看到钾元素的焰色反应机理和钠元素有一定的区别。这个区别就是钾元素的电子跃迁存在于4s→4p(可见光红色区域)或4s→5p(可见光紫色区域),其对应辐射光波长都处于可见光波长范围,因此钾元素的焰色反应才会呈现为紫红色。 焰色反应实验操作焰色反应实验操作的准确与否决定了这个实验的成败,因此明确焰色反应的实验操作关键,是做好课堂教学以及指导学生实验的重中之重,具体分析如下。 1、焰色反应实验步骤 ①把装在玻璃棒上的铂丝(或铁、镍、铬、钨丝)在酒精灯的火焰里灼烧,直至与原来火焰的颜色相同。 ②用铂丝蘸取金属的盐溶液,放在火焰上灼烧,观察火焰所呈现的颜色。每次实验完毕,都要用稀盐酸洗净铂丝,再用蒸馏水清洗,然后在火焰上灼烧到无色,才能进行下一次实验。 ③在观察钾的焰色时,若有钠的干扰,Z好透过蓝色的钴玻璃观察,这样就可以滤去黄色的光,让紫色的光通过。 2、焰色反应实验时注意的问题 每次实验,火焰如果都呈现明显的特征颜色,钠——黄色、钾——紫色(透过蓝色钴玻璃),这就是实验成功的表征。而实验中经常出现火焰所呈现的颜色不明显,且一闪即逝的现象,要保证实验成功,应注意如下几个问题。 ①酒精灯芯不能被污染,应尽量采用未被污染的酒精灯芯,使酒精灯火焰趋近无色。 ②应用酒精灯外焰灼烧蘸取金属盐的铂丝时,呈现明显特征颜色后,再移至内焰下部,使整个火焰均呈现特征颜色。 ③铂丝一定要洗涤干净,避免沾有较多的其他金属阳离子而影响实验效果。 焰色反应实验的改进方法焰色反应实验有很多改进方法,而作为课堂演示实验,应该具有操作简单、实验时间短、现象明显便于观察及具有一定的趣味性等特点。 改进方法一: 先将粉笔的一端小心地打出一个2cm深的小孔,在小孔中放入一定量的钾盐或钠盐并压实。实验时可以将粉笔中有钾盐或钠盐的一端浸泡在酒精中,一定时间后点燃粉笔上的酒精,这时可以拿着粉笔绕教室一周,使每位学生都能近距离观察到钾盐或钠盐的焰色,现象十分明显。 实验完毕后,可以把粉笔保存好待下次实验时使用。改进后实验的特点是,观察钾或钾的化合物的焰色根本无需使用蓝色钴玻璃,实验操作方便简单,焰色反应的时间较长,便于观察清楚,在酒精中浸泡过的粉笔可长期使用。 改进方法二: 准备一个玻璃片,在玻璃片上放适量的要进行焰色反应的物质的固体粉末,用浸泡有酒精的医用棉球蘸少许粉末,用酒精灯点燃酒精棉球,然后把燃着的医用棉球迅速从酒精灯火焰上移开,这时可以非常明显地观察到粘有固体粉末的酒精燃烧时的火焰颜色。改进后的实验特点是,观察钾的化合物根本无需用蓝色钴玻璃,就可以清楚地看见紫红色的火焰。 改进方法三: 将钠、钾金属的盐研碎,然后将研碎的钠盐或钾盐放入蒸发皿或坩埚中,再加入少量酒精后点燃。开始时火焰颜色为酒精燃烧的颜色,随后立即出现金属的焰色。该方法操作简单,可见度大,现象明显,效果很好。 2018-09-15 浏览次数:113160次 本文来源:https://www.yiqi.com/retiao/detail_2596.html 热门标签: 上一篇 下一篇 看过《焰色反应的本质、原理及实验》的人还看了以下文章 化学反应09-17化学反应原理09-17化学反应类型09-17化学反应速率09-17化学反应平衡09-17反应热09-17化学反应方程式09-17化学反应与能量09-17焰色反应09-17 延伸阅读 查看更多精彩>> 版权与免责声明①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。 ②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。 ③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。 ④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi |
【本文地址】
今日新闻 |
推荐新闻 |