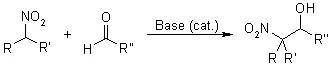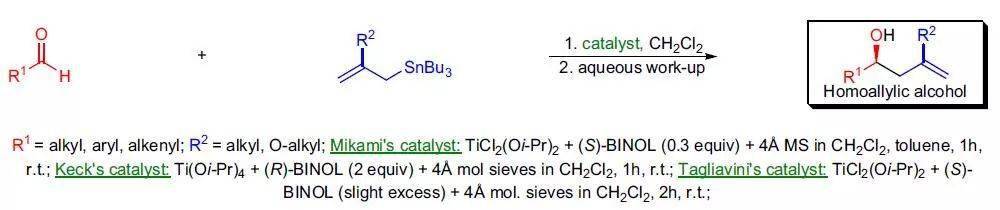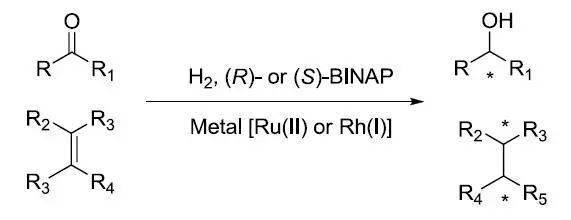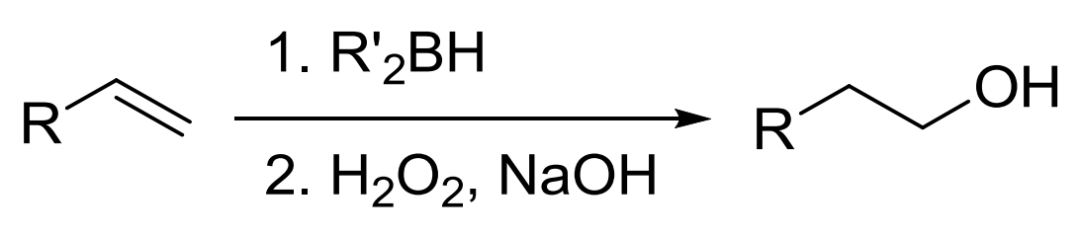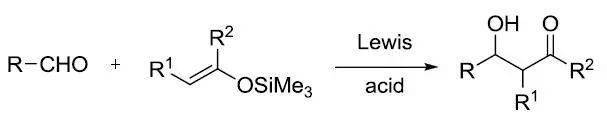醇的制备汇总 |
您所在的位置:网站首页 › 邻二醇生成环氧 › 醇的制备汇总 |
醇的制备汇总
|
在有机金属试剂存在下,羰基化合物可以迅速与其反应,这类反应被称为Barbier反应。P. Barbier最初提出的实验方案是利用金属镁反应,后来被发展为著名的格氏试剂。近期一些其他金属(如, Sn, In, Zn)在相同的条件的水溶液中反应得到很好的效果。这些反应明显要安全和易于操作,甚至一些无保护基团的糖类也可以和这些有机金属试剂反应。 三、 Nozaki–Hiyama–Kishi偶联反应
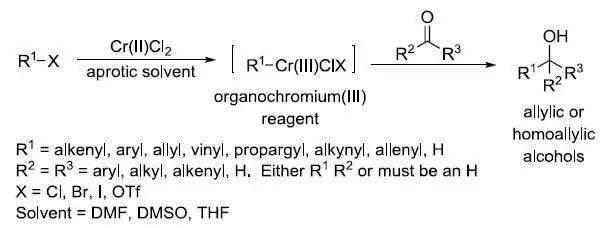
Cr-Ni双金属催化下烯基,芳基,炔丙基,炔基等卤代物先氧化加成得到有机三价铬试剂,然后对醛进行亲核加成得到醇的反应。 四、 Baylis-Hillman反应 活性烯烃和醛在三级胺(如DABCO = 1,4-Diazabicyclo[2.2.2]octane)的催化下发生的偶联反应被称为Baylis-Hillman 反应。膦也可以用于此反应,如果胺或膦是手性的,则发生非对映选择性的 Baylis-Hillman 反应。 五、 Cannizzaro反应
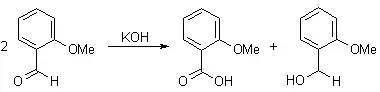
在浓碱条件下,不能进行烯醇化异构的醛发生氧化还原歧化反应得到相应的醇和酸的反应。α-酮基醛发生分子内的歧化反应可以得到很好的产率。 六、 Henry反应
Henry反应是指在碱催化下硝基烷烃与醛酮反应β-羟基硝基烷烃的反应。此反应和羟醛缩合类似,也被称为硝基Aldol反应。 七、 Keck不对称烯丙基化反应
在Ti(IV)-BINOL络合物催化下,烯丙基亲核试剂对映选择性的加成到醛上制备手性仲醇的反应。 八、 Meerwein–Ponndorf–Verley还原
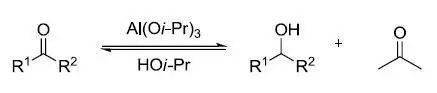
利用 Al(Oi-Pr)3在异丙醇中还原酮得到相应的醇的反应。是 Oppernauer氧化的逆反应。 九、 Prins反应
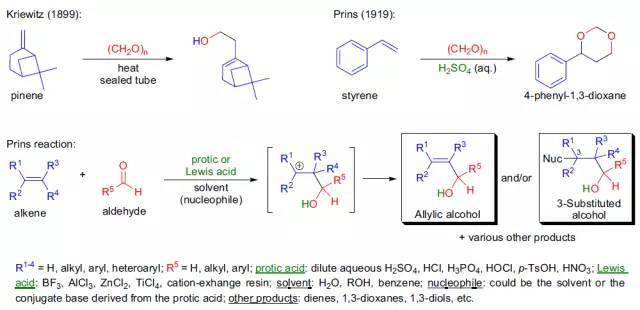
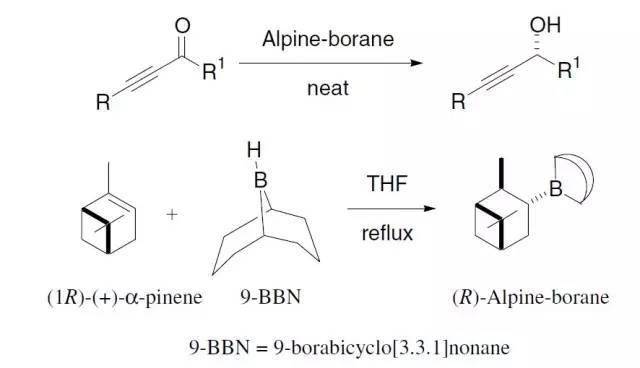
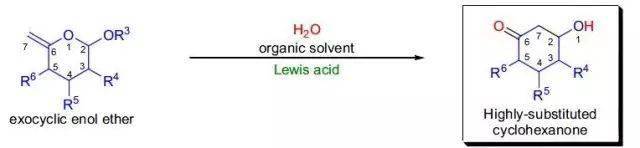
1899年,Kriewitz报道了在封管中加热多聚甲醛和β-蒎烯可以得到一种不饱和醇。直到二十年后,H.J. Prins才第一次对硫酸催化下的各种烯烃(如苯乙烯,蒎烯,莰烯等)与甲醛的反应进行了综合性的研究。Prins反应中采用强质子酸的强烈条件,对反应的选择性、普适性以及环境友好方面都有不利的影响,限制了反应的实际应用。后来发现采用不同的Lewis酸也可以有效、温和地参与或催化该反应,而且对反应的历程和选择性影响很大,从而可以通过另外一个途径对反应进行调控。 十、 不对称丙烯基硼化 Asymmetric Allylboration ,Roush asymmetric allylation 十一、 Sakurai烯丙基化反应
Lewis酸催化下烯丙基硅烷作为碳亲核试剂进行烯丙基化的反应。此反应也被称为 Hosomi–Sakurai反应。底物如果是单纯的羰基化合物,则产物为醇。 十二、 Kagan-Molander偶联反应
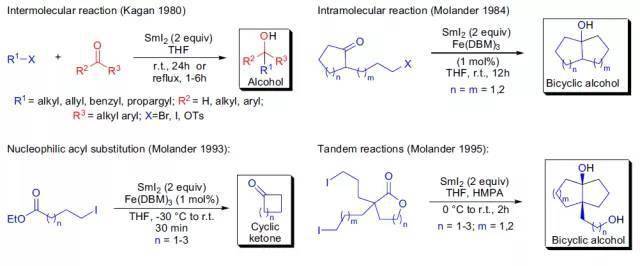
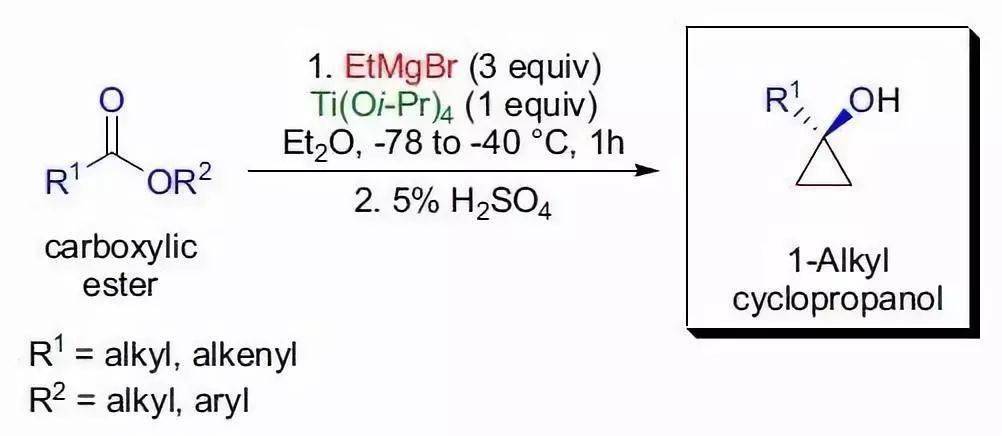
上世纪70年代末,H. Kagan系统地的研究了二价镧系金属碘化物的还原特性,并在这一研究的基础上,发现在两倍当量的二碘化钐存在下溴代烷,碘代烷或TsO烷与醛酮反应可以生成相应的醇。最初的反应条件是以四氢呋喃为溶剂室温下反应24小时或回流几小时。Kagan也发现在反应中加入催化量的氯化铁可以明显地减少反应时间,而这一方法在后来被G.A. Molander进一步的研究发展。在1984年G.A.Molander第一次报道了在分子内发生的此反应,ω-碘代酯在二碘化钐和催化量的三价铁盐的存在下发生分子内的酰基取代反应,并进一步发生此反应生成复合多环脂烃。现在此类反应被统称为Kagan-Molander二碘化钐介导偶联。这个反应常用作分子内成环。酯和两分子的卤代烷烃反应生成叔醇。 十三、 Sharpless不对称羟胺化
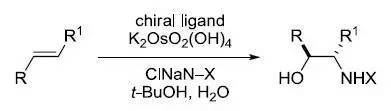
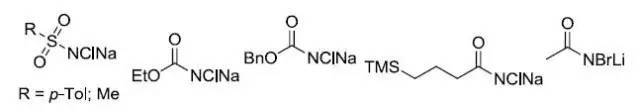
在锇催化下胺基和羟基对烯烃进行顺式加成,通过加入手性配体(二氢奎宁或二氢奎宁衍生物类手性配体)实现对映选择性。常见的氮源(XNClNa)包括:
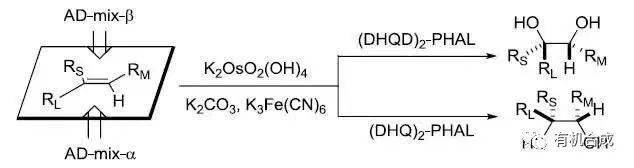
十四、 Sharpless不对称双羟基化反应
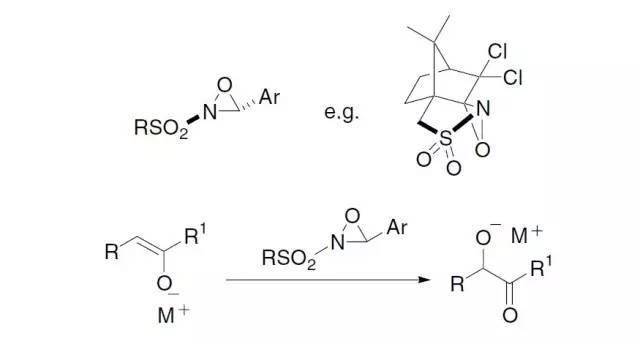
RL:最大取代基,RM中等取代基,Rs:最小取代基。 十六、 Davis氧化反应
十七、 Corey-Bakshi-Shibata还原
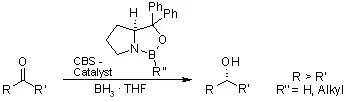
利用硼烷和手性恶唑硼烷催化剂(CBS catalyst)对映异构选择性的还原酮得到相应的手性醇。通常情况下,MeCBS比较常用(R'' = Me,通过改变取代基可以增加选择性)。 十八、 Luche还原
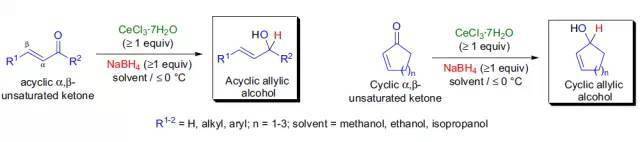
1978年,J.L. Luche报道了使用镧系金属氯化物和硼氢化钠的混合物选择性地将α,β-不饱和酮还原为相应的烯丙醇。而后进一步研究了此反应的应用范围和一些限制,并发现使用CeCl3.7H2O/NaBH4在乙醇或甲醇中反应共轭烯酮(α,β-不饱和酮)发生1,2-还原的效果最好。使用氯化铈/硼氢化钠的混合物将共轭烯酮转化为相应的烯丙醇的反应被称为Luche还原。 十九、 Midland还原
二十、 Noyori不对称氢化反应
二十一、,
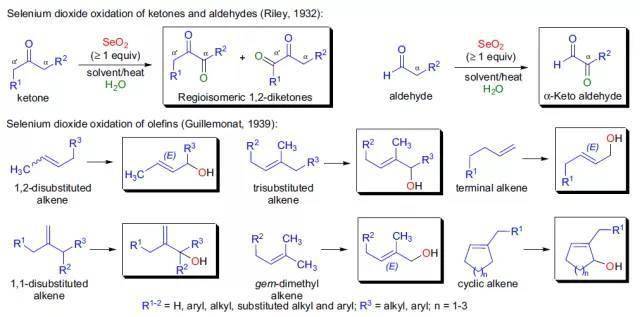
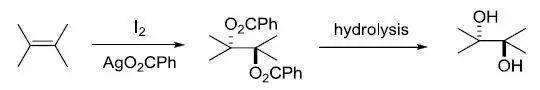
利用过氧酸将烷基硅化合物立体选择性的氧化为相应的醇。 二十二、 Riley氧化
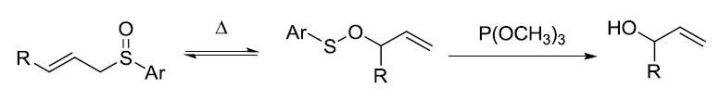
二十三、 Mislow–Evans重排反应
烯丙型亚砜在P(OMe)3存在下加热,发生[2,3]-σ-单电子重排,得到次磺酸酯,进而在P(OMe)3作用下转化为烯丙醇的反应。此反应立体选择性高。 二十四、 Wharton反应 利用肼还原α,β-环氧酮得到烯丙醇的反应。 二十五、 夏普莱斯-香月(Sharpless-Katsuki )不对称环氧化反应
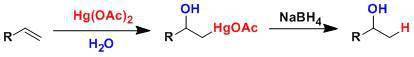
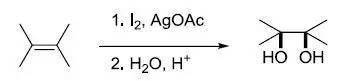
二十六、 氧化加汞还原脱汞反应 烯基上醋酸汞的顺式选择性加成反应,接着用硼氢化钠脱汞还原,得到马氏加成的醇。不需要强酸性条件,反应能在温和环境下进行。
二十七、 Brown硼氢化氧化反应
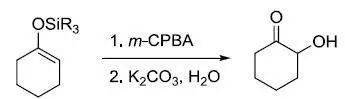
硼烷对烯烃进行协同顺式加成得到有机硼加成产物,然后在碱性条件下氧化得到醇的反应。其特点是:(1)反应过程不发生重排;(2)反应为顺式加成;(3)与不对称烯烃加成时,符合反马尔可夫尼可夫规则。有机硼烷可以发生多种反应,可以用来合成多种类型的有机化合物。例如:烯烃的硼氢化-氧化反应可以制备醇;炔烃的硼氢化-氧化可以制备醛和酮,用其他有机试剂替代过氧化氢也可用于制备胺、卤代烷等。过渡金属可催化烯烃和炔烃的加成,可以显著提高反应速率,与非催化的硼氢化反应相比,可以改变区域选择性和不对称选择性,手性过渡金属催化剂可以实现对映选择性硼氢化反应。 二十八、 Rubottom氧化反应 烯醇基硅烷用mCPBA氧化,水解得到α -羟基化产物的反应。
二十九、 过氧化酮氧化(Oxidation with Dioxirane) 氧化制备叔醇 三十、 四氧化锇氧化 在催化量的四氧化锇和共氧化剂的存在下,烯烃被氧化成邻二醇。通过其他的试剂较难实现的烯烃转化成邻二醇通过此方法能很温和平稳的进行。尽管锇价格相对昂贵,也被频繁使用。
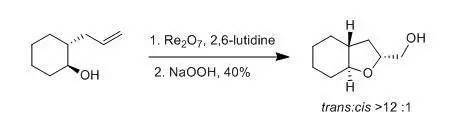
三十一、 Kennedy氧化环化反应 1992年Kennedy, R. M. 等人报道了5-羟基烯烃和氧化铼(VII)(Re2 O7 )反应得到2-羟甲基四氢呋喃的反应。
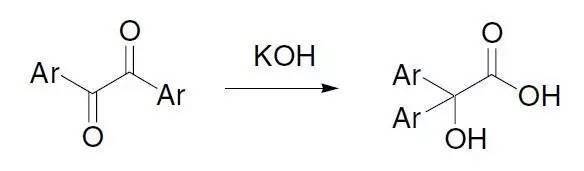
三十二、 Benzilic acid rearrangement(二苯基乙醇酸重排)
苯偶酰通过苯基重排得到二苯基乙醇酸的反应。 三十三、 由手性氨基酸合成手性羟基酸 三十四、 烯烃双羟化反应 Prévost反式双羟化反应
C. Prévost报道了利用苯甲酸银和碘氧化苯乙烯反应生成相应二醇的苯甲酸酯,水解从而得到1,2-二醇的反应。这种两步把烯烃转化为1,2-反式二醇的反应称为Prévost反应。 Woodward顺位双羟化反应
反应机理和Prévost 反式双羟化反应。1933年,C. Prévost报道了利用苯甲酸银和碘氧化苯乙烯反应生成相应二醇的苯甲酸酯,水解从而得到1,2-二醇的反应。这种两步把烯烃转化为1,2-反式二醇的反应称为Prévost反应。此反应最重要的改进为Woodward and Brutcher改进法,他们利用乙酸和水作为溶剂得到了順式-1,2-二醇。 三十五、 Chan炔还原反应 利用红铝(sodium bis(2-methoxyethoxy)aluminum hydride)或氢化铝锂立体选择性地将炔丙醇还原为E-烯丙醇的反应。 羰基化合物被金属氢化物还原生成醇。已知有各种各样的强度性质不同的还原剂。以容易得到,使用方便等实用性来考量,最多被使用的有以下还原剂。 三十八、 三十九、 四十、 四十一、 四十四、
四十五、 Chan酰氧基乙酸酯重排反应
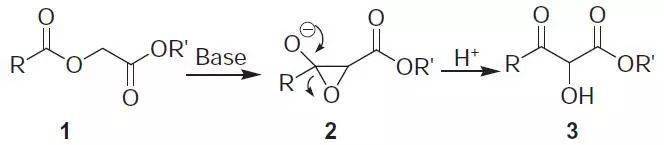
强碱性条件下,酰氧基乙酸酯经过环氧化物中间体,重排生成2-羟基-3-酮酯的反应。 四十六、 Demjanov重排
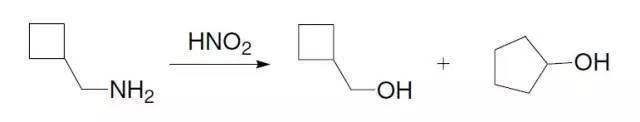
一级胺转化为重氮化合物中间体经过C-C键迁移得到醇的反应。 四十七、Ferrier碳环化反应
四十八、 Hammick吡啶烷基化反应
另外除了还原醛酮制备醇外,有机金属试剂对其加成也可以制备醇。 四十九、 Emmert还原缩合反应
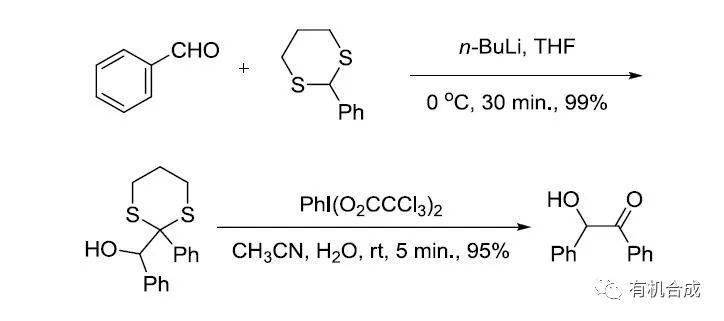
五十、 Corey–Seebach反应
五十一、 Arens-van Dorp反应 烷氧基乙炔在强碱条件下对醛酮加成得到烷氧基炔甲醇的反应。【 D. A. van Dorp, J. F. Arens, Nature160,189 (1947);J. F. Arens et al.,Rec. Trav. Chim.68,604, 609 (1949)】常用的强碱有氨基锂和丁基锂。其他端基炔也可以进行此反应。后来 Isler对此方法进行改进利用 β-氯烯基醚作为底物,在氨基锂条件下原位生成烷氧基炔基锂中间体直接进行反应。【 O. Isler et al.,Helv. Chim. Acta39,259 (1956)】。 五十二、 安息香缩合反应
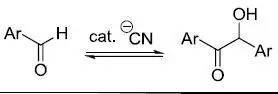
氰基催化芳香甲醛缩合得到安息香类物的反应。现在此反应都改用噻唑鎓盐或N杂化卡宾催化。此反应与Stetter反应的机理类似。 五十三、 羟醛缩合反应(Aldol condensation) 醛酮在碱性条件下得到烯醇盐和另一个羰基化合物缩合得到β-羟基醛酮的反应。有时β-羟基醛酮会脱水得到α,β-不饱和羰基化合物。将烯醇盐加成到醛( aldehyde)上得到醇( alcohol),因此此反应被称为 Aldol缩合反应。 Evans羟醛缩合反应
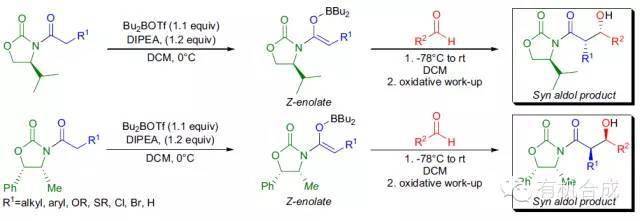
通过使用具有手性辅助基团的烯醇化合物可以得到立体化学纯度很高的羟醛缩合产物。D.AEvans 等发现通过由S-缬氨酸或(1S ,2R )-去甲麻黄碱制备的恶唑烷酮类化合物制备的羟醛缩合产物有很好的光学纯度。通过手性助剂进行的非对称羟醛缩合反应都称为Evans羟醛缩合反应。 Mukaiyama羟醛缩合反应
在Lewis酸催化下醛和烯醇硅醚进行羟醛缩合得到β-羟基羰基化物的反应。此反应由向山光昭(Teruaki Mukaiyama)在1973年报道。烯醇硅醚为烯醇负离子的等效体,但其亲核性不够强,不能直接与酮反应,因此需要加入路易斯酸以活化羰基。 Abiko-Masamune羟醛缩合反应 去甲麻黄碱(或去甲肾上腺素)作为手性助剂的丙酸酯和醛进行不对称羟醛缩合的反应。反应中形成了硼烯醇酯,最后生成是 syn【3】或 anti【2】构型的产物是由二烷基(三氟甲磺酰氧基)硼烷的烷基空间位阻、手性助剂、叔胺和温度(低温更容易生成动力学产物anti构型)共同决定的。利用大位阻的二环己基(三氟甲磺酰氧基)硼烷通过生成 E -硼烯醇酯生成anti构型的产物,而二丁基(三氟甲磺酰氧基)硼烷和DIPEA更容易生成syn构型的产物【10】。乙酸酯进行此反应可能会生成双羟醛缩合产物【6】。甲氧基乙酸酯可以高选择性的制备syn构型的乙醇酸衍生物【8】。 五十四、 Jacobsen水解动力学拆分
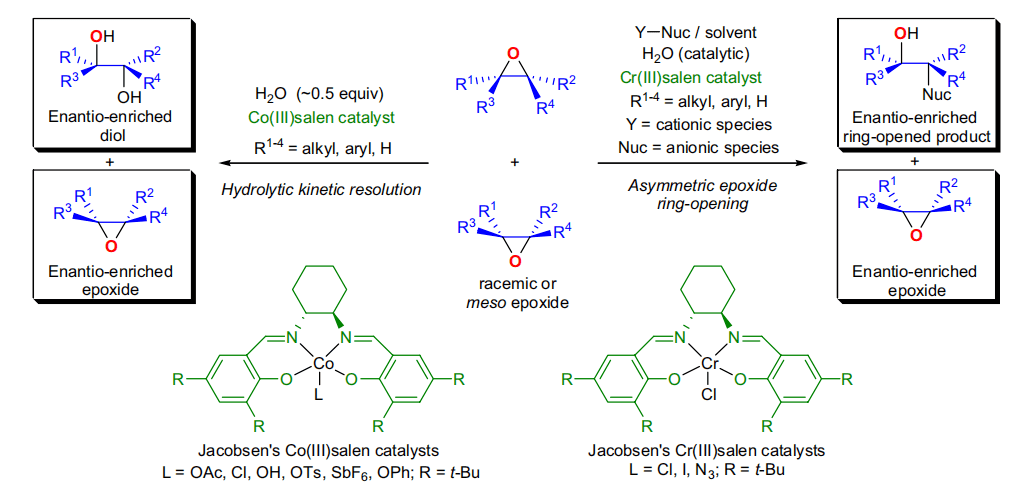
1995年,E.N. Jacobsen在发现 Jacobsen–Katsuki不对称环氧化反应 几年后,其团队报道了在催化量的手性Cr(III)(salen)配合物存在下,各种亲核试剂 (e.g., TMSN3)进攻内消旋的环氧化合物进行不对称开环反应(asymmetric ring-opening, ARO)。尽管之前有很多环氧对映选择性开环的报道,但是此种利用手性Cr(III)(salen)配合物催化的开环反应具有前所未有的高对映选择性。1997年,他们发现手性Cr(III)(salen)配合物催化消旋的端基环氧化合物水解,高对映选择性地得到端基环氧化合物和二醇,此方法被称为 Jacobsen水解动力学拆分 五十五、 Mukaiyama水合反应 在氧气存在下,烯烃经钴催化剂[Co(acac)2]催化与当量的硅烷反应得到烯烃的水合物的反应。此反应遵循马氏规则,锰催化剂也可以催化此反应。 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |