FDA《特定药物的生物等效性指导原则》长半衰期药物生物等效性指导 原则介绍分析 |
您所在的位置:网站首页 › 辐射半衰期长意味着什么问题 › FDA《特定药物的生物等效性指导原则》长半衰期药物生物等效性指导 原则介绍分析 |
FDA《特定药物的生物等效性指导原则》长半衰期药物生物等效性指导 原则介绍分析
|
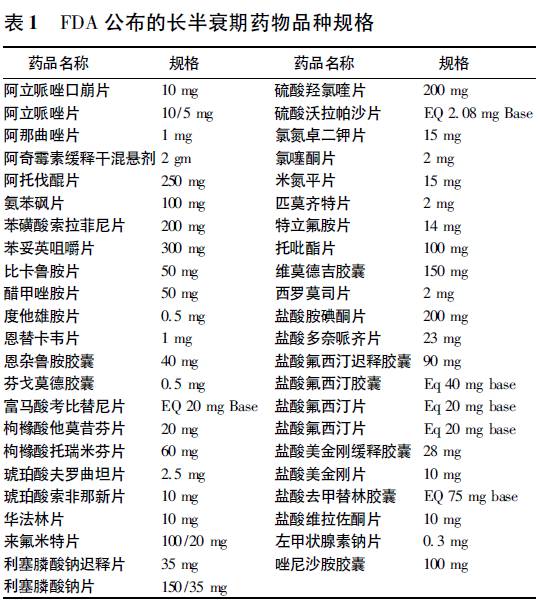
由于长半衰期药物的清除期较长,所以国际上对长半衰期药物的生物等效性研究作了进一步要求。 国际上对长半衰期药物的定义不是非常统一,但一般指的是半衰期超过24 h 的药物。 各国及组织通常允许使用Cmax和适当截取的AUC 来描述药物浓度的峰值和总暴露量; FDA 明确表明对于半衰期较长的( 24 h 以上)药物,如果药物分布和清除个体内变异较大,则不能截取部分AUC 来评价药物暴露量。 针对具体药物,FDA 于2010 年6 月开始,陆续公布《特定药物的生物等效性指导原则》(Bioequivalence Recommendations for Specific Products) ,并持续更新药物的品种和内容,其中包括对长半衰期药物生物等效性研究的指导。 根据仿制药的研发需要,2015 年FDA 颁布《特定仿制药物的研发指导原则》( Product-Specific Recommendations for Generic Drug Development) 。 FDA 明确表明《特定药物的生物等效性指导原则》是对FDA 2013 年颁布的《以药动学为终点评价指标的仿制药生物等效性研究指导原则( 草案) 》的补充。 本文对FDA《特定药物的生物等效性指导原则》中有关长半衰期药物生物等效性内容进行介绍和分析。 FDA 公布的长半衰期药物品种规格 FDA 2011 年颁布了的长半衰期药物盐酸胺碘酮生物等效性试验指导意见草案,并建议其他长半衰期药物生物等效性研究可参阅该指导草案。 目前,中国药学会组织翻译的FDA《特定药物的生物等效性指导原则》中涉及长半衰期药物指导原则约有45 品种规格,具体见表1。
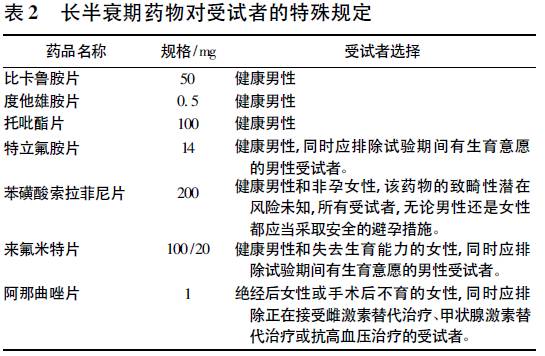
其中涉及我国进行仿制药质量与疗效一致性评价的首批289 品种的有: 阿立哌唑口崩片、阿立哌唑片、阿奇霉素缓释混悬剂、氨苯砜片、华法林片、枸橼酸他莫昔芬片、盐酸胺碘酮片、左甲状腺素钠片。 生物等效性试验设计 1 生物等效性试验类型 FDA 通常推荐需要进行空腹和餐后体内生物等效性试验,但对于口服常释制剂,当参比制剂说明书中明确说明该药物仅可空腹服用( 饭前1 h或饭后2 h 服用) 时,则不考虑进行餐后试验。 FDA《特定药物的生物等效性指导原则》中长半衰期药物的推荐试验类型主要如下: 空腹和餐后体内生物等效性试验: 绝大部分长半衰期药物需要进行空腹和餐后体内生物等效性试验。 此外,还对部分药品作出进一步的规定: 如苯妥英咀嚼片要求整片吞服; 氯氮卓二钾片剂采用创新型风险评估与缓和策略( REMS) 向患者告知本药品会增加出现自杀想法和自杀行为的风险,故所有相关元素均须纳入协议和知情同意书中。 空腹体内生物等效性试验: 部分药物只推荐空腹体内生物等效性试验,包括阿奇霉素缓释混悬剂、左甲状腺素钠片、苯磺酸索拉菲尼片、恩替卡韦片; 撒布性药物生物等效性研究: 部分药物除需要常规空腹和餐后体内生物等效性试验外,还需进行“空腹,撒布性药物生物等效性研究”,如盐酸美金刚缓释胶囊等。 2 生物等效性试验设计方案 FDA《以药动学为终点评价指标的仿制药生物等效性研究指导原则》( 草案) 规定:对于半衰期较长( 24 h 以上) 的口服常释制剂,若有充分的清除期,仍然可以采用单次给药的交叉试验进行生物等效性评价,如有必要,可考虑采用平行试验设计。 无论交叉设计还是平行设计,生物样本采集时间均应足以使药物通过肠道完成转运和吸收( 通常需2 ~ 3d) 。 Cmax和适当截取的AUC 通常用来描述药物吸收的峰值和总暴露量。 如对于药物分布和清除个体内变异较小的药物,可用AUC0-72h来代替AUC0-t或AUC0-inf。 但对于药物分布和消除个体内变异较大的药物,则不能采用截取的AUC。 FDA《特定药物的生物等效性指导原则》推荐的长半衰期药物等效性试验设计主要包括: 单次给药、双向交叉体内试验; 单次给药、双向交叉体内试验,或采取平行试验设计; 单次给药、双处理、双周期交叉体内试验,或采取平行试验设计; 单次给药、四向完全重复交叉体内试验; 单次给药、平行试验设计。 其中绝大部分药品推荐第一或第二种试验设计。 FDA 还对个别药品进行特殊规定: 推荐琥珀酸索非那新片仅需进行单次给药、平行试验设计即可; 左甲状腺素钠片采取单次给药、四向完全重复交叉体内试验设计, 对左旋甲状腺素的测量可以缩短至给药后的48 h。 3 受试者选择 FDA 对生物等效性试验受试者的选择一般应符合以下要求: 年龄在18 岁以上( 含18 岁) ; 应涵盖一般人群的特征,包括年龄、性别和种族; 如果药物拟用于两种性别,那么研究入选的男性和女性应占相似的比例; 如果药物主要适用于老年人群,那么入选受试者应尽可能多地选择老年人( 60 岁以上的人) ; 入选受试者的例数应足以使生物等效性评价具有足够的统计学效力,但并不要求所划分的亚组也满足统计学要求( 一般不鼓励划分亚组进行统计分析) 。 《特定药物的生物等效性指导原则》对大部分长半衰期药物的女性受试者做了进一步的规定,规定受试者为健康男性和非孕、哺乳期女性; 规定受试者为健康男性和女性( 对女性不作特殊规定) 的品种仅有阿立哌唑片、阿奇霉素缓释混悬剂、阿托伐醌片、恩替卡韦片、枸橼酸托瑞米芬片、琥珀酸夫罗曲坦片、利塞膦酸钠片、苯妥英咀嚼片。 根据个别药品的特点,《特定药物的生物等效性指导原则》对一些药物作了特殊规定,见表2。
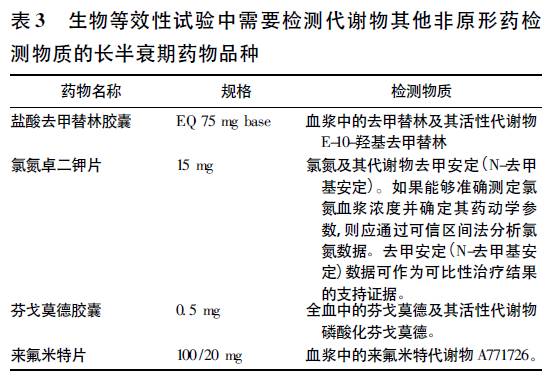
生物等效性试验豁免 除去17 个长半衰期药物不适合申请生物等效性试验豁免外,FDA《特定药物的生物等效性指导原则》长半衰期药物涉及的生物等效性试验豁免的情况涉及的生物等效性试验豁免的情况主要包括: 药物剂型相同,但规格不同,其活性成分和非活性成分的比例与已进行过BE 试验的规格相似的情况下,根据溶出试验和最大规格BE 试验可以申请一个或多个较小规格的BE 试验。 对于常释制剂,FDA 规定若满足以下条件,其他规格的体内生物等效性试验可申请豁免: 规定的规格生物等效性试验结果可接受; 所有规格体外溶解试验结果可接受; 所有规格制剂的处方比例相似。对于非常释制剂,FDA 规定可申请豁免条件为: 其他规格制剂的活性和非活性组分与体内研究所用受试制剂处方比例相似; 其他规格制剂的释药原理与体内研究所用受试制剂相同; 所有规格溶出试验结果可接受,并建议至少在3 种溶媒( 例如pH 1. 2, 4. 5 和6. 8) 中通过f2值判断其他规格的溶出曲线与生物等效性试验中受试制剂的相似,且建议绘制受试制剂和参比制剂所有规格的溶出曲线。 FDA《特定药物的生物等效性指导原则》涉及此范畴,可申请豁免其低规格的品种包括: 阿立哌唑口崩片、阿立哌唑片、氨苯砜片、醋甲唑胺片、枸橼酸他莫昔芬片、琥珀酸索非那新片、华法林片、来氟米特片、利塞膦酸钠片、氯氮卓二钾片、氯噻酮片、米氮平片、匹莫齐特片、特立氟胺片、托吡酯片、维莫德吉胶囊、西罗莫司片、盐酸胺碘酮片、盐酸氟西汀迟释胶囊、盐酸氟西汀胶囊、盐酸氟西汀片、盐酸氟西汀片、盐酸美金刚缓释胶囊、盐酸维拉佐酮片、左甲状腺素钠片、唑尼沙胺胶囊。 在FDA 颁布的2015 版《基于生物药剂学分类系统的口服固体速释制剂BA/BE 豁免原则( 草案) 》和2010 版相比,增加了BCS 3 类的BA/BE 豁免,并规定对于BCS1 类和3 类的药物,只要处方中的其他辅料成分不显著影响口服固体常释制剂中活性药物成分( API) 的吸收,则可申请生物等效性豁免。 生物药剂分类系统( BCS) 是基于药物本身的溶解度和渗透性,对其进行科学分类的一种系统。根据BCS 分类系统,药品被分为以下四类: 1 类: 高溶解性、高渗透性( High Solubility- High Permeability); 2 类: 低溶解性、高渗透性( Low Solubility-High Permeability) ; 3 类: 高溶解性、低渗透性( High Solubility-Low Permeability) ; 4 类: 低溶解性、低渗透性( Low Solubility-Low Permeability) 。其中,盐酸美金刚片属于BCS 分类豁免范围,豁免申请中应提供相应的BCS 分类和有关体外试验数据。 检测物质 FDA 一般推荐测定原形药物,而不是代谢产物。 原因是代谢产物的药时曲线主要反映代谢物的生成、分布和消除,而原形药物的药时曲线比代谢产物的能更灵敏地反映制剂的变化。 FDA 同时规定,如果由从原形药物产生的主要代谢产物满足以下两点,则可作为生物等效性试验的检测物质: 代谢产物基本上产生于进入机体循环系统以前,如首过效应、肠壁细胞内、肠道内代谢等。 代谢产物显著影响药物的安全性和有效性。 FDA《特定药物的生物等效性指导原则》要求检测代谢物和其他非原形药检测物质的长半衰期药物品种,见表3。
参比制剂选择 参比制剂选择是生物等效性试验的关键点之一。 为了避免由于参比制剂使用的不同而可能导致的各仿制品之间发生显著的差异,FDA 对于参比制剂的选择很明确,在橙皮书的处方药及非处方药目录中,FDA 规定了参比药品目录。 在参比目录中对每个品种的参比药品都提供了明确的信息,并且提供了特定药厂和特定规格等信息。 故此,在FDA《特定药物的生物等效性指导原则》中对参比制剂的信息未做重复描述。 剂量倾泻试验 有些调释制剂与含乙醇饮品同时服用,会导致调释制剂发生剂量倾泻等现象,产生不良后果。 FDA 目前要求体外研究时在溶出介质中添加不同浓度的乙醇进行额外的溶出度试验,如盐酸美金刚缓释胶囊为属于该类的长半衰期药物品种。 结语 长半衰期药物消除期较长,问题复杂。 有些药物的半衰期有长达40 d 以上,按照规定其清除期接近一年( 7 倍半衰期的时间) 。 根据药物特点,FDA《特定药物的生物等效性指导原则》针对具体长半衰期药物推荐了多种试验设计方案,并给药方式、试验设计、受试者选择、给药条件、检测物质选择、豁免条件、体外溶出试验等多个方面进行规定。 本文就FDA《特定药物的生物等效性指导原则》中关于长半衰期药物的生物等效性试验进行详细分析介绍,希望对我国仿制药质量与疗效一致性评价工作的顺利开展提供借鉴和帮助。 请复制以下链接,下载PDF版原文。 https://pan.baidu.com/s/1bHpvL8 说明 来源:中国药学杂志2017 年1 月第52 卷第2 期 Chin Pharm J,2017 January,Vol. 52 No. 2 本文由凡默谷原创排版与编辑,如转载,请注明来源 ↓↓↓ 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |