体外转录(IVT)快速上手 |
您所在的位置:网站首页 › 转录过程的视频 › 体外转录(IVT)快速上手 |
体外转录(IVT)快速上手
|
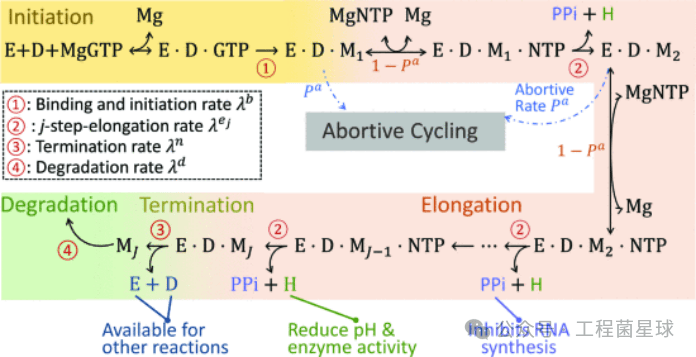
转录起始不需要引物,在此期间,RNA聚合酶结合在启动子上以后,使启动子附近的DNA双链解旋并解链,以促使底物核糖核苷酸与模板DNA的碱基配对。转录起始就是RNA链上第一个核苷酸键的产生。镁离子通过支持RNAP的活性,稳定RNAP-DNA复合物,促进NTP与RNAP的结合,在IVT过程中发挥关键作用。 一旦进入转录延伸阶段,底物NTP不断被添加到新生RNA链的3’-OH端,随着转录泡复合体与RNA聚合酶沿着DNA模板向前移动,DNA双螺旋持续解开,暴露出新的单链DNA模板,新生RNA链的3’端不断延伸,在解链区形成稳定且持续的酶伸长复合物。而在解链区的后面,DNA模板链与其原先配对的非模板链重新结合成为双螺旋,RNA链被逐步释放。 在遇到终止子序列时,RNA聚合酶和DNA模板之间的相互作用开始被破坏,转录终止。此时,RNA 链中不会继续添加互补 NTP,RNA聚合酶也不再形成新的磷酸二酯键,DNA恢复成双链状态,而RNA聚合酶和RNA链都被从模板上释放出来[2-3]。 02 IVT反应关键工艺参数 IVT是个复杂的动态反应过程(图2),影响因素除T7 RNAP、NTP、DNA模板以外,转录buffer中的各种成分也是制约IVT反应的关键工艺参数。
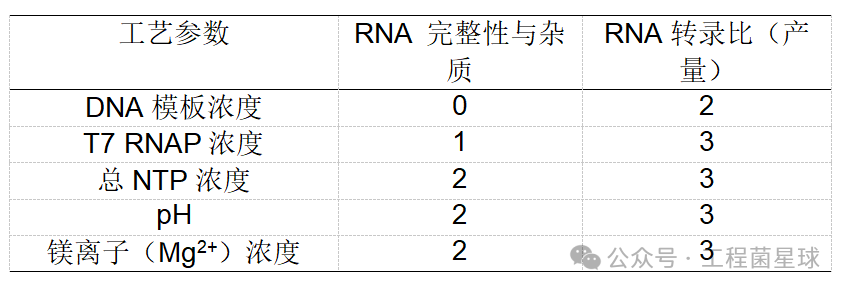
图2IVT过程的分子反应示意图(参考文献[1]) (E-RNA聚合酶、D-DNA模板、M- RNA复合物/产物) 表1为文献已报道的部分关键工艺参数对IVT反应的影响程度。下文菌菌将依次从关键原料以及转录buffer中的逐个因素,深入梳理各参数对于IVT反应的影响情况。 表1关键工艺参数对IVT反应的影响情
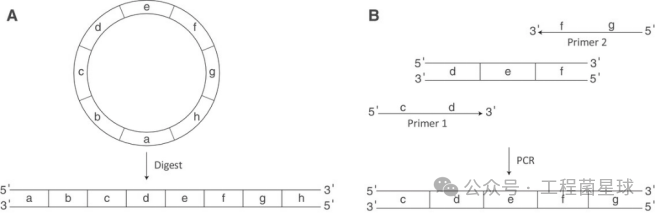
注:影响等级由0~3依次变高。 2.1 DNA模板 DNA模板设计是成功转录的一个组成部分。mRNA 的 IVT 需要一个 DNA 模板,该模板使用上游 RNA 聚合酶启动子位点编码所需信息。模板可以是线性化质粒或PCR产物的形式。 转录模板必须包含 T7 RNA 聚合酶启动子序列、5'-UTR、ORF 和 3'-UTR。poly(A)尾部可以包含在质粒中,或通过PCR添加,或通过酶促多聚腺苷酸化在转录后添加。质粒设计必须包括一个独特的限制性内切酶切割位点,用于在所需 3′-末端下游进行线性化。 在IVT反应中,DNA模板浓度应该足够高,以保证不会限制反应速率,一般应使用高于 40 nM 的 DNA 浓度来保证最佳IVT生产。
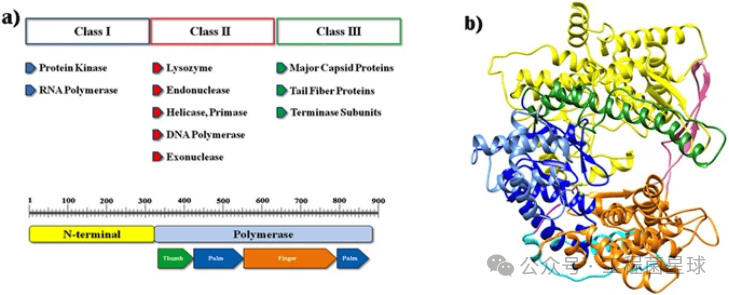
图3 DNA 模板结构示例(参考文献[4]) 2.2 T7 RNAP T7 RNA聚合酶是一种来自 T7 噬菌体的 RNA 聚合酶,可催化 DNA 以 5'→3' 方向形成 RNA。T7 聚合酶具有极高的启动子特异性,仅转录 T7 启动子下游的 DNA。如图4所示,T7线性基因组的关键基因可以分为三大类,并且这三大类基因在T7感染周期的不同阶段进行表达:I类基因在感染早期表达,为噬菌体生长建立有利条件;II类是主要参与DNA复制、蛋白编码的基因;III类基因则在噬菌体生长的后期表达,主要编码结构基因。T7RNAP 由 N 端(残基 1-325)和聚合酶(残基 326-883)结构域组成[6-7]。 为保证IVT转录比,应添加一定活性的T7 RNA聚合酶;此外,缓冲液中的pH、镁离子等也会影响T7 RNA聚合酶的活性,详见下文。
图4T7 RNA聚合酶结构(参考文献[5]) 2.3 NTP浓度 如前所述,底物浓度和辅助因子之间存在密切关系,如NTP和Mg2+形成复合物添加到新生mRNA 链中。NTP浓度必须足够高以促进反应。然而,超过一定值的浓度增加则对反应没有显著影响。 现有文献报道的数据为,NTP浓度高于7mM对mRNA的产生有积极影响。 表2不同NTP浓度下IVT反应产生mRNA的情况 2.4反应温度 现有文献尚未报道反应温度与IVT的直接关系,但温度确实会影响酶与模板启动子的结合,一般IVT反应温度应使用至少为37°C,建议在37°C~44°C之间。同时,如图5所示,高温还可以减少dsRNA的形成,降低产品的免疫原性。此外,在温度控制中应该保证良好的热传导,不完全传热会导致反应产率低,一般混合水浴是最佳选择。
图5IVT 中 dsRNA形成的示意图(参考文献[8]) 2.5 转录buffer体系中的影响因素 除了上文提到的关键原料,常用的10×转录buffer体系中也有诸多影响IVT反应的因素。10×转录buffer体系一般组成为Tris盐酸盐(Tris-HCl)、氯化镁(MgCl2)、二硫苏糖醇(DTT)、亚精胺,其中Tris-HCl buffer的pH一般为8.0(25℃)。 2.5.1 pH值 pH值反映了氢(H)离子的浓度,在IVT过程中对酶与DNA模板的结合、酶活性和RNA降解速率起着关键作用。因此,在 IVT 过程中持续监测和控制 pH 值并评估其影响至关重要。T7 RNAP 在 7.9∼ 8.1 的 pH 范围内表现出最佳活性,甚至某些野生型T7RNAP的最佳酶活性谱pH值在7.9~9.5。但在IVT反应期间以及任何下游过程中,应将pH值保持在7~8的范围内,以避免mRNA的碱性水解。如表3所示,为不同pH下,IVT反应产生mRNA的量。 表3不同pH下IVT反应产生mRNA的情况 2.5.2 Mg2+浓度与无机焦磷酸酶 Mg2+浓度被发现是有效转录的关键因素,它是T7 RNAP酶与DNA模板结合的媒介,同时Mg2+也需要与NTP复合物形成与RNA链的磷酸二酯键。当游离Mg2+浓度低于 5 mM时,转录速率和掺入的NTP的效率会大大降低。然而,Mg2+浓度过高也有利于RNA降解。一般建议浓度范围为40-60mM 以促进mRNA 的合成。 在IVT过程中,每个NTP的添加都会导致无机焦磷酸离子和质子H的释放,而无机焦磷酸盐作为反应的副产物,其可与Mg2+发生螯合而形成沉淀物焦磷酸镁(Mg2PPi),进而直接抑制反应速率。因此,为保证RNA产量,IVT反应中常需要加入无机焦磷酸酶来水解PPi,以避免无机焦磷酸盐的过多累积,并确保镁离子留在溶液中,从而优化 T7 RNAP 酶活性[9-10]。 2.5.3亚精胺 亚精胺是一种脂肪族多胺,对核酸具有高亲和力,可中和负电荷,从而促进DNA的凝聚和聚集。在IVT反应中,亚精胺在转录起始中起重要作用,可使 RNA 聚合酶从质粒模板上解离,作用于 RNA 合成的起始和延伸阶段,刺激转录反应。同时,高浓度的亚精胺也会抑制反应。一般建议浓度为1 ~ 3 mM 之间,以保证促进 mRNA 的IVT进程。 2.5.4 DTT DTT是一种还原剂,在转录过程中对维持酶的活性起着重要作用。但现有研究表明,超过10 mM DTT不会改善较短RNA的合成。反应缓冲液需要新鲜的DTT才能获得最佳的酶活性。氧化缓冲液可能导致低产量或低 mRNA 质量,并增加截短转录本的产生。因此,一般建议将DTT分装后进行储存,或者对10×buffer采用现用现配的原则[11]。 2.6 其他影响因素 除上述因素外,反应中应避免使用反应抑制剂,如RNase和EDTA。EDTA作为Mg2+螯合剂,只在反应终止时加入。RNase应在全程避免,包括使用RNase-Free的物料,及时更换手套等。同时,也有文献报道将通过添加尿素(0.8-1.2M)也可以降低产物中的dsRNA 含量。此外,有研究发现二甲基亚砜(DMSO)可将转录效率提升高15%,但10% DMSO 对于 RNA 产量没有影响,且对于小 RNA 分子,添加 DMSO 会导致全长转录本和流产转录本生成更快[12]。 03 总结 本文从关键反应原料(DNA模板、T7 RNAP、NTP)、反应温度、转录buffer中等因素,全面梳理了IVT的重要工艺参数,便于大家快速理解IVT反应原理、并针对性地优化IVT反应体系。 当前技术下,实验室规模的IVT反应本身没有难度可言,但是如何实现产量的最大化、保证完整性和纯度,同时减少副产物的形成,以达到最佳的反应工艺,这其中为摸索IVT关键工艺参数、交叉影响因素而涉及的实验次数就显得非常庞杂、数量巨大。 参考文献 [1] K. Wang, W. Xie and H. Zheng, "Stochastic Molecular Reaction Queueing Network Modeling for in Vitro Tranion Process," 2023 Winter Simulation Conference (WSC), San Antonio, TX, USA, 2023, pp. 1900-1911. [2]Kochetkov SN, Rusakova EE, Tunitskaya VL. Recent studies of T7 RNAPolymerase mechanism. FEBS Lett. 1998 Dec 4;440(3):264-7. [3]Arnaud-Barbe N, Cheynet-Sauvion V, Oriol G, Mandrand B, Mallet F. Tranion of RNA templates by T7 RNAPolymerase. Nucleic Acids Res. 1998 Aug 1;26(15):3550-4. [4]Henderson JM, Ujita A, Hill E, Yousif-Rosales S, Smith C, Ko N, McReynolds T, Cabral CR, Escamilla-Powers JR, Houston ME. Cap 1 Messenger RNA Synthesis with Co-tranional CleanCap® Analog by In Vitro Tranion. Curr Protoc. 2021 Feb;1(2):e39. [5]Borkotoky S, Kumar Meena C, Bhalerao GM, Murali A. An in-silico glimpse into the pH dependent structural changes of T7 RNAPolymerase: a protein with simplicity. Sci Rep. 2017 Jul 24;7(1):6290. [6]Arnaud-Barbe N, Cheynet-Sauvion V, Oriol G, Mandrand B, Mallet F. Tranion of RNA templates by T7 RNAPolymerase. Nucleic Acids Res. 1998 Aug 1;26(15):3550-4. [7]Gholamalipour Y, Karunanayake Mudiyanselage A, Martin CT. 3' end additions by T7 RNAPolymerase are RNA self-templated, distributive and diverse in character-RNA-Seq analyses. Nucleic Acids Res. 2018 Oct 12;46(18):9253-9263. [8] Wu MZ, Asahara H, Tzertzinis G, Roy B. Synthesis of low immunogenicity RNA with high-temperature in vitro tranion. RNA. 2020 Mar;26(3):345-360. [9] Kern JA, Davis RH. Application of solution equilibrium analysis to in vitro RNA tranion. Biotechnol Prog. 1997 Nov-Dec;13(6):747-56. [10] Kern JA, Davis RH. Application of a fed-batch system to produce RNA by in vitro tranion. Biotechnol Prog. 1999 Mar-Apr;15(2):174-84. [11]Rosa SS, Nunes D, Antunes L, Prazeres DMF, Marques MPC, Azevedo AM. Maximizing mRNA vaccine production with Bayesian optimization. Biotechnol Bioeng. 2022 Nov;119(11):3127-3139. [12]Francis C, Frida J P, Thanh-Huong B, Alicja M, Artem K, Jérémie P, Sven Even B. Urea supplementation improves mRNA in vitro tranion by decreasing both shorter and longer RNA byproducts. RNA Biol. 2024 Jan;21(1):1-6. 生物制品微信群! 请注明:姓名+研究方向! 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】