【学术分享】浅谈新版《医疗器械分类目录》实施后涉及管理类别调整的第二类敷料类产品在延续注册过程中的常见问题 |
您所在的位置:网站首页 › 超市产品类别分类 › 【学术分享】浅谈新版《医疗器械分类目录》实施后涉及管理类别调整的第二类敷料类产品在延续注册过程中的常见问题 |
【学术分享】浅谈新版《医疗器械分类目录》实施后涉及管理类别调整的第二类敷料类产品在延续注册过程中的常见问题
|
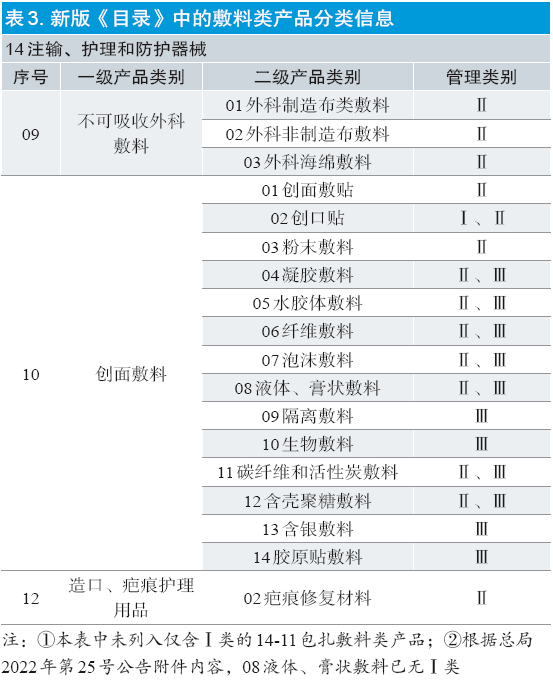
直至新版《目录》的发布,通过类别的分级管理,敷料产品的种类和管理类别变得更为具体(见表3)。原6864敷料类产品对应新版《目录》中的14-09 不可吸收外科敷料、14-10 创面敷料和14-11 包扎敷料(管理类别为Ⅰ类,本文不讨论)。此外,新增的12-02 疤痕修复材料也属于本文中讨论敷料的范畴。
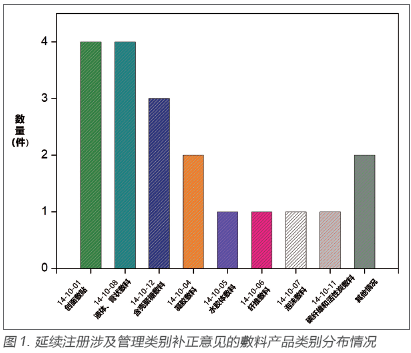
可以看出,相对于02 版《目录》而言,除可吸收性止血、防粘连材料的管理类别没有调整,仍作为Ⅲ类医疗器械进行管理外,其余的敷料类产品,从仅有Ⅰ类和Ⅱ类的2 个管理类别,衍生出根据不同的产品特性划分的更多更复杂的管理类别情况,部分新增的新型敷料还涉及Ⅲ类。反映在市场上,会出现即便产品名称相同,但产品的管理类别不同的现象。例如,国家食品药品监督管理总局曾在2010 年对一“泡沫敷料”产品作出分类界定通知(国食药监械[2010]111号[6]),明确将该类产品作为Ⅲ类医疗器械管理。但在新版《目录》实施后,原按此分类界定通知以Ⅲ类注册的产品如果符合新版《目录》中14-10-07 管理类别为Ⅱ类的情形,则可以按照Ⅱ类医疗器械申请延续注册。同理,应该会有较多的敷料类产品在新规实施后会涉及此类问题。仍以广东省的数据为例(图1),延续过程中涉及管理类别发补的问题主要集中在10-01 创面敷贴、10-08 液体和膏状敷料和10-12 含壳聚糖敷料上,其他类别则申报量较少,但也均有涉及,分布也相对平均。还有其他一些特殊情况的,如申请人宣称产品的分类属18-01-13 妇产科手术器械- 凝胶,但产品名称包含“敷料”,此类产品在延续时审评均提出了管理类别的补正意见。
2.延续注册过程中的常见问题 依据《广东省第二类医疗器械注册证延续办事指南》受理条件的要求:(一)原医疗器械注册证为广东省药品监督管理局核发,申报延续注册的产品依据《医疗器械分类目录》或分类界定通知等文件,管理类别属于二类医疗器械;(二)申请人是在广东省辖区范围依法进行登记的生产企业,原注册证为国家总局核发的三类医疗器械证,延续时产品类别依据《医疗器械分类目录》或分类界定通知等文件调整为二类医疗器械。此处需要强调的要求是,无论是原为Ⅱ类医疗器的产品,还是原为Ⅲ类调整为Ⅱ类的产品,均需要在延续注册申请的时候提交产品仍可以断定为Ⅱ类的依据,特别是对于分类不清或存在争议的产品。 能够作为分类依据的文件有《医疗器器械分类目》及其动态调整表、分类界定结果汇总文件、《免于临床评价医疗器械目录》以及其他总局发布有关某一特定类别产品的分类界定通告文件等。如果申请人未能提供前述文件作为明确分类依据的,将会涉及管理类别的补正意见。 2.1 未明确产品的二级产品类别 申请人在申请表或提交自行判断的分类说明文件仅说明了产品所属的子目录或一级产品类别,未列明产品所属的二级类别并提供完整的分类编码,故无法判定其在新版《目录》中的具体位置,以判定管理类别。此时,作为主体责任人,申请人应当对产品的属性和管理类别先进行自我判断并在申请延续注册时进行明确,审评机构才能够对申请人所提供分类依据的适宜性进行评估。 2.2 产品名称超范围表述或不规范 申报延续的产品名称中包含一些超出目录范围或不规范表述,而这些表述会影响到产品管理类别的判定。例如名称中“功能性”或“止血”等词语,“功能性”表述意味着产品的功能不具体、不明确,可以是某种功能也可以是某几种功能,而具有“止血”功能的敷料类产品则还需要进一步通过确认其所含成分是否会被人体吸收来判断其属于Ⅱ类还是Ⅲ类。 2.3 产品适用范围超范围表述或不规范 申请人虽明确了产品的分类编码,但前文中也有提到,部分敷料类产品在同一二级类别下有不同的管理类别。因此,这类产品当其适用范围和结构组成与新版《目录》或分类界定文件中差异较大,且未能明确能否用于慢性创面等涉及第三类产品界定的问题时,通常会涉及发补。例如适用范围中出现“各种创面”“溃疡”和“烧烫伤”等词语,“各种创面”属于夸大和超范围表述,皮肤性“溃疡”一般属于慢性创面,而“烧烫伤”也因其具有不同的分级需要分级限定。 2.4 产品结构组成涉及可吸收成分或药物 申报产品的结构组成超出新《目录》中产品描述中列出的材料或成分,根据目前的水平认知无法确认其是否会被人体吸收或发挥药理学作用时,申请人需提供相应的分类依据或支持的资料。如发挥药理学作用机制的,则应按相关要求做好分类界定工作,按药械组合产品申报或不作为医疗器械管理。 2.5 分类界定通知文件与产品信息不符 该问题分为两种情形,第一是在申报资料阶段,申请人提交申报产品以往的分类界定通知文件,但文中的产品名称、预期用途或产品描述等信息与申报产品注册证中载明内容差异较大,申请人无法提供合理解释说明,且经审评判断仍存在管理类别不明确问题的,仍会对产品的分类作出补正意见。第二是在补充资料阶段,申请人将补正期间取得的分类界定告知文件作为补充资料,此时,如存在产品描述信息差异的,也应提供充分合理的解释依据。通常来讲,其内容应保持一致,对于无法提供合理解释的,仍属产品管理类别不明确。 2.6 涉及降类产品延续的问题 已取得Ⅲ类注册证的产品在向原审批部门申请延续注册过程中,原审批部门对申报产品的管理类别作出补正意见,如建议申请人按Ⅱ类医疗器械向所在省市的药品监督管理部门申请延续。此时,建议申请人提交申报前与监管机构的既往沟通记录,即原审批部门对于申报产品申请延续注册时作出的有关分类的补正意见以及申请人的沟通回复(如适用)等作为按Ⅱ类申请延续时分类依据的支持性资料,以利于技术审评机构综合作出判断。 注册人依据现行法规自行判断申报产品属于管理类别由Ⅲ类调整为Ⅱ类,没有向原审批部门申请延续注册,直接向相应的食品药品监督管理部门申请注册延续。如果未能提交充分的分类依据,准确的分类编码信息、或所提供的分类信息与产品实际特征不符等,当技术审评人员依据申请人所提供现有申报产品资料判定其管理类别调整为第二类仍不充分时,同样会对申报产品的管理类别作出补正意见。 3.讨论与思考 此外,笔者在审评一些管理类别由Ⅲ类调整为Ⅱ类的案例时发现,由于此类产品的注册证原批准部门与改变类别后的审批部门不同,即申报系统不同,故当审评人员欲了解申报产品的首次核发或历次注册申报的具体信息时,仅能依赖于申请人所提供的申报材料,从而缺少了一些可以依据原产品的注册信息而判断产品管理类别的其他依据,进而可能会造成一些不必要的分类发补。由此引发思考,是否可以开发建立一种适用于类别转换产品的注册申请平台或申报资料共享平台,使这类产品的注册申报资料具有一定的连续性,从而在原注册审批部门及现审批部门可以实现同步,提高审评效率的同时也能够缩短申请人的注册周期。 参考文献略 【学术分享】国内外体外诊断试剂行业发展现状及趋势 【学术分享】基于数据分析概述医疗机器人产业发展现状及未来趋势 【学术分享】医疗器械生产洁净区送排风系统及其检查要点 【学术分享】浅谈美国FDA 高风险医疗器械审批要求的最新调整思路 【学术分享】医疗器械生产质量管理规范核查常见问题与浅析 【学术分享】第二类医疗器械临床评价方法研究 本刊简介 《中国医疗器械信息》杂志是在国家新闻出版总署登记注册的面向全国发行的国家级正式刊物,是医疗器械行业内唯一一本由中国医疗器械行业协会主管的全国性综合性医疗器械科技类杂志。杂志于1995 年创刊,是“中国学术期刊综合评价数据库(CAJCED)统计源期刊”、“中国期刊全文数据库(CJFD)全文收录期刊”、“中国核心期刊(遴选)数据库收录期刊”、“中文科技期刊数据库收录期刊”、“中文生物医学期刊数据库(CMCC)收录期刊”。 《中国医疗器械信息》杂志为大度十六开(210mm×285mm)半月刊,采用进口高品质铜版纸,四色全彩印刷。出版日期为每月15,25 日。《中国医疗器械信息》办刊资质完备,有邮发资格(邮发代号82-256), 发行方式包括:邮局订阅、自办订阅、赠阅发行和会议发行。发行量为平均每期50,000 册,遇大型展会和学术活动还将增量发行。 真诚欢迎业界专家学者、医疗设备的应用者、研发设计人员为本刊撰稿,共同把刊 物办好。 投稿方式 投稿邮箱: [email protected] [email protected]返回搜狐,查看更多 |
【本文地址】