经验分享:CAR |
您所在的位置:网站首页 › 质粒kan › 经验分享:CAR |
经验分享:CAR
|
第一代青铜段位:针对的是肿瘤的CD19或CD20抗原,信号转导区由胞内的CD3ζ链组成。第一代CAR-T细胞在体内生存能力不强,也不能产生足够的IL-2,仅具有限的抗肿瘤作用。 第二代白银段位:信号转导区加了一个共刺激信号分子(如CD28、4-1BB)。与第一代相比,第二代CAR-T产生的IL-2得到大幅度加强,杀伤肿瘤的能力得到了提升,但是疗效不够持久。 第三代黄金段位:加了两个共刺激信号分子(CD28、4-1BB或CD134),提高了CAR-T的增殖能力和杀伤性。 第四代白金段位:在第三代CAR-T的基础上又加了细胞因子或共刺激配体(如IL-12/IL15/anti-PD-1等),可以通过局部释放细胞因子来调节微环境并招募免疫效应细胞杀伤肿瘤,在微环境的免疫抑制和实体瘤方面发挥一定的促杀伤作用。第四代CAR-T细胞的扩增能力更强,在体内停留的时间也更久。 第五代砖石段位——通用CAR:由于目前大部分CAR-T细胞都是利用患者自身的T细胞来产生的,而患者与患者之间存在个体差异,制备T细胞是一个昂贵且耗时的过程。除此之外,每种CAR具有固定的抗原特异性仅能靶向特定的肿瘤表位,因此科学家们致力于开发一种通用型CAR-T细胞,生产一种现成的(off-the-shelf)即用型治疗剂。 通用CAR-T是使用ZFNs,TALENs以及CRISPR/Cas9等基因编辑工具,敲除异体T细胞上的TCR、MHC以及相关信号通路基因,从而防止异体型CAR-T的宿主排斥反应。此外敲除PD-1与CTLA4等T细胞抑制信号分子,能够进一步增强CAR-T细胞的功能。通用CAR-T并不依赖于病人的淋巴细胞,是非定制的细胞疗法,能够现货供应为更多的病人提供治疗。 CAR-T疗法的流程利用白细胞分离术收集患者的T细胞,然后在体外进行T细胞活化,通过装备CAR基因的慢病毒载体,将CAR基因转入T细胞从而CAR-T细胞,CAR-T细胞经扩增纯化然后回输患者体内进行治疗。具体过程如下:
慢病毒载体是由三个包装质粒和一个表达质粒(也称穿梭质粒)瞬间共转染293T细胞,通过克隆筛选获得稳定组装表达高滴度慢病毒载体的细胞株,经发酵纯化后获得一定质量要求的慢病毒。 慢病毒载体包装四质粒系统质粒系统 慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的目的,己成为表达外源基因或外源shRNA的常用载体之一。慢病毒来源于HIV-1,经改造成为安全的慢病毒载体,先从HIV-1基因组来阐述改造过程。
上图是HIV-1病毒结构及其基因组,其中gag基因编码p17,p24核心蛋白;pol基因编码蛋白酶、整合酶、逆转录酶等,为病毒增殖所必需;env基因编码表面抗原gp160,gp120和gp41。tat 基因促进病毒基因转录和翻译。rev基因能增强gag和env基因的表达,以合成相应的病毒结构蛋白。vpu基因对HIV-1的复制、装配与成熟不可缺少。LTR包含了HIV-1的启动子和增强子区段,缺少了HIV-1无法完整复制。 首先科研工作者敲除了对HIV-1复制及致病必不可缺少的tat、rev、 vif、vpr,vpu和nef基因;另外,在5和3’LTR缺失了对病毒复制和基因转录起重要作用的U3序列,使HIV-1成为自灭活载体,丧失了复制能力。HIV-1的env基因编码的包膜蛋白主要侵染表达CD4受体的T细胞,为了扩大感染细胞的类型,用水泡性口炎病毒糖蛋白(VSV-G)替代了env编码的包膜糖蛋白,这样不仅使HSV-1丧失了复制性及致病性,还大大提高了病毒的嗜性范围。 最后,为了进一步提高安全性,将表达CAR分子的目的基因、rev基因、gag和pol基因及VSV-G基因分别用4个质粒携带,慢病毒包装只需把上述4个质粒共同转染到293T细胞中,三个质粒分别表达病毒复制组装需要的元件,病毒就这样在293T细胞中包装出来了。
常用的慢病毒包装质粒生产菌株为大肠杆菌,慢病毒包装质粒骨架部分带有细菌复制子(ori),能在大肠杆菌内高效稳定地复制。质粒还带有抗生素抗性基因,用于在宿主菌中生长的抗性筛选。质粒应避免使用β-内酰胺类抗生素抗性基因(如氨苄),可考虑卡那霉素抗性基因。慢病毒包装质粒还包括一些调控元件,以促使基因表达和质粒的稳定,常用启动子有CMV、SV40、EF-1α等,其中CMV、SV40应用较为广泛。转录终止子常用牛生长激素(BGH)、SV40等。 典型的质粒大规模制备过程包括发酵、细胞收获、细胞裂解、澄清浓缩和柱层析等步骤,如下:
重组E.coli高密度发酵常用LB培养基,使用大豆蛋白胨,可以避免使用动物源性原料。酵母提取物也必须在没有动物源成分的情况下生产。在高密度培养的发酵罐中,诸如培养基组成分、温度、pH值、溶解氧、搅拌速度等影响菌体生长及质粒产量的因素都要到控制及优化,发酵优化后质粒产量可达摇瓶的10-50倍。Voss等人描述了使用脱脂甘油培养基大肠杆菌高密度生产质粒的方法。 离心或微滤等技术用于收集发酵液中大肠杆菌。后通过裂解,如碱性裂解或热裂解来释放质粒。碱裂解法是目前应用最为广泛的方法,将菌液置于碱性强阴离子溶液中,使宿主DNA 和蛋白质变性,质粒因其特有的环状超螺旋结构,仅破坏碱基对之间的氢键。当pH恢复至中性质粒会发生复性,而宿主DNA不能完全复性,与菌体碎片和已变性的蛋白质结合在一起,采用离心法就能将质粒从菌体裂解液中分离出来。另外需要特别注意的是碱裂解要均匀,以防止局部过碱,质粒在pH12以上无法复性。 采用超滤法、切相流过滤、沉淀等方法可除去细胞碎片杂质蛋白质、低分子量核酸等杂质,同时也起到了浓缩质粒的作用,为后续柱纯化做准备。其中中空纤维切向流过滤可高效地用于菌体或质粒收集,相比离心其可以连续过滤,更适合大体积料液的处理,同时由于其开放式流道的低剪切特性,可保护质粒的完整性和超螺旋结构。 色谱法是大规模纯化质粒DNA 常用方法,能有效除去宿主基因组DNA、RNA、宿主蛋白、氨基酸、多糖、内毒素等组分。亲和层析具有优异的选择性和通用性,是纯化质粒的有效工具,亲和色谱能有效分离开环及线性质粒。离子交换色谱可用于质粒不同拓扑形态的分离,在药用质粒纯化中应用最为广泛。目前市场上大部分的纯化试剂盒都是以离子交换色谱固相柱为基础,通过pH和盐浓度的准确平衡来获得高纯度的DNA。体积排阻色谱可分离出一些小分子的杂质。为提高上述纯化方法的纯化效果常采用RNase将高分子量RNA降解为寡核苷酸。 质粒的质量控制质粒作为胞内生物大分子,生产中存在大量杂质,如基因组DNA、RNA、菌体蛋白、内毒素、菌体多糖等。在质粒终产品中的杂质均不利于转染,因此,需要将质粒中的杂质控制在一定水平。慢病毒包装质粒质量标准如下表所示。
在纯度方面,要将A260/A280控制在1.8-2.0之间,低于1.8说明质粒中存在蛋白污染,高于2.0说明质粒有降解或存在RNA污染。质粒DNA浓度可根据需要控制在一定范围内,这里需要说明的是在这里,质粒浓度高于5 mg/mL容易形成二聚体。 另外,典型的质粒有3种不同的构型:共价闭合环形的超螺旋结构(SC构型);一条链完整,另一条链上有一至数个缺口的开环所呈现的开环构型(OC构型);双链均断裂所呈现的线性构型(L构型)。OC构型及L构型由于单链或双链断裂导致质粒尺寸增大,导致转染效率低下,故需要控制其比例,慢病毒包装质粒要求超螺旋纯度大于90%。常用的质粒构型测定方法有琼脂糖凝胶电泳法(AGE)、离子交换法及毛细管凝胶电泳(CGE)。AGE法能分离SC、OC及L构型,但只是一种半定量分析方法;离子交换法(如DNA-NPR)可以实现各种拓扑形态质粒的基线分离,洗脱顺序为开环、超螺旋、线性和质粒二聚体,可以分析质粒的含量和拓扑形态,检测质粒的纯度和浓度。质粒不同的拓扑结构也可用毛细管凝胶电泳(CGE)进行区分,在CGE检测中,不同构型的质粒可被填充凝胶的毛细管在电场中实现分离而后进行光学检测。
荧光定量PCR是当前定量检测质粒中残留基因组DNA及RNA的常见方法,目前已有商业化试剂盒。另外,质粒中内毒素会很大的影响转染的效率,内毒素残留较高可能会导致转染失败,内毒素残留检测方法常用动态显色法。 小结近年来,随着免疫细胞治疗、基因编辑等技术手段在医疗领域的不断发展,细胞治疗产品为一些严重且难以治疗的疾病提供了新的治疗思路与方法,CAR-T细胞治疗已成为肿瘤治疗领域中新的国际研究热点,也不断取得令人鼓舞的进展。我国的CAR-T研究也呈现蓬勃之势,众多研究机构及医药公司开投入到了CAR-T产品的研发中,已有机构提交了CAR-T细胞治疗产品的临床试验申请。但我们也必须清醒地认识到CAR-T疗法还是一个新兴领域,人们尚未有足够的数据评估其潜在风险,CAR-T呈现个体化、始材料差异大及安全性评价复杂等问题。因此,如何提高CAR-T细胞治疗产品的安全性、有效性、质量可控性以及产品工艺一致性是每一个研发者需要面临的问题。一个完整的CAR-T细胞治疗产品的制备过程包括慢病毒载体的制备和CAR-T细胞产品的生产制备两个大的环节。而慢病毒的生产又包括质粒载体的生产制备和慢病毒的生产制备两个阶段。慢病毒载体由HIV-1改造而来,后续将着重介绍慢病毒载体的安全风险评估、生产制备及质量控制。(来自生物制药小编)返回搜狐,查看更多 |
【本文地址】
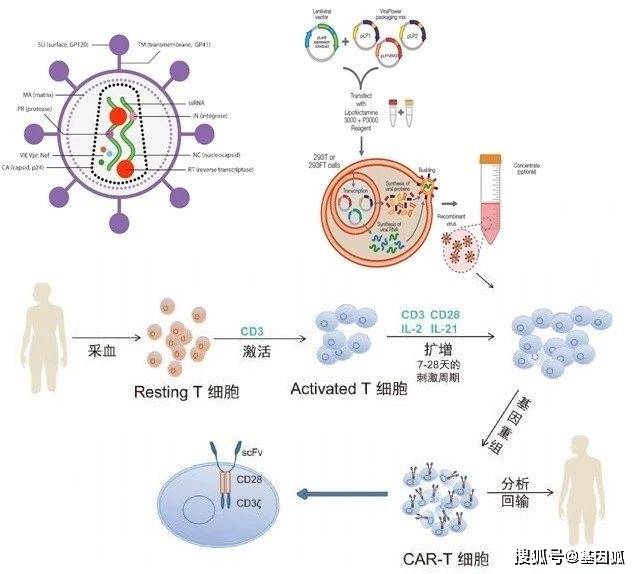 ▲图3. CAR-T生产工艺流程
▲图3. CAR-T生产工艺流程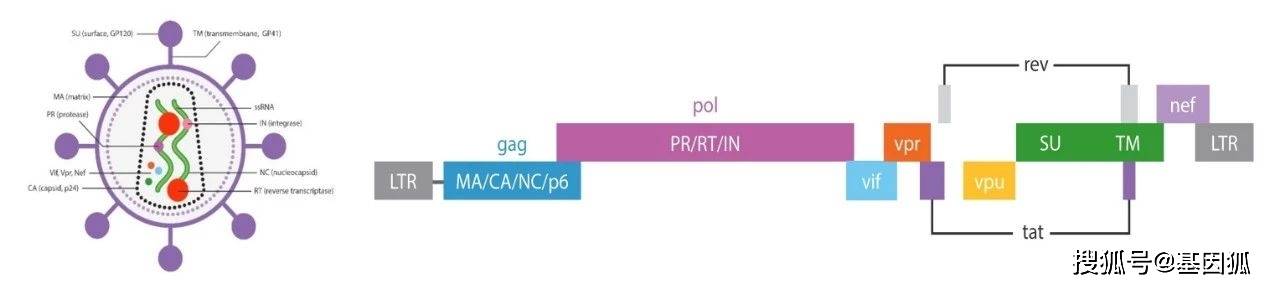 ▲图4. HIV-1及其基因组
▲图4. HIV-1及其基因组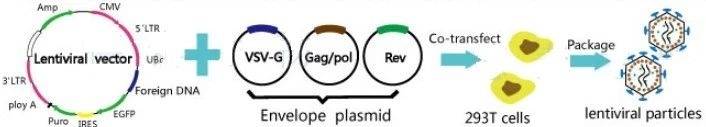 ▲图5. 慢病毒载体包装过程
▲图5. 慢病毒载体包装过程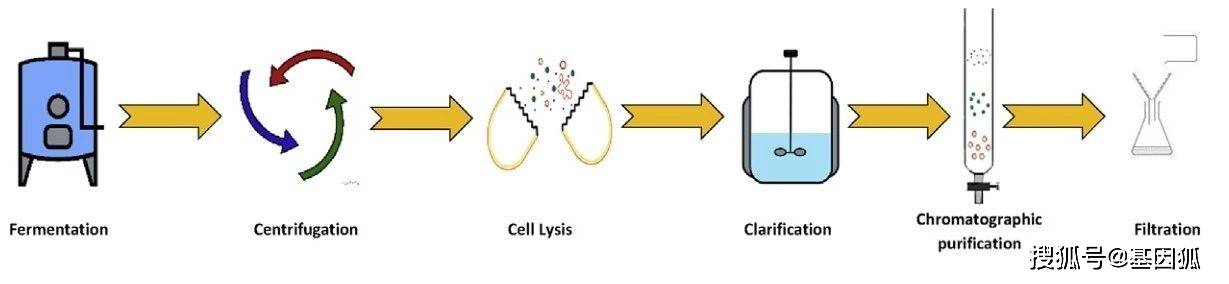 ▲图7. 质粒生产流程
▲图7. 质粒生产流程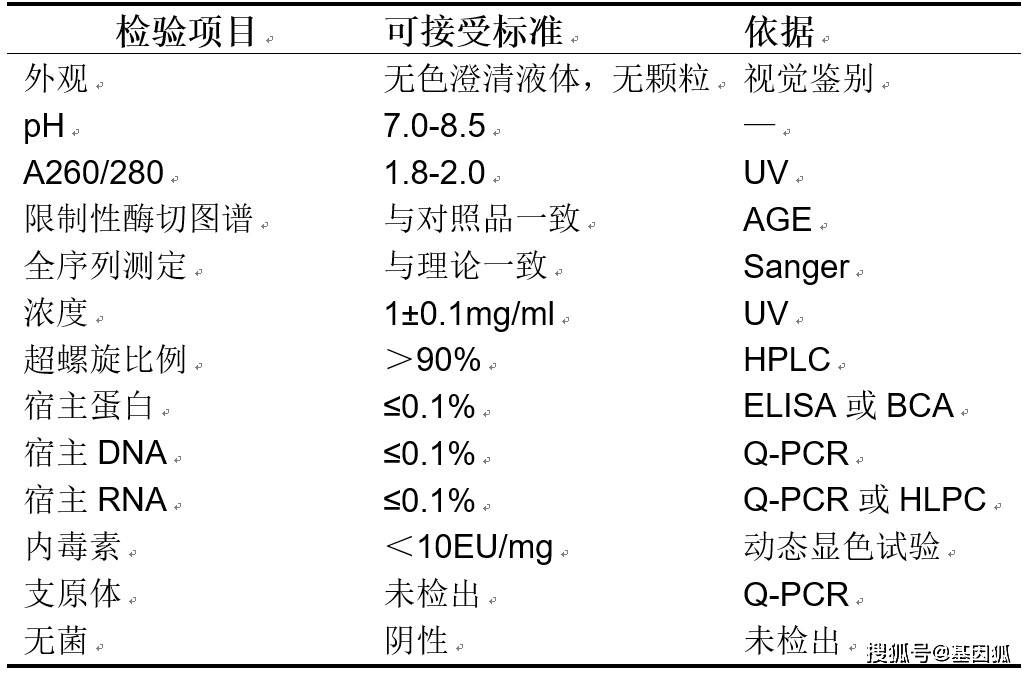 ▲表1. 慢病毒包装质粒质量标准
▲表1. 慢病毒包装质粒质量标准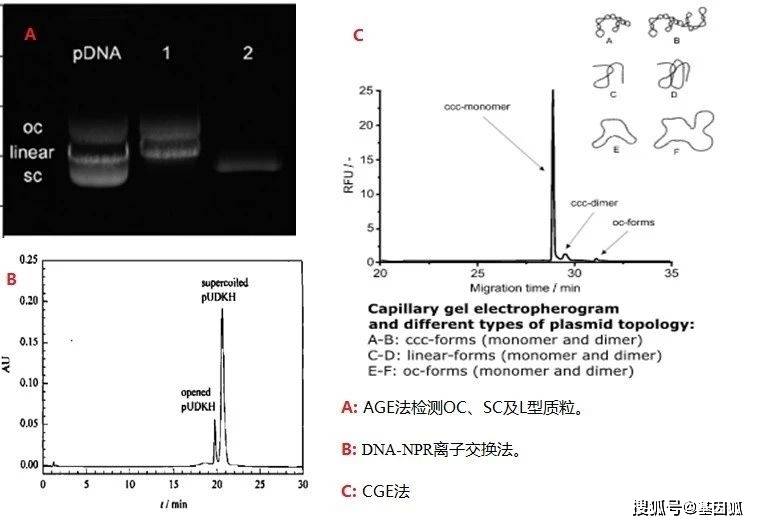 ▲图8. 各种拓扑形态质粒的分析
▲图8. 各种拓扑形态质粒的分析