【综述】贝达喹啉耐药分子机制研究进展 |
您所在的位置:网站首页 › 贝达喹啉代购 › 【综述】贝达喹啉耐药分子机制研究进展 |
【综述】贝达喹啉耐药分子机制研究进展
|
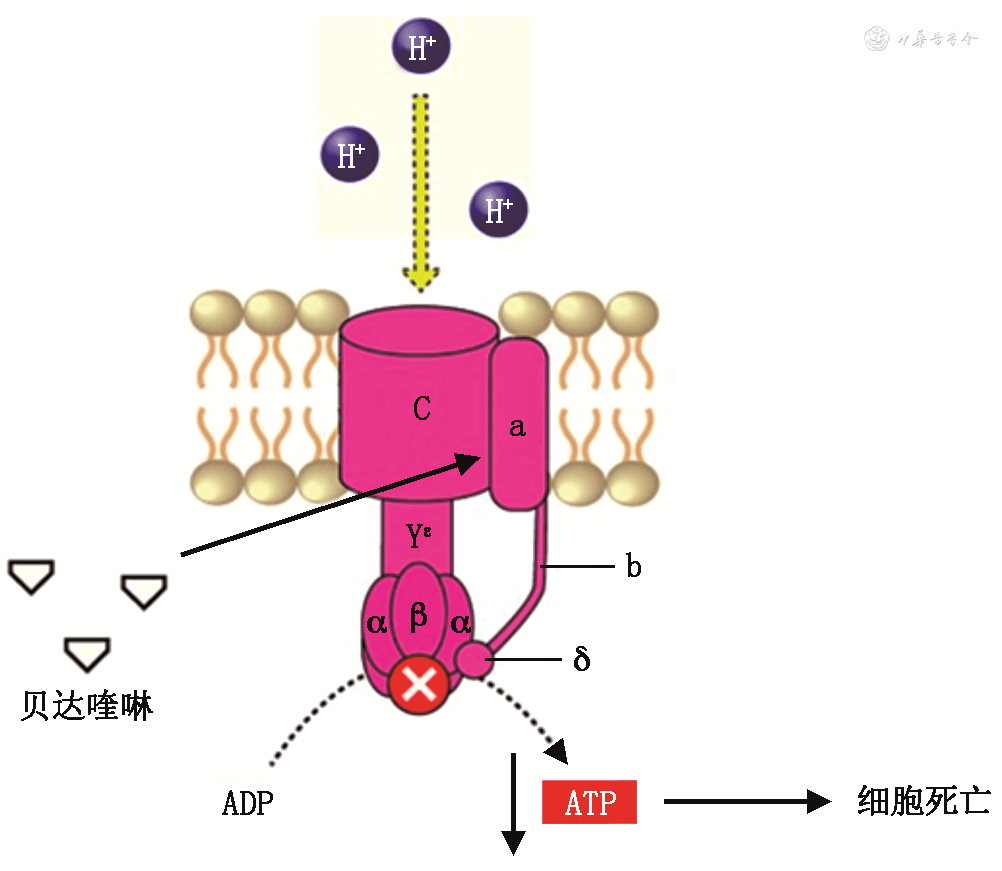
在不同NTM的体外实验中,贝达喹啉表现则有所差异。文献表明,在慢生长分枝杆菌( Slowly Growing Mycobacteria ,SGM)中,贝达喹啉对鸟分枝杆菌( M.avium )、溃疡分枝杆菌( M.ulcerans )和脓肿分枝杆菌( M.abscessus )具有抑菌作用 [ 22, 23, 24] ;在快生长分枝杆菌(Rapidly Growing Mycobacteria,RGM)中,贝达喹啉对龟分枝杆菌脓肿亚种( M.abscessus )和龟分枝杆菌( M.chelonae )具有抑菌作用;而石氏分枝杆菌( M. shimodei )、异种分枝杆菌( M. xenopi )对贝达喹啉具有耐药性 [ 25] 。 在NTM体内试验中,贝达喹啉的作用也有争议性。研究表明,在C57BL/6J小鼠模型中贝达喹啉对 M.avium 具有抑菌作用 [ 26] ;有临床研究报道了10例患有鸟分枝杆菌复合群( M. avium complex ,MAC)或 M. abscessus 的病例接受贝达喹啉治疗后,9例患者症状有所改善,4例患者的痰结核菌培养在6个月时转阴,但有2例患者出现了贝达喹啉获得性耐药 [ 27] 。另有一项临床研究对2例NTM伴HIV感染的患者使用贝达喹啉治疗后发现临床症状均有所改善且痰结核菌培养转阴,也未出现获得性耐药或疾病复发状况 [ 28] 。Erber等 [ 29] 报道了首例口服贝达喹啉成功治疗偶然分枝杆菌( M. fortuitum )引起的慢性伤口感染。 此外,有研究表明贝达喹啉对其他细菌抗菌活性较弱,如棒状杆菌( Corynebacterium )和幽门螺杆菌( Helicobacter pylori )的最低抑菌浓度(MIC)为4 mg/L;在革兰阳性菌中,诺卡菌( Nocardia )的MIC高于16 mg/L,肺炎链球菌( Streptococcus pneumoniae )、金黄色葡萄球菌( Staphylococcus aureus )的MIC均高于32 mg/L;在革兰阴性菌中,大肠杆菌( Escherichia coli )和流感嗜血杆菌( Haemophilus influenzae )的 MIC也均高于32 mg/L [ 30] 。因此,贝达喹啉是一种窄谱抗生素,目前研究发现其仅对分枝杆菌有效。 (二)贝达喹啉的作用机制 贝达喹啉主要通过抑制分枝杆菌三磷酸腺苷(adenosine triphosphate,ATP)合成酶的质子转移链来抑制分枝杆菌活性。ATP合成酶是一种存在于细胞内膜的关键酶,其产生的ATP可促进分枝杆菌的分解代谢和合成代谢 [ 31] 。ATP合酶主要由两个区域组成:胞质区域F1(F1复合物由α、β、γ、δ、ε共5个亚基组成)和跨膜区域Fo(Fo复合物由a、b、c共3个亚基组成) [ 32] 。当质子流穿过Fo域时,F1结构域的γ和ε亚基旋转,驱动ATP合成 [ 33] 。当贝达喹啉抑制分枝杆菌ATP合成酶的质子转移链后,ATP消耗、pH稳态失衡、最终导致细菌死亡 [ 34] 。另有文献表明贝达喹啉能够靶向分枝杆菌F-ATP合成酶的ε亚基及与c亚基,抑制细菌活性 [ 35] 。此外,贝达喹啉对人类ATP合成酶复合物的敏感性比分枝杆菌低20 000倍,因此,贝达喹啉对分枝杆菌ATP合成酶的抑制作用具有特异性 [ 36, 37] 。具体机制示意见 图1。
图1贝达喹啉的作用机制[ 38] 二、贝达喹啉耐药分子机制 贝达喹啉的不当使用会导致耐药菌株的出现,因此应对其进行精确、可重复的药物敏感性试验(drug susceptibility testing,DST)监测。根据欧洲抗微生物药敏试验委员会(European Committee On Antimicrobial Susceptibility Testing,EUCAST)指南,贝达喹啉在7H9培养基上的 MIC折点(breakpoints)为 0.25 mg/L [ 39] 。 有研究表明其耐药性发生由分枝杆菌染色体突变导致 [ 40] 。目前已知的贝达喹啉耐药分子机制由三个基因 atpE ( Rv1305 )、 Rv0678 ( mmpR5 )、 pepQ ( Rv2535c )的非同义突变导致。 (一) atpE 基因靶点突变 atpE 基因( Rv1305 )编码贝达喹啉的作用靶标——ATP合成酶的跨膜蛋白; atpE 基因突变后,贝达喹啉与ATP合成酶的Fo结构域c亚基结合能力减弱,H + 转移维持,ATP产生;多份研究报告显示, atpE 基因多在28和63位发生突变 [ 41, 42, 43] 。Andries等 [ 30] 首次发现了编码F1/Fo跨膜蛋白的 atpE 基因的贝达喹啉相关抗性突变——Ala63Pro,紧接着Petrella等 [ 44] 在耐贝达喹啉的MTB中发现atpE新的突变位点——Ile66Met,Zimenkov等 [ 43] 在贝达喹啉耐药的MTB临床分离菌株中发现Asp28Asn和Ala63Val突变位点。且 atpE 基因突变常会使贝达喹啉的MIC增加8~133倍,发生高水平耐药。Huitric等 [ 41] 研究发现28%(15/53)的耐贝达喹啉的MTB菌株存在以下 atpE 基因位点突变:Asp28Val、Ala63Pro、Ile66Met、Asp28Pro、Glu61Asp。而其余耐贝达喹啉菌株中未发现基因突变,这表明可能存在其他耐药机制。 atpE 基因突变位点可见文献[ 14,30,41, 42, 43, 44, 45]。 (二) Rv0678 基因非靶点突变 临床上首次发现且报道最多的是 Rv0678 基因。 Rv0678 ( mmpR5 )基因是一种蛋白质二聚体,属于MarR家族调控基因之一 [ 46] 。 Rv0678 基因位于mmpS5上游,其编码的蛋白是外排泵系统MmpS5(Rv0677c)/MmpL5(Rv0676c)的转录抑制因子,其突变将导致外排泵MmpS5/MmpL5过表达,细胞内药物浓度降低,贝达喹啉低水平耐药产生 [ 47] ;MmpL是分枝杆菌基因组编码的一组膜蛋白,属于外排泵耐药结节细胞分化(resistance-nodulation-division,RND)蛋白超家族, Rv0678 基因突变导致RND家族中的膜转运蛋白增加,贝达喹啉流出增加,菌体内药物浓度降低 [ 44] 。 在一系列耐贝达喹啉的MTB菌株实验中发现, Rv0678 基因突变可能先出现,其会导致较低水平耐药,然后治疗失败的患者发生 atpE 基因突变,最终产生高水平耐药性 [ 48] 。 此外, Rv0678 基因突变会导致贝达喹啉和氯法齐明(clofazimine)发生交叉性耐药。氯法齐明属于亚氨基苯嗪类药物,主要用于治疗麻风分枝杆菌感染 [ 49] 。氯法齐明具有较强的抗分枝杆菌和抗炎活性,但其确切作用机制仍不清楚,目前认为其作用机制主要有以下几点:氯法齐明被Ⅱ型 NADH 氧化还原酶(type Ⅱ NADH oxidoreductase,NDH-2)还原为还原型氯法齐明,再次氧化后会释放活性氧,产生抗结核作用;氯法齐明选择性地与结核分枝杆菌DNA的鸟嘌呤碱结合,抑制依赖DNA的RNA聚合酶,阻止RNA的合成,抑制细菌蛋白的合成,发挥其抗菌作用;此外,氯法齐明可激活细菌磷脂酶 A2 的作用,释放对结核分枝杆菌有毒性的酶水解产物溶血磷脂,从而增强氯法齐明的抗分枝杆菌作用 [ 37,50, 51, 52] 。 贝达喹啉与氯法齐明可能具有相同的外排泵MmpS5/MmpL5系统,该外排泵的上调会导致耐药性的发生,因此 Rv0678 基因是贝达喹啉和氯法齐明发生交叉性耐药的重要机制,有研究发现患者既往服用氯法齐明可能会导致贝达喹啉耐药 [ 44] 。南非的一项回顾性研究显示,在378株MTB菌株中,12株耐氯法齐明菌株中有5株(42%)具有贝达喹啉耐药性,而9株耐贝达喹啉菌株均对氯法齐明耐药,且大多数(8/9)菌株发生Rv0678基因突变特征 [ 53] 。 总之,对贝达喹啉耐药可能会导致氯法齐明完全性交叉耐药,而耐氯法齐明的MTB菌株中大约三分之一对贝达喹啉具有交叉性耐药。因此,可能存在赋予这两种抗生素交叉耐药的其他机制,需要进行全基因组测序分析来确定新机制。 Rv0678 基因突变位点可见文献[ 13, 14, 15,19,43,45,47, 48,53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69]。 (三) pepQ 基因非靶点突变 pepQ ( Rv2535c )基因编码的372位氨基酸蛋白由100-aa N-末端α/β结构域和250-aa C末端肽酶2个结构域组成 [ 44] 。 pepQ 基因编码Xaa-Pro细胞质肽酶,其突变后导致贝达喹啉和氯法齐明敏感性降低,其确切机制仍不清楚。有研究表明 pepQ 基因突变可能会通过不同途径增加mmpL5/mmpS5转运体外排,如在氨基末端附近含有Val-Pro-Pro延伸,可阻止mmpL5降解 [ 44] 。 pepQ 基因突变位点可见文献[ 44,67]。 总而言之,不论是否服用过贝达喹啉,都应当进行耐药分子机制的检测和标准化抗生素敏感性测试,这将有助于医疗工作者临床指导治疗并降低患者耐药发生风险。 三、结语与展望 本文对抗结核新药贝达喹啉抗菌特征、作用机制及耐药分子机制进行了综述。总而言之,贝达喹啉具有很强的抗MTB活性,但是其耐药发生率、耐药发生原因及机制也不容忽视。 目前,MDR-TB和RR-TB仍是全球结核病控制工作面临的严峻问题,传统的抗结核治疗方式存在治疗周期长、生物利用度低、毒副作用强、耐药性增加等局限性问题,因此“全口服、毒性小、更有效、少住院”将是全新耐药结核病化学治疗方案设计的基本考量和原则 [ 70] 。多项临床试验的结果证实,与传统治疗方案相比,含贝达喹啉的治疗方案会改善MDR-TB的治疗效果。 贝达喹啉虽治疗效果较好,但仍然产生了一定程度的耐药性。因此需要全面的药理学检测和药物监测系统,更好地评估贝达喹啉与其他抗结核药物联合应用、在短程方案中的应用、耐药的监测和预防、在不同人群中及肺外结核中的应用,药物的安全性及有效性,及时评估其耐药的流行病学进展 [ 71] 。此外,药代动力学/药效学建模研究也有助于预测疗效和降低耐药性 [ 72] 。 传统的分子诊断技术不能准确地评估抗药性突变,随着测序技术和生物信息学的发展,全基因组测序在预测抗结核药物敏感性、研究地区传播模式的分子流行病学起到了至关重要的作用,这有利于解决结核病的早期诊断和耐药问题,有助于更好地管理现有的治疗方案,以避免治疗失败、进一步的耐药性发展和耐药菌株的传播。 参考文献(略)返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |