蛋白酪氨酸磷酸酶PTP1B(PTPN1)简介 |
您所在的位置:网站首页 › 蛋白磷酸化是什么 › 蛋白酪氨酸磷酸酶PTP1B(PTPN1)简介 |
蛋白酪氨酸磷酸酶PTP1B(PTPN1)简介
|
蛋白磷酸化和去磷酸化是生物机体内发生的非常重要的活动。在组织内,蛋白的磷酸化主要发生在酪氨酸,丝氨酸和苏氨酸等基团。蛋白激酶和蛋白磷酸酶分别负责调节蛋白的磷酸化和去磷酸化,从而维持机体的正常平衡。PTP1B就是一个广泛存在的原型非受体酪氨酸磷酸酶,在调节各种代谢如糖尿病肥胖或癌症如EGF相关通路中扮演着重要角色。下面会从它的发现,简单结构,作用机制及作为靶点药物等各个方面简单介绍一下PTP1B这个蛋白磷酸酶。 PTP1B的发现及结构PTP1B是科学家们1988年从人体胎盘中提取验证发现的最早的PTP家族蛋白,它主要分布在细胞内质网上,它的晶体结构在1994年被解析出来,其他相关的主要研究历程见table 1。PTP1B分子一共约有435个aa主要有三部分组成:N-末端催化区域,调节区域及C-末端定位裂解区域(见图1)。N-末端催化区域有几个关键aa如Ser50和Tyr66,152,153的磷酸化, Cys215的氧化通过翻译后修饰调节该区域的催化功能;调节区域是一群富含脯氨酸的一个片段,主要用来识别特异性底物;PTP1B主要定位在内质网是因为它的C-末端区域,这个区域对后面蛋白的降解也起到一定作用。到目前为止,晶体结构只能解析前300个aa, 完整的蛋白解析结构还在研究当中。  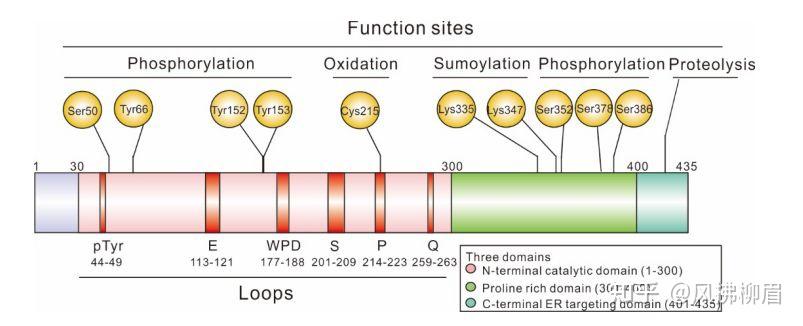 图一:PTP1B简单域结构示意图 2. PTP1B典型信号通路机制 PTP1B在胰岛素和瘦蛋白介导的信号通路中起着重要作用。以胰岛素为例,当胰岛素诱导胰岛素受体胞内酪氨酸发生磷酸化,胰岛素也会刺激PTP1B催化区域的Tyr66磷酸化,继而激活PTP1B去脱磷酸化胰岛素受体及其底物,负向调节胰岛素促进的糖代谢。体内PTP1B敲除小鼠实验证明,PTP1B的敲除后小鼠体内的胰岛素受体磷酸化明显增加,糖代谢活动也明显增强,进而血液内葡萄糖及胰岛素的浓度明显下降,因而很多研究都集中在PTP1B在糖尿病中的作用。另一个瘦蛋白相关通路中,PTP1B会去磷酸化瘦蛋白受体下游通路中的JAK2,进而导致食欲刺激激素神经肽Y合成的抑制,从而瘦身。此外,PTP1B也在癌症研究中有一定作用,既可以抑癌也会促癌,需要分析其扮演的具体作用情况。研究表明,PTP1B在一些癌种中过表譬如乳腺癌,子宫癌和胰腺癌等。在患有乳腺癌的大鼠纤维细胞中激活的her2受体伴随着升高的PTP1B;在HER2引起的乳腺癌小鼠中,ptp1b缺陷可以明显抑制肿瘤生长延长生存期,ptp1b抑制剂处理也能抑制肿瘤生长。最新报道,PTP1B可作为免疫检查点参与体内T细胞免疫作用,在ptp1b+/+, ptp1b+/-和ptp1b-/-小鼠中移植乳腺癌细胞原位成瘤并持续观察 |
【本文地址】
今日新闻 |
推荐新闻 |