一文看懂药品注册受理号+批准文号编码 |
您所在的位置:网站首页 › 药品名称含义 › 一文看懂药品注册受理号+批准文号编码 |
一文看懂药品注册受理号+批准文号编码
|
CSS:申请生物制品试生产转正式生产 CSL:申请生物制品临床研究 CSZ:申请生物制品试生产转正式生产 CSS、CSL、CSZ、CS后面加B即为补充的意思 二、CDE发布12位代码新受理号编码原则 2005年03月07日,CDE发布:新受理号编码原则开始实施,规定了新的注册申请受理号编码原则,新的编码原则由十二位代码组成,较之原编码原则,包含的注册信息更为全面,使得国产/进口、新药/已有国家标准、化药/中药/生物制品、临床/生产/补充/再注册申请等信息能够非常容易地被辨识。原文见(药通社摘选): http://www.cde.org.cn/news.do?method=largeInfo&id=658
自2005年元月起,国家食品药品监督管理局注册司新的注册申请受理号编码原则正式开始实施。新的编码原则由十二位代码组成,较之原编码原则,包含的注册信息更为全面,使得国产/进口、新药/已有国家标准、化药/中药/生物制品、临床/生产/补充/再注册申请等信息能够非常容易地被辨识。为使得注册申请人方便地了解相关信息,现将编码原则公布如下:
三、另有文章将注册受理号,总结的更加全面: ★ 前面4个字母的含义 第一个字母: 只有2种情况,分别代表国内注册(C)和进口注册(J)。 第二个字母: 一般有4种情况,分别代表新药(X,化药1~5类,中药1~8类,生物制品1~14类)、仿制药(Y,化药第6类,中药第9类,生物制品第15类)、补充申请(B)和再注册(Z)。 第三个字母: 一般有4种情况,分别代表化药(H)、中药(Z)、生物制品(S)、辅料(F,如化药常规辅料和生物制品大多数试剂盒)。 第四个字母: 一般有6种情况,分别代表申请生产或者销售(S,国内是申请生产,进口为申请销售),申请临床(L),进口分包装(F),补充申请(B),再注册(Z),复审(R)。★ 7位数字的含义 前面2位是受理年份的后两位。 后5位一般是流水号。 需要注意的是紧挨着年份的2位数字的第一位如果是9的话就肯定不是流水号。这种受理号的形式与其他的区别很小,但是该号是企业完成生物等效性后直接寄国家局药审中心申请生产,由药审中心发的。 受理号 申请类型 CYHL******* 国内化药仿制药申请临床 CYHS******* 国内化药仿制药申请生产 CYHS**9**** 国内化药仿制药完成生物等效性后申请生产 CYHB******* 国内化药仿制药的补充申请 CYHB**9**** 国内化药仿制药完成生物等效性后的补充申请 CBHR******* 国内化药补充申请后申请复审 CYHR******* 国内化药仿制药申请 CXHL******* 国内化药新药申请临床 CXHS******* 国内化药新药申请生产 CXHR******* 国内化药新药申请复审 CXHB******* 国内化药新药补充申请 CXHB**9**** 国内化药新药补充申请后生物等效性报生产 CYFS******* 国内仿制辅料申请生产 CYFB******* 国内辅料补充申请 CXFL******* 国内新辅料申请临床 CXFS******* 国内新辅料申请生产 CYSL******* 国内生物制品仿制药申请临床 CYSS******* 国内生物制品仿制药申请临床 CYSB******* 国内生物制品补充申请 CYSB**9**** 国内生物制品补充申请批准生物等效性申请生产 CYSR******* 国内生物制品仿制药申请生产被否后复审 CXSL******* 国内生物制品新药申请临床 CXSS******* 国内生物制品新药申请生产 CXSB******* 国内生物制品新药补充申请 CXSR******* 国内生物制品新药申请复审 CYZS******* 国内中药仿制药申请生产 CYZR******* 国内中药仿制药申请复审 CYZB******* 国内中药生产补充申请 CXZL******* 国内中药新药申请临床 CXZS******* 国内中药新药申请生产 CXZB******* 国内中药补充申请 CBZR******* 国内中药补充申请被否后申请复审 CXZR******* 国内中药新药申请被否后申请复审 JYHF******* 化药仿制药申请进口分包装 JYHB******* 进口化药仿制药补充申请 JYHZ******* 进口化药再注册 JXHL******* 进口化药申请临床 JXHS******* 进口化药申请销售 JXHR******* 进口化药新药申请复审 JXFL******* 进口新辅料申请临床 JYFB******* 进口辅料补充申请 JZHR******* 进口化药再注册申请复审 JYSF******* 生物仿制药申请进口分包装 JYSB******* 进口生物仿制药补充申请 JXSL******* 进口生物药新药申请临床 JXSS******* 进口生物药新药申请销售 JXSR******* 进口生物药新药申请被否后申请复审 JYSZ******* 进口生物药再注册申请 JYZB******* 进口中药补充申请 JXZL******* 进口中药新药申请临床 JXZR******* 进口中药新药申请复审 JYZZ******* 进口中药再注册申请 JZZR******* 进口中药再注册被否后申请复审 药品批准文号编码含义 五、2019年《药品注册管理办法》2019年征求意见稿 注意:该《药品注册管理办法》,截至发稿,还没有正式实施
第一百二十七条(药品批准文号格式)规定药品批准文号的格式为(药通社摘选): 境内生产药品: 国药准字H(Z、S)+4位年号+4位顺序号; 中国香港、澳门和台湾地区生产药品: 国药准字H(Z、S)C+4位年号+4位顺序号; 境外生产药品:国药准字H(Z、S)J+4位年号+4位顺序号。 其中,H代表化学药,Z代表中药,S代表生物制品。 药品批准文号,不因上市后的其他注册事项的变更而改变。 六、2007年《药品注册管理办法》 《药品注册管理办法》2007年版本第一百七十一条规定(药通社摘选): 药品批准文号的格式为:国药准字H(Z、S、J)+4位年号+4位顺序号,其中H代表化学药品,Z代表中药,S代表生物制品,J代表进口药品分包装。 《进口药品注册证》证号的格式为:H(Z、S)+4位年号+4位顺序号; 《医药产品注册证》证号的格式为:H(Z、S)C+4位年号+4位顺序号,其中H代表化学药品,Z代表中药,S代表生物制品。 对于境内分包装用大包装规格的注册证,其证号在原注册证号前加字母B。 新药证书号的格式为:国药证字H(Z、S)+4位年号+4位顺序号,其中H代表化学药品,Z代表中药,S代表生物制品。 七、2002年药监局关于统一换发并规范药品批准文号格式 2002年药监局发布,关于统一换发并规范药品批准文号格式的通知 ,国药监注[2002]33号
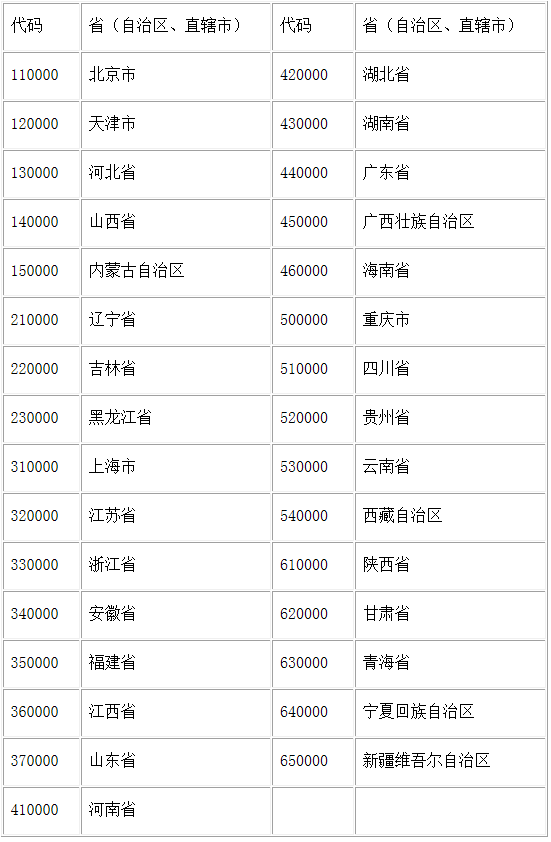
各省、自治区、直辖市药品监督管理局,解放军总后卫生部: 药品批准文号是药品生产合法性的标志。 《药品管理法》规定,生产药品“须经国务院药品监督管理部门批准,并发给药品批准文号”。由于历史的原因,目前,已上市药品的批准文号的格式不尽相同,这种情况,不利于进行统一管理和监督。为加强药品批准文号管理,根据国家药品监督管理局《关于做好统一换发药品批准文号工作的通知》(国药监注〔2001〕582号)要求,现又规范了新的药品批准文号格式,并将在近期对全国药品生产企业已合法生产的药品统一换发药品批准文号。现将有关事项通知如下: 一、药品批准文号格式: 国药准字+1位字母+8位数字,试生产药品批准文号格式:国药试字+1位字母+8位数字。 化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母“B”,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药品使用字母“J”。 数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“19”、“20”代表2002年1月1日以前国家药品监督管理局批准的药品,其它使用各省行政区划代码(见附件一)前两位的,为原各省级卫生行政部门批准的药品。 第3、4位为换发批准文号之年公元年号的后两位数字,但来源于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。 数字第5至8位为顺序号。 有关批准文号的换发说明见附件二。 二、每种药品的每一规格发给一个批准文号。除经国家药品监督管理局批准的药品委托生产和异地加工外,同一药品不同生产企业发给不同的药品批准文号。 三、自2002年1月1日以后批准生产的新药、仿制药品和通过地方标准整顿或再评价升为国家标准的药品,一律采用新的药品批准文号格式。 四、自2002年1月1日以后批准发给的化学药品《进口药品注册证》,其注册证号格式亦作部分改变,其中字母“X”改为“H”,其它部分不变。原已发给的旧格式注册证号在换发《进口药品注册证》时用新格式取代。 五、药品批准文号及化学药品的进口药品注册证号换发后,印有原格式批准文号及注册证号的包装标签在2003年6月30日后禁止流通使用。 附件: 1.药品批准文号采用的中华人民共和国行政区划代码 2.统一换发并规范药品批准文号格式说明 国家药品监督管理局 二○○二年一月二十八日 附件一: 药品批准文号采用的中华人民共和国行政区划代码
附件二: 统一换发并规范药品批准文号格式说明 一、凡原卫生部核发的药品批准文号,统一换发为国药准(试)字相应类别,数字前两位为“10”,3、4位为原批准文号年份的后两位数字,后4位顺序号重新编排。如:“卫药准字(1997)X-01(1)号”换发为“国药准字H10970001”。 二、2001年12月31日以前由国家药品监督管理局核发的药品批准文号,凡不同于新的批准文号格式的,也按新格式进行统一换发。原年份为“1998”、“1999”的,换发后第1、2位为“19”;原年份为“2000”、“2001”的,换发后第1、2位为“20”。第3、4位仍为原批准文号年份后两位。详见下表:
三、原省级药品监督管理部门核发的药品批准文号,换发时,应根据其原批准文号中的省份简称,在新格式药品批准文号中使用相应省份代码,新批准文号数字第3、4位为换发年份的后两位,顺序号重新编排。 例如,原化学药品“京卫药准字(1996)第000001号”换发为“国药准字H11020001”,字母和数字含义依次是:“H”为化学药品,“11”为北京市的行政区划代码前两位,“02”为换发之年2002年的后两位数字,“0001”为新的顺序号。 通过地方标准整顿或再评价升为国家药品标准的药品,现为地方药品批准文号,或已经换发为国药准字XF00000000等类型,但不同于新批准文号格式的,也应按上述要求,加入省份代码,进行统一换发。中药药品批准文号换发后,不再使用“ZZ××××-”前缀。 参考资料: CDE:www.cde.org.cn NMPA:www.nmpa.gov.cn 药通社:www.yaotongshe.net 小木虫:http://muchong.com/t-4960903-1-authorid-1004605 其他网络资料,不一一列举返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |