一文读懂丨BICR 和 INV 评估的差异知多少? |
您所在的位置:网站首页 › 英文名字评估 › 一文读懂丨BICR 和 INV 评估的差异知多少? |
一文读懂丨BICR 和 INV 评估的差异知多少?
|
图 1. BICR 双盲加裁定评估工作流程图 (图源:文献 4) 与 OS 可以客观评估不同,PFS 的评估可能受多种主观因素的影响,比如肿瘤测量的差异、靶病灶选择、新病灶检测失败、不同影像科医师和临床医师对进展的解释差异等,这些主观因素都可能对治疗组之间的 PFS 结果评估造成不同影响 [5] 。 而且,阅片人本身以及不同阅片人之间的差异,可能对肿瘤缓解的评估结果产生较大的影响。阅片人在靶病灶选择以及肿瘤边缘测量等多方面存在差异,特别是对于交界性肿瘤 [6] 。 因此,在多中心研究中,虽然都采用统一的 RECIST 1.1 评估标准,但相比于在几十甚至上百个中心由不同的研究者分别进行阅片评估,由一个或几个 BICR 统一进行评估,显而易见可以更大程度地保证评估结果的一致性并减少偏倚。 中国国家药品监督管理局(NMPA)药品审评中心发布的《抗肿瘤药临床试验影像评估程序标准技术指导原则》 [2] 也指出: ➣研究者在疗效评估时不仅有影像数据,还可获得影像外的临床数据。该因素有助于研究者对影像学资料的判读,但在开放性设计的临床试验中,研究者可能对试验组受试者产生倾向获益的预期,由此可能导致研究的影像评估结果出现潜在的偏倚或倾向性。 ➣而 BICR 评估中,独立中心化的影像评估过程通常是充分盲化的,评估者不知晓所评病例的治疗信息(非单臂试验)和研究者的评估结果,可提高影像评估的独立性和可信度,并与研究者的评估结果互为对比。因此可能提高研究结果的客观性。 实际上,在很多抗肿瘤临床试验中可以观察到,BICR 和 INV 评估的 PFS 在数值上存在一定的差异。举例而言,在 ALK-TKI 相关研究中,INV 评估的结果往往在数值上优于 BICR 评估的结果。 ➣ALEX 研究 [7,8] 中,阿来替尼组和克唑替尼组 BICR 评估的中位 PFS 为 25.7 个月 vs 10.4 个月(HR = 0.50),INV 评估为 34.8 个月 vs 10.9 个月(HR = 0.43); ➣ALTA-1L 研究 [9] 中,布格替尼组和克唑替尼组 BICR 评估中位 PFS 为 24 个月 vs 11 个月(HR = 0.49),INV 评估为 29.4 个月 vs 9.2 个月(HR = 0.43)。 由此我们是否可以假设,ALK 突变疾病的特点导致了在 ALK 相关研究中,INV 结果普遍比 BICR 结果更长?这种差异是否可以类推到其他 ALK-TKI 中呢?比如 CROWN 研究 [10] 中,洛拉替尼组 INV 评估的中位 PFS 和 BICR 评估的中位 PFS 都还没到达,但是从 INV 评估的 HR 0.21 比 BICR 评估的 HR 0.28 更低来看,洛拉替尼很大可能有更长的 INV 中位 PFS。最终结果是否如此,让我们一起期待研究数据的出炉。 综上所述,INV 与 BICR 评估结果在数值上可能存在一定的差异。临床医生在解读抗肿瘤药物临床研究数据时,不能简单地把 INV 与 BICR 评估的 PFS 混在一起进行对比,而应综合考虑评估者、评估标准等因素,在同类型的评估中进行比较(如 BICR 结果 vs BICR 结果、INV 结果 vs INV 结果),知其然并知其所以然,才能更好地指导临床。
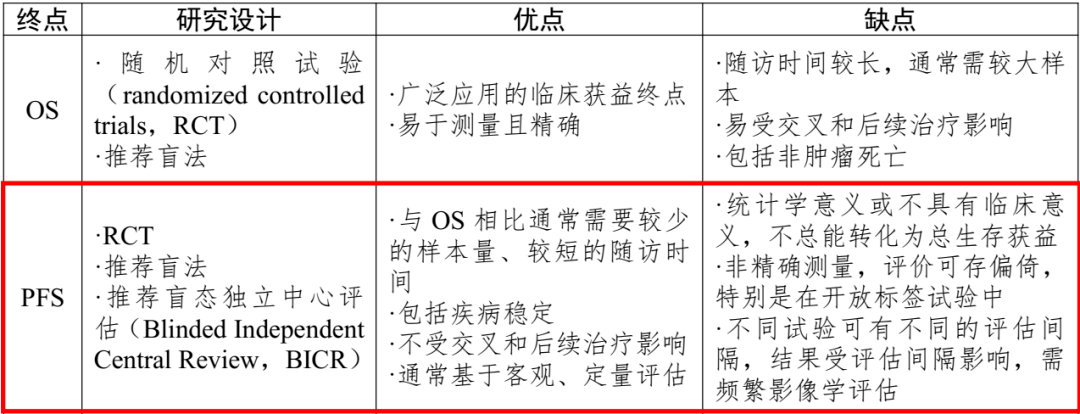
(图源:站酷海洛) 为了确保研究数据的可靠性,美国 FDA 建议使用 BICR 评估抗肿瘤药物研究的终点指标 [11] 。FDA 指出,当主要研究终点为基于肿瘤测量的终点(如 PFS、ORR)时,为了减少评估偏倚,肿瘤评估通常应由中心评估者对研究治疗进行盲法评估。BICR 评估往往是 III 期研究获批适应证的必要条件。 同样,NMPA 发布的《抗肿瘤药物试验终点技术指导原则》《晚期非小细胞肺癌临床试验终点技术指导原则》均推荐,以 PFS 为终点的随机对照试验采用 BICR 评估 [12,13] 。 表 1. 晚期 NSCLC 药物常用临床试验终点比较 (图源:文献 13)
总之,BICR 和 INV 评估各有其优缺点,BICR 可用于检验 INV 评估的结果,两者需要保持一致性。在以 PFS 为终点的临床研究中,两者相结合能够为研究结果带来「双保险」。需要指出的是,在解读研究结果时,虽然非头对头研究的结果不能用于直接比较,但在用作临床参考时,理清结果由 BICR 评估还是 INV 评估,采用同类评估标准的结果进行间接的比较,可更好地减少偏差,避免被误导。 小调研 学以致用~ 本内容仅供医疗专业人士阅读 内容审核:青寻 项目审核:孔宇森 题图来源:站酷海洛 参考文献 [1]. Villaruz LC, Socinski MA. The clinical viewpoint: definitions, limitations of RECIST, practical considerations of measurement. Clin Cancer Res. 2013;19:2629–2636. [2].《抗肿瘤药临床试验影像评估程序标准技术指导原则》. [3]. Ford RR, et al. Adjudication Rates between Readers in Blinded Independent Central Review of Oncology Studies. J Clin Trials 2016, 6:5. [4]. Beaumont H, Iannessi A, Wang Y, et al. Blinded Independent Central Review (BICR) in New Therapeutic Lung Cancer Trials. Cancers (Basel). 2021;13(18):4533. [6]. Walovitch R, Girardi, Duan F. A Simulation Study to Evaluate Accuracy and Precision of Blinded Independent Central Reviews of Progression-free Survival in Cancer Clinical Trials.J Clin Trials 2013, 3:3. [7]. Camidge D R, Dziadziuszko R, Peters S, et al. Updated efficacy and safety data and impact of the EML4-ALK fusion variant on the efficacy of alectinib in untreated ALK-positive advanced non–small cell lung cancer in the global phase III ALEX study. Journal of Thoracic Oncology, 2019, 14(7): 1233-1243. [8]. Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. [10]. Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med. 2020;383(21):2018-2029. [11]. Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics Guidance for Industry. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-trial-endpoints-approval-cancer-drugs-and-biologics [12].《抗肿瘤药物试验终点技术指导原则》. [13].《晚期非小细胞肺癌临床试验终点技术指导原则》. 点击 阅读原文,参与调研 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |