【药研快报】一文速览:2023年上半年国内罕见病药物获批 |
您所在的位置:网站首页 › 艾曲波帕怎么吃要空腹么 › 【药研快报】一文速览:2023年上半年国内罕见病药物获批 |
【药研快报】一文速览:2023年上半年国内罕见病药物获批
|
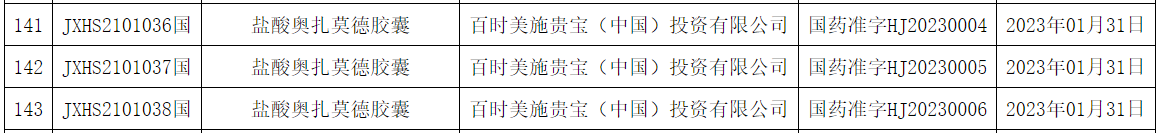
罕见病用药是国家药监局药品注册与监管工作会议中每年都会被“点名“的领域,因其急需性,更因其难能可贵。据统计,截至6月30日共约有50款新药首次获得中国国家药监局(NMPA)批准上市,约有30多款新药在中国迎来了新适应症。本篇内容以“看中国”之名带您速览其中罕见病药物,包括首次批准上市的7款及3款成功扩大适应症,为中国罕见病患者扩充药物治疗之希望。 (一)首次获批上市的罕见病药物 盐酸奥扎莫德胶囊
百时美施贵宝旗下新型选择性鞘氨醇1-磷酸(S1P)受体调节剂热珀西亚(盐酸奥扎莫德胶囊)国内获批,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发-缓解型多发性硬化和活动性继发进展型多发性硬化。企业称该药物是在中国自身免疫疾病领域首个获批的创新疗法,有望为中国多发性硬化患者带来“躯体+认知”双重保护治疗新方案。疗效和安全性证据来自SUNBEAM(12个月)和RADIANCE(B部分,24个月)两项大型阳性药物对照III期研究结果,显示与干扰素β-1a相比,热珀西亚可带来显著临床获益,包括年复发率(ARR)的显著降低,持续治疗12个月时降低48%;持续治疗24个月,降低38%;MRI病灶数减少、脑容量丢失减少及认知功能保护。 尼替西农胶囊
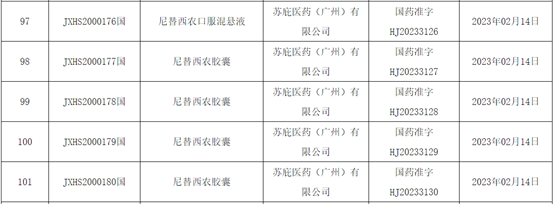
瑞典苏庇医药(SOBI)开发的尼替西农是国际上治疗1型酪氨酸血症(HT-1)的首选药物,今年在国内获批了口服混悬液和胶囊两个剂型,用于治疗成人和儿科患者的1型遗传性酪氨酸血症。尼替西农是一种4-羟苯丙酮酸双氧酶竞争性抑制剂,该酶在酪氨酸分解代谢途径中可上调延胡索酰乙酰乙酸酶(FAH)。通过抑制1型酪氨酸血症患者酪氨酸的正常代谢,该药可预防代谢中间体马来酰乙酰乙酸盐和延胡索酰乙酰乙酸盐的累积。在1型酪氨酸血症患者中,这些代谢中间体会转化为毒性代谢物,造成肝肾毒性。疗效对比数据显示,2个月以下患儿单用饮食限制方法治疗的HT-1患者,2年和4年的存活率均为29%;而增加尼替西农药物治疗后,2年和4年存活率均提高至88%。 西罗莫司凝胶
北京希而欧生物医药是一家中日合资的国际性CRO公司,引进西罗莫司凝胶(商品名:纤洛丽)在国内获批上市,用于治疗6岁及以上儿童和成人患者的结节性硬化症相关面部血管纤维瘤。西罗莫司一种大环内酯抗生素类免疫抑制剂,堪称药物中的“多面手”,除可用于器官移植抗排斥反应领域,还可应用在抗衰老、治疗脑型疟疾等治疗领域。过去在国内获批上市均为口服剂型,即片剂、胶囊剂、口服溶液。2022年美国FDA已批准Nobelpharma株式会社的HYFTOR(西罗莫司外用凝胶)0.2%,这是首个外用治疗与结节性硬化症(TSC)相关成人和6岁以上儿童面部血管纤维瘤的药物。凝胶的应用应限于血管纤维瘤的受累区域,应用部位不应被堵塞。 醋酸格拉替雷注射液
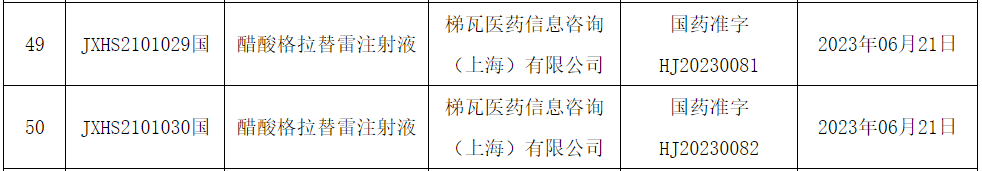
醋酸格拉替雷(Glatiramer acetate)是梯瓦制药(Teva)的老牌多发性硬化(MS)药物,于1996年获得FDA批转上市。国内药物的中文商标为固派松,此次国内获批用于治疗复发型MS成人患者,包括临床孤立综合征、复发缓解型多发性硬化和活动性继发进展型多发性硬化。获批规格(20mg/ml和40mg/ml)均获得美国FDA批准,其中,40mg/ml降低了每周给药频次,提高了患者依从性和便利性。醋酸格拉替雷是由四个氨基酸组成的多肽随机混合成的醋酸盐。它的作用机制可能包括,有利地改变促炎反应和调节细胞分裂素之间的平衡,在一定程度上降低复发率和疾病的严重程度,被认为IFN-β的替代药物。近30年的临床研究数据证实,醋酸格拉替雷可显著降低复发率和疾病活动性,改善患者残疾进展和脑萎缩,降低临床孤立综合征转归为多发性硬化的风险,同时还可改善疲劳、认知功能和痉挛等症状,并具有长期安全性良好,无明显时间依赖性的不良反应,非特殊情况无须监测。 艾加莫德α注射液
艾加莫德α注射液(卫伟迦)由再鼎医药申报,是国内首个且目前唯一NMPA批准的FcRn拮抗剂,它与常规治疗药物联合,获批用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。其在美国、欧盟和中国获批用于AChR抗体阳性的成人gMG治疗,在日本获批用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的成人gMG患者。在重症肌无力的治疗上,艾加莫德在ADAPT研究的全球三期临床研究中, 达到了其主要终点,证实了与安慰剂相比,在接受艾加莫德治疗后,显著更多的AChR抗体阳性的gMG患者是重症肌无力日常活动评分(MG-ADL)应答者(68%对比30%;p60岁的重型再障患者,在不少于6个月的艾曲泊帕(75mg qd)治疗后,总体有效率可以超过70%,而且在年龄60~70岁的人群中,使用该联合方案总体的疗效和缓解率与成人总体人群的结果相似。在此之前,其已在中国获批用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的成人和6岁及以上儿童慢性免疫性(特发性)血小板减少症(ITP)患者,使血小板计数升高并减少或防止出血。 依库珠单抗注射液
依库珠单抗(eculizumab)注射液(中文商品名:舒立瑞),是阿斯利康旗下的强劲新药,在国内外医学研究和市场格局上均颇受瞩目。该药最初由Alexion公司开发,是一款“first-in-class”C5补体抑制剂,通过抑制补体级联反应终端的C5蛋白,降低炎症反应。此次依库珠单抗在国内获得第三个适应症,成为当前中国首个获批用于治疗gMG的补体抑制剂。其关键III期临床试验REGAIN研究结果显示,与安慰剂组相比,接受依库珠单抗治疗的抗AChR抗体阳性的难治性gMG患者在肌肉力量以及生活质量方面的MG-ADL评分获得快速且持续的改善。为期六个月的REGAIN研究显示出的改善,在超过130周的开放标签扩展期研究中得到了持续。 利司扑兰口服溶液
神经罕见病创新药物艾满欣(利司扑兰口服溶液用散)是一种运动神经元生存基因2(SMN2)mRNA剪接修饰剂,通过双位点特异性调控SMN2基因(SMN1同源基因)的剪接,促进保留外显子7,提高功能性SMN蛋白水平。利司扑兰可穿透血脑屏障,分布于中枢和外周,可提高全身多系统SMN蛋白水平,且保持稳定。2021年6月,利司扑兰在华首次获批用于治疗2月龄及以上脊髓性肌萎缩症(SMA)患者,开启了SMA口服治疗的新时代。此次获批将利司扑兰的适用人群拓展至16日龄及以上的SMA患者。该适应症拓展主要基于RAINBOWFISH研究中利司扑兰对症状前SMA患儿的疗效和安全性中期分析结果。临床研究证实,对于1型SMA患者,利司扑兰可帮助患者实现运动里程碑,获得呼吸和吞咽、进食等功能的持续改善,为患者带来更多全身获益。同时,对于2/3型患者,利司扑兰可以改善患者运动功能,提高生活独立性,减轻照护者负担。 备注: (1)引用资料(略)为网络对药物获批的新闻报道; (2)上述药物整理仅代表本平台关注到的罕见病类别范畴。 版权声明 以上内容来自良医汇-罕见病新进展,如有建议或疑问,欢迎致电18017449015。 |
【本文地址】
今日新闻 |
推荐新闻 |