分泌路径(Secretory Pathway)详解 |
您所在的位置:网站首页 › 膜蛋白转运机制 › 分泌路径(Secretory Pathway)详解 |
分泌路径(Secretory Pathway)详解
|
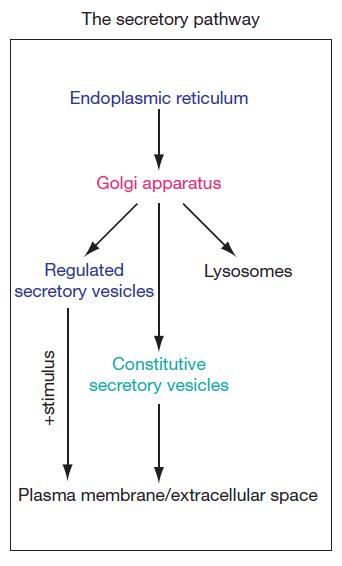
Secretory Pathway(分泌路径)是蛋白质转运的重要途径之一,分泌路径是内质网(ER)和高尔基体(Golgi)、溶酶体(Lyso)、质膜(PM)以及胞外等的蛋白质折叠、修饰和质量控制系统。
Secretory Pathway 是如何工作的?
新合成的蛋白质通过信号识别粒子(SRP)靶向进入分泌路径,进入内质网进行折叠和修饰,随后在分泌路径中进行一系列转运和定位活动(如:通过 ER 和高尔基之间的囊泡转运、定位于 ER、在高尔基体内修饰、通过高尔基体转运蛋白等),最后蛋白从高尔基体离开,靶向定位进入后高尔基体运输(包括溶酶体,质膜和细胞外间隙)。
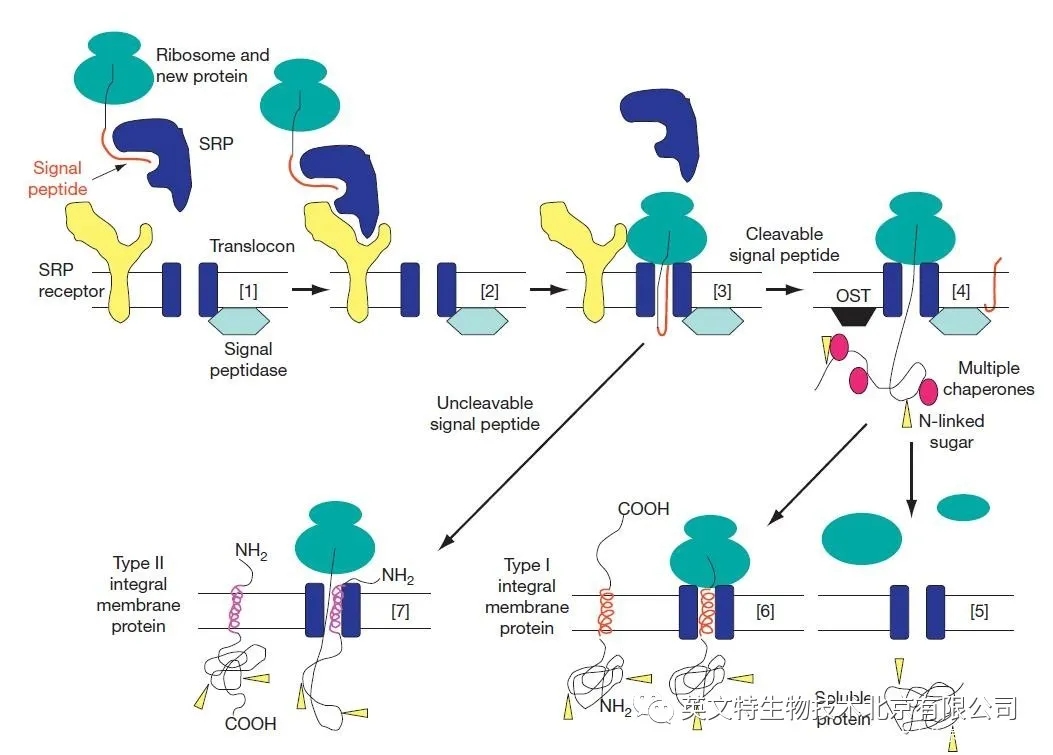
新蛋白合成进入内质网 哪些蛋白会进入分泌路径? 进入分泌途径的蛋白质可分为两类:一类在内质网和高尔基体中起作用以确保适当的蛋白质折叠和修饰(即驻留蛋白),另一类是在内质网和高尔基体中处理并被运输到其他位置(如溶酶体、质膜,细胞外间隙)。这些蛋白质中的每一种不仅具有进入分泌途径的信号,而且还可能有一个次级信号将其定位到该路径内的特定细胞器。 分泌通路进入的信号和机制蛋白质是由氨基末端肽(称为信号肽)合成的,它允许蛋白质穿过内质网的膜。信号肽由 13-16 个疏水性氨基酸组成,由蛋白质和核糖核酸组成的复合物识别,称为信号识别粒子(SRP)。当信号肽在翻译过程中从核糖体中出现时,SRP 与之结合并停止翻译,然后将新的蛋白质 - 核糖体复合物靶向 ER 膜的细胞质面,在那里它与 SRP 受体结合。随后,新的蛋白质 - 核糖体复合物从 SRP 及其受体中释放出来,转移到一个叫做 “translocon” 的水膜通道中,翻译恢复。新的蛋白质通过翻译子共同翻译转移到内质网腔,在许多情况下,信号肽被一种特定的信号肽酶裂解。
图片来源:Secretory Pathway,S Shikano and K J Colley, University of Illinois, Chicago, IL, USA
许多蛋白质被一个氨基端疏水信号肽靶向进入分泌途径,以允许它们在内质网膜上进行共翻译转位。上图中,[1] 信号识别粒子(SRP)识别新蛋白的信号肽。[2] 核糖体 - 新的蛋白质 - SRP 复合物与内质网膜上的 SRP 受体相互作用。[3] 核糖体 - 新的蛋白质复合物被转移到易位子通道,蛋白质继续合成,蛋白质通过水通道移动。[4] 当新蛋白进入内质网腔时,其信号肽被信号肽酶裂解,伴侣蛋白结合以帮助折叠,寡糖蛋白转移酶复合物(OST)在 N - 连接糖基化过程中将寡糖(箭头)转移到天冬酰胺残基上。[5] 可溶性蛋白质缺乏额外的疏水序列,通过易位子转运,在内质网腔中完成折叠和修饰。[6] I 型完整膜蛋白有第二疏水序列,它被分成脂质双层,并作为跨膜段。这些蛋白质的氨基末端位于细胞器的管腔内,或在转运到质膜时位于细胞外,而其羧基末端则位于细胞质中。[7] 与具有可切割氨基末端信号肽的蛋白质不同,II 型完整膜蛋白有一个不可清除的信号锚定,它将蛋白质靶向分泌途径,然后分配到脂质双层中作为跨膜段。这些蛋白质的氨基端在细胞质中,而羧基端在细胞器的管腔或细胞外。在内质网水平进入的可溶和完整的膜蛋白如不需要停留在那里,可以通过膜囊泡将其从内质网转运到通路中的其他位置。 可溶性和完整膜蛋白 可溶性蛋白质完全转运穿过内质网膜进入管腔,这些蛋白质要么留在内质网中,要么靶向另一个细胞器,要么从细胞分泌。具有一个或多个疏水跨膜区的完整膜蛋白将利用这些序列插入内质网的膜中,并作为内质网驻留的跨膜蛋白或靶向于另一个细胞膜。Ⅰ 型膜蛋白有一个可切割的信号肽和一个单独的疏水性氨基酸片段,作为膜的一个区域。这类蛋白质的氨基末端位于细胞器的管腔或细胞外,如果到达质膜(这些在拓扑上是等效的),它的羧基末端在细胞质中。相比之下,Ⅱ 型膜蛋白有一个不可清除的信号肽或信号锚定物,它通常靠近蛋白质的氨基端,同时兼有信号肽和跨膜区的双重功能。与 Ⅰ 型膜蛋白相比,Ⅱ 型膜蛋白采用更为复杂的插入机制。因此,如果 Ⅱ 型膜蛋白到达质膜,它的羧基末端将位于细胞器的管腔或细胞外,而它的氨基末端则位于细胞质中。其他的蛋白质多次跨越膜,被称为 Ⅲ 型膜蛋白。它们可以从可裂解的信号肽或不可清除的信号锚定开始,并具有数量不等的疏水跨膜段。
内质网中蛋白质的折叠和修饰 内质网蛋白N-连接糖基化的启动 当蛋白质进入内质网腔,它们在伴侣蛋白的帮助下折叠和组装。许多蛋白质在 N - 连接糖基化过程中也会通过向天冬酰胺残基中添加碳水化合物而进行共翻译修饰(图 2)。预成型低聚糖(Glc3Man9GlcNAc2)由 3 个葡萄糖、9 个甘露糖和 2 个 N - 乙酰氨基葡萄糖残基组成,通过低聚糖 - 蛋白质 - 转移酶复合物转移到三肽序列天冬酰胺 - X - 丝氨酸或苏氨酸(X 不能是脯氨酸)中可接近的天冬酰胺残基。随后,内质网和高尔基体中的糖苷酶(去除单糖的酶)和糖基转移酶(添加单糖的酶)的修饰导致 N - 连接低聚糖的重构。这些 N - 连接的碳水化合物帮助蛋白质折叠,保护它们不被降解,并且在某些情况下,在细胞表面和细胞外空间对于调节和介导蛋白质和细胞间的相互作用至关重要。分子伴侣和内质网质控系统内质网的一个重要功能是作为蛋白质折叠和质量控制的场所。内质网中的蛋白质折叠包括分子内二硫键的形成、脯氨酸异构化和疏水性氨基酸在蛋白质内部的隔离。蛋白质二硫键是在蛋白质离开转运子时形成的,最初可能在蛋白质的线性氨基酸序列中紧密相连的半胱氨酸残基之间错误地形成。硫醇氧化还原酶,如蛋白质二硫键异构酶(PDI),有助于形成和重组蛋白质的二硫键,使之成为最具能量优势的构型。不同类型的伴侣监测蛋白质的折叠,防止未折叠和未组装的蛋白质从内质网流出。伴侣 BiP 最初被鉴定为免疫球蛋白重链结合蛋白,它与许多蛋白质折叠中间产物的疏水序列相互作用,并阻止它们聚合。两种称为 calnexin 和 calreticulin 的分子伴侣识别一种单糖基化碳水化合物结构(Glc1Man9GlcNAc2),由一种特殊的葡萄糖基转移酶,识别未折叠或错误折叠的蛋白质,并在 Man9GlcNAc2 结构中添加一个葡萄糖。未正确折叠或未组装成具有伴侣亚基的寡聚体的蛋白质通过伴侣相互作用被阻止离开内质网,并且可以通过易位子穿过内质网膜回到细胞质中,在这个过程中它们被蛋白酶体复合体降解,称为内质网相关降解(ERAD)。
蛋白质在分泌途径中的转运和定位 内质网和高尔基体之间的囊泡运输蛋白质通过囊泡在内质网和高尔基体之间移动,这些囊泡被一套特殊的细胞质蛋白包裹,形成 COP-Ⅰ 和 COP-Ⅱ 外壳。COP-Ⅱ 包被囊泡从 ER 转移到中间隔室 / 顺式高尔基体,而 COP-Ⅰ 包被的囊泡则从高尔基体转移回内质网,也可以介导高尔基池之间在顺行(向质膜)和逆行(向内质网)方向的转运。 囊泡转运的过程可分为三个阶段:“货物” 选择和出芽、靶向以及融合。在第一阶段,COP 包被的作用是选择货物离开隔室,并帮助膜变形使囊泡出芽。它们在 ADP 核糖基化因子(ARF;COP-Ⅰ 特异)和 Sar1p(COP-Ⅱ 特异)的帮助下聚集在膜上。囊泡出芽后,ARF 和 Sar1p 水解三磷酸鸟苷(GTP)导致囊泡脱开。在第二和第三阶段,运输囊泡和靶膜上的栓系蛋白相互作用使膜结合在一起。这使得囊泡相关的 SNARE 蛋白(可溶性 NSF 附着蛋白受体)和靶膜相关 SNARE 蛋白形成复合物。随后在 SNARE 蛋白复合物中的构象变化将膜结合在一起进行融合。另一组 Rabs 通过招募和激活通路中的各种蛋白质,在多个水平上控制着囊泡转运的过程。 蛋白质在内质网中的定位 参与蛋白质折叠、修饰和质量控制的蛋白质必须保留在内质网中,而目的地为高尔基体、溶酶体、质膜或细胞分泌的蛋白质必须离开。离开 ER 是一个选择性的过程,需要货物受体与 COP-Ⅱ 外壳相互作用。大多数驻留 ER 的蛋白不会离开 ER,然而,一些驻留蛋白会从内质网逃逸,并被 COP-Ⅰ 囊泡从高尔基体和中间隔室转移回。这些蛋白质具有特定的氨基酸信号,通过直接与 COP-Ⅰ 组分的相互作用或通过与货物受体的间接相互作用,将其并入 COP-Ⅰ 包被的囊泡中。例如,BiP 是一种可溶性内质网伴侣蛋白,其羧基末端有四个氨基酸序列赖氨酸 - 天冬氨酸 - 谷氨酸 - 亮氨酸(KDEL)。这个 KDEL 序列由 KDEL 受体识别,KDEL 受体介导 COP-Ⅰ 囊泡从中间室转移回 ER。赖氨酸 - 赖氨酸 - X-X 序列(KKXX)存在于一些内质网膜蛋白的羧基端,并且通过 COP-Ⅰ 小泡介导这些蛋白质的回收。内质网定位信号与蛋白质质量控制除了羧基末端的 KDEL 和 KKXX 序列外,一种称为 RXR 的精氨酸 - X - 精氨酸信号介导了整体膜蛋白转移回至内质网的过程。RXR 通常存在于质膜上表达的多聚蛋白的细胞质区域。RXR 被认为在生物发生和运输过程中被各种机制所掩盖,如折叠、亚单位组装、蛋白质 - 蛋白质相互作用和翻译后修饰,这些都是蛋白质在质膜上正常发挥功能所必需的。这些过程中的任何一个缺陷都会导致 RXR 的暴露,从而导致 COP-Ⅰ 的识别和随后向 ER 的逆行迁移。因此,RXR 是 ER 的检查点,确保具有适当结构和功能的蛋白质的输出。 蛋白质在高尔基体的修饰
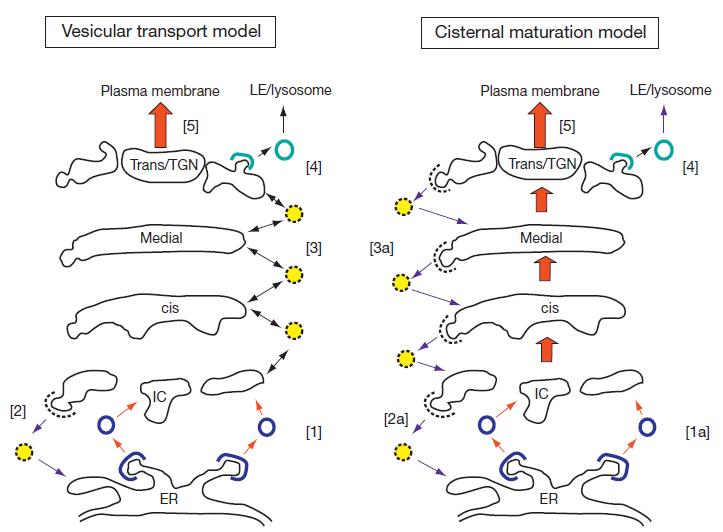
高尔基体由一堆扁平的池组成,池中含有酶和其他蛋白质,这些蛋白质参与了对新合成的蛋白质的进一步修饰和加工。它被分为顺 - 中 - 反池,然后是一个小管和小泡网状结构称为 TGN。N - 连接的糖基化过程是通过特定池中的糖苷酶和糖基转移酶的作用完成的。同样,丝氨酸和苏氨酸残基的糖基化(O - 连接糖基化)是由其他糖基转移酶完成的。一些修饰也发生在高尔基,例如,蛋白质和碳水化合物被磺基转移酶硫酸化,一些蛋白质在丝氨酸和苏氨酸残基上被高尔基激酶磷酸化。此外,消化酶(胰蛋白酶、羧肽酶)和激素(胰岛素)等蛋白质作为非活性前体,必须在高尔基体晚期或后高尔基体室进行蛋白质水解处理,使之成为活性物质。 蛋白质通过高尔基体的转运 目前,有两种不同的模型来解释蛋白质通过高尔基体的转运(如下图)。囊泡转运模型认为,在 COP-Ⅰ 包被的囊泡中,蛋白质在高尔基池之间顺序移动,而池本身是静止的。例如,未保留在顺式高尔基体中的蛋白质将被并入包被的囊泡中,并被运输到内侧高尔基体,然后运输到反式高尔基体。目的地为后高尔基体小室的蛋白质以这种方式通过连续的高尔基池移动,被每个小室中的驻留酶修饰。在池成熟或进展模型中,则认为内质网衍生膜在高尔基体的顺式面上形成一个新的池。这需要 COP-Ⅱ 包衣囊泡内质网中新合成蛋白质的顺行转运,以及 COP-Ⅰ 包衣囊泡中原有顺式池中顺式高尔基酶的逆行转运。新的池和它的内容物逐渐成熟通过堆栈作为驻留高尔基酶被连续引入 COP-Ⅰ 包被囊泡。即在囊泡运输模型中,当货物在不同的池中移动时,驻留的高尔基酶保留在池中。而在池成熟 / 进展模型中,驻留的酶以逆行的方式持续运动,而顺行的货物仍然在池中。
图片来源:Secretory Pathway,S Shikano and K J Colley, University of Illinois, Chicago, IL, USA 两种高尔基体蛋白质转运模型的比较。在囊泡转运模型中,货物蛋白在囊泡中的池之间移动,而高尔基酶则保留在它们的驻留池中。[1] COP-Ⅱ 包被囊泡将新的蛋白质从内质网转运到中间室(IC)。[2] 逃离内质网的驻留内质网蛋白可在 COP-Ⅰ 包被囊泡中从 IC 中回收。[3] COP-Ⅰ 包被囊泡还可在高尔基池之间以逆行和顺行方式(渗透小泡)运输蛋白。在池成熟模型中,蛋白在顺式结构面进入一个新的池,并被驻留的高尔基酶修饰(成熟),这些高尔基酶以逆行的方式连续运输到顺序成熟的池中。[1a] COP-Ⅱ 包被囊泡将新的蛋白质从内质网转运到 IC,在那里形成新的顺式池。[2a] 逃避内质网的驻留内质网蛋白可以在 COP-Ⅰ 包被的囊泡中从 IC 中回收。[3a] 高尔基酶在 COP-Ⅰ 包被囊泡中以逆行的方式运输,以改变早期池中的货物蛋白。蛋白质从 TGN 中退出的机制在这两种模型中是共同的即 [4] 网格蛋白包被的囊泡介导晚期内切体(LE)- 溶酶体转运,而 [5] 其他蛋白质以调节或组成的方式分泌到质膜或细胞外间隙。 蛋白质从高尔基体离开并定位到高尔基体后 蛋白质从高尔基体离开 一旦蛋白质到达 TGN(trans Golgi network,即反面高尔基体管网状结构),它们将被分类到高尔基体后的隔间,包括溶酶体、质膜和细胞外间隙。如果被运输到溶酶体 - 内体系统就会涉及到网格蛋白包裹的囊泡,类似于那些在内吞作用中吸收蛋白质的囊泡。相反,向质膜的转运或胞吐,可发生在分泌性小泡 / 小管中,或以特定细胞类型的分泌颗粒的调节方式发生。靶向溶酶体的蛋白质 溶酶体是一个降解的小室,含有许多酸性水解酶,这些水解酶可以消化蛋白质、脂类和碳水化合物。大多数溶酶体酶向溶酶体的运输需要这些酶的 N - 连接糖上的甘露糖 6 - 磷酸残基。甘露糖 6 - 磷酸残基由 TGN 中的受体识别,这些受体介导新溶酶体酶结合到网格蛋白包被的囊泡,以进入晚期内体。这些被网格蛋白包裹的囊泡从 TGN 移动并与晚期内体融合,腔 pH 值降低导致溶酶体酶与受体分离。这些酶随后被运送到溶酶体,而受体则循环到 TGN。一些缺乏甘露糖 6 - 磷酸残基的溶酶体膜蛋白也通过网格蛋白包被的囊泡运输到溶酶体,而另一些则被运输到细胞表面,并入内吞过程中使用的一套不同的网格蛋白包被的囊泡,然后通过晚期的内体运输到溶酶体。 组成性和调节性分泌 在许多细胞类型中,膜相关蛋白和可溶性蛋白组成性地移动到质膜上,而不需要特定的信号。组成性分泌的蛋白质包括受体、通道蛋白、细胞粘附分子、可溶性细胞外基质和血清蛋白。其他蛋白质,如激素和神经递质是针对分泌小泡的,这些小泡参与内分泌和外分泌细胞、某些类型的免疫细胞和神经元的调节分泌。这些小泡一直处于分泌准备状态,直到导致细胞内钙水平升高的细胞外信号触发其内容物的胞外释放。
分泌途径中的微管和运动蛋白 膜室之间的囊泡运输需要细胞微管和运动蛋白。微管产生于一种称为微管组织中心(MTOC)的结构,微管的负端被锚定。运动蛋白是一类能够沿细胞骨架表面运动的分子马达。它们由 ATP 的水解提供动力,并将化学能转化为机械功。例如,几种类型的驱动蛋白马达向微管正端运输囊泡货物,而细胞质动力蛋白 - dynactin 将小泡运输到负端。此外,某些种类的非传统肌球蛋白沿着肌动蛋白丝传递货物。例如,沿微管从内质网到高尔基体的囊泡运输依赖于动力蛋白 - dynactin 复合物,而从高尔基体到内质网的逆向运输,如内质网驻留蛋白的再循环,很可能是驱动蛋白依赖性驱动蛋白也参与了与 TGN 不同的贩运途径,包括运输到晚期内体和分选到构成和调节分泌囊泡。运动蛋白向膜泡的募集是由各种分子促进的,包括外套蛋白、模块化支架蛋白、跨膜蛋白、小 gtpase 和其他运动蛋白。 ------------------------------------------------------------------------------------------------------
Invent 柱式法快速蛋白提取及亚细胞结构分离,助力蛋白转运研究好帮手! Invent分泌路径蛋白研究全攻略
SM-005(质膜及组分分离) Minute™ Plasma Membrane Protein Isolation and Cell Fractionation Kit
ER-035(肝脏内质网) Minute™ High Fidelity ER Isolation Kit for Liver Tissue
ER-036(内质网) Minute™ ER Enrichment Kit For Tissues and Cultured Cells
GO-037(高尔基体) Minute™ Golgi Apparatus Enrichment Kit
LY-034(溶酶体) Minute™ Lysosome Isolation Kit for mammalian cells/tissues
ED-028(早期内体) Minute™ Endosome Isolation and Cell Fractionation Kit |
【本文地址】