振幅整合脑电图在早产儿中的临床应用进展 |
您所在的位置:网站首页 › 脑电图课件视频 › 振幅整合脑电图在早产儿中的临床应用进展 |
振幅整合脑电图在早产儿中的临床应用进展
|
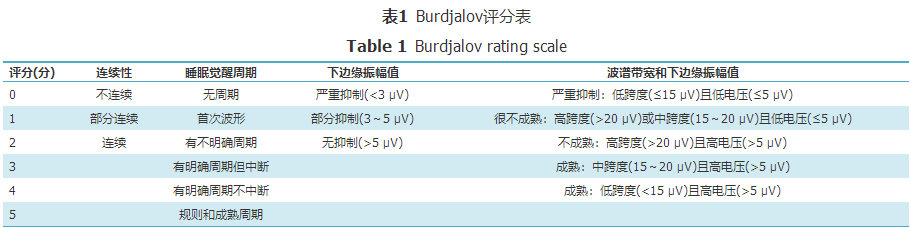
早产儿的aEEG图像在PMA 27周时开始出现逐渐的连续性,PMA 30~31周开始达最佳,PMA 33周以后则呈完全的连续性,PMA对极早产儿aEEG图像连续性的影响比胎龄较大的早产儿更大;在PMA 25~26周,aEEG图像第1次出现循环周期样改变,呈间断性,SWC在PMA 34周左右完全建立,在PMA 36周时成熟;PMA 27周后aEEG下边缘电压值逐渐增大,波谱带宽度逐渐变窄,PMA 35~36周aEEG图像整体达最高,并逐渐趋于稳定[5,8,9]。有学者认为,影响早产儿中枢神经系统成熟度的最敏感指标依次是SWC的形成、背景活动的连续性和波谱带宽度[5]。当aEEG振幅下边缘已增高,表示早产儿脑功能发育已达到成熟后期[10]。早产儿PMA 35~36周时Burdjalov总分达到最高,即早产儿脑发育完全成熟[5]。 2 aEEG评分判读标准 目前应用的aEEG评分判读标准,包括Burdjalov和Hellström-Westas评分,不仅适用于足月儿,对早产儿也有一定的临床应用价值。 2.1 Burdjalov评分系统 Burdjalov等[5]在新生儿出生12~24 h、48~72 h、出院前每周或每2周进行aEEG监测,且每次监测持续8~24 h,最终将监测结果总结归纳出一套按连续性、SWC、下边缘振幅值和波谱带宽度4个方面评分的标准,将每项评分相加的总和(最小0分,最高13分)可以评价出脑发育的成熟度,见表1。
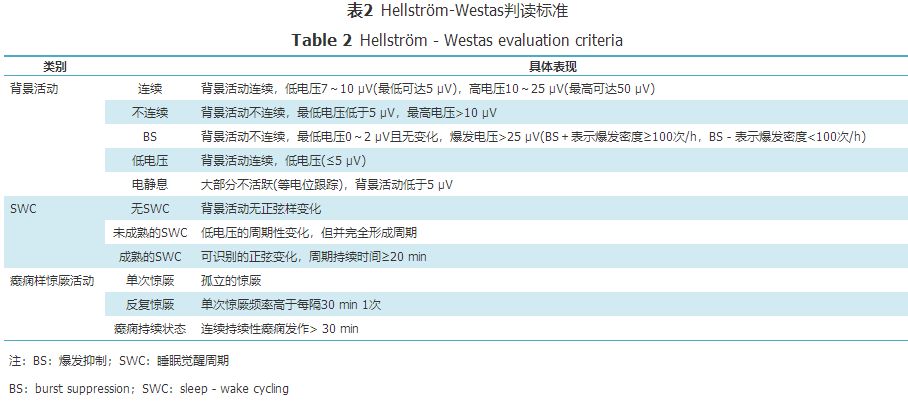
表1 Burdjalov评分表 Table 1 Burdjalov rating scale 虽然Burdjalov评分系统已被国内外广泛应用于临床,但仍存在一定不足,尚需进一步完善,如某些新生儿由于某些原因,直到出生后几天才能得到aEEG记录,此外,该评分系统对于连续性和SWC的判断具有主观性,缺少定量评分标准。 2.2 Hellström-Westas评分系统 Hellström-Westas和Rosén[11]根据aEEG背景活动、SWC和是否伴癫痫样惊厥活动3个方面设计aEEG判读标准,见表2。
表2 Hellström-Westas判读标准 Table 2 Hellström-Westas evaluation criteria Hellström-Westas的aEEG判读标准便于准确描述aEEG图像形态,比Burdjalov评分系统增加了癫痫样惊厥活动的分类。新生儿惊厥通常表现为微小发作,临床不易于判断,出现癫痫样惊厥活动时,aEEG图像表现为振幅的突然上升或下降,并多伴随波谱带宽度变窄,随后伴短时间的背景活动抑制。研究发现,aEEG可以敏感地识别出亚临床惊厥,诊断惊厥的敏感度达60%~80%[12]。值得注意的是,Hellström-Westas的aEEG判读标准没有具体分数参照,无法直观反映新生儿脑功能发育状态。有学者比较Burdjalov和Hellström-Westas 2套评分判读标准,认为2种标准都适于评价早产儿出生72 h内aEEG监测结果,并可有效评估早产儿的存活率,此外,Hellström-Westas判读标准还可预测早产儿在PMA 48个月时脑发育的远期结局[13]。 3 aEEG在早产儿脑损伤中的临床应用 早产儿的脑组织发育尚不成熟,当受围生期缺氧缺血或宫内感染等不良因素时,易发生不同程度的脑损伤,主要包括脑白质损伤(white matter injury,WMI)和颅内出血(intracranial hemorrhage,ICH),严重者可留有远期神经系统后遗症甚至死亡。当脑损伤发生后,因为神经细胞电活动异常,在大脑出现结构改变之前,神经元已发生电信号的变化,所以电生理技术较早期影像学检查对脑损伤更有诊断价值,早产儿出生后早期行aEEG监测可对其是否存在脑损伤及脑损伤的程度进行及时评估。 3.1 aEEG在WMI中的应用 WMI是早产儿脑损伤的最常见形式,而脑室周围白质软化(periventricular leucumalacia,PVL)是WMI的最严重表现,目前最常用的检测手段有颅脑磁共振成像(MRI)和超声技术,而在出生早期,特别是72 h内,常规MRI及超声有时难以识别。研究发现,严重的WMI,出生72 h内可能出现异常aEEG:背景活动缺乏周期性、波谱带较宽、Burdjalov总分低,表明早产儿动态脑功能监测有助于早期发现严重的WMI[14,15]。还有研究发现,aEEG低电压、背景活动不连续和缺失成熟的SWC与严重的神经病变甚至与死亡有关,并证明aEEG的监测结果与颅脑超声动态检查结果具有较好的一致性[16,17]。此外,aEEG的监测结果还可以评估WMI程度,颅脑超声检查结果为重度WMI的早产儿,其aEEG图像下边界振幅值明显低于轻度和无WMI的早产儿,2次爆发间隔的时间更长[18]。 研究发现,患有囊性PVL的早产儿,出生6~13 d aEEG图像上边缘振幅值较对照组显著增大[19]。另有学者报道,aEEG监测结果与影像学检查并非呈同步变化,如Kato等[20]报道1例胎龄29周的早产儿,在出生1 h内aEEG监测结果异常,出生28 h aEEG监测结果已完全恢复正常,而出生11 d颅脑超声检查发现该早产儿患有囊性PVL,但仅为个例报道,还需要进一步的研究和证实。 3.2 aEEG在ICH中的应用 ICH是早产儿围生期的常见疾病,脑室周围-脑室内出血(periventricular-intraventricular hemorrhage,PIVH)是ICH最常见的类型。临床上通常根据早产儿颅脑超声检查结果,对PIVH进行Papile分级(Ⅰ、Ⅱ级为轻度出血,Ⅲ、Ⅳ级PIVH为中重度出血)。 研究表明,aEEG监测结果与早产儿PIVH的严重程度有关。有学者观察胎龄25~33周的早产儿在出生7 d内的aEEG图像发现,与轻度出血组及无ICH组比较,中重度出血组患儿的aEEG背景活动连续性降低,SWC缺失率高,Burdjalov总分偏低,异常aEEG的发生率显著增高[21]。有学者建议,aEEG图像连续的程度可以作为早产儿严重ICH的阴性预测值:如果早产儿的aEEG背景活动在出生72 h可逐渐呈现出连续性,则可排除有颅内严重出血的可能[17]。 进一步研究发现,虽然有些早产儿患有中重度PIVH,在出生后早期aEEG图像表现为明显异常,但随着PMA的增加,aEEG图像会逐渐趋于正常。如Sohn等[22]报道,患有PIVH-Ⅳ级的早产儿,从出生48 h到PMA 36周,aEEG图像的SWC持续不成熟,Burdjalov总分持续低,自PMA 36周开始,aEGG的连续性、振幅值、波谱带宽度逐渐追赶上正常。 总之,aEEG有助于早期识别早产儿ICH,并能预测ICH的轻重程度,但无法区别正常和轻度ICH。临床确诊ICH仍主要依靠影像学检查,以早期发现脑损伤,合理治疗,改善其预后,减少后遗症的发生。此外,有报道称aEEG还能有效评估早产儿IVH后引起的脑室扩张,在ICH后的动态随访治疗中,起到一定的指导作用[23]。 3.3 预后评估 若出生后有条件,对早产儿,特别是有脑损伤的高危早产儿,应尽早进行aEEG监测,其检测结果可为神经发育预后提供有价值的信息。研究显示,早产儿出生24 h内进行aEEG监测,其结果对远期预后判断的精确率达75%~85%[24]。如果出生72 h内出现异常aEEG,则提示神经发育预后不良[14]。Wikström等[24]认为早产儿出生12 h aEEG背景活动性抑制、出生24 h aEEG图像IBI延长、爆发频率减小均提示预后不良。新近有研究,纳入1 181例早产儿的13项研究,就有关aEEG或EEG在早产儿出生1~10年对神经发育结果判断的精确性进行系统评价,结果表明,在早产儿出生7 d内监测aEEG或EEG的结果可作为后期神经发育的预测因子[25]。早产儿在PMA 30~34周的aEEG监测结果可预测患儿2岁时运动发育情况,但无法预测语言与认知能力[26]。 即使对于晚期早产儿,早期进行aEEG监测也可评估其神经发育结果,有学者对正常和有窒息史的晚期早产儿在出生6 h时进行aEEG监测,并在出生18个月进行随访,通过对比发现,异常的aEEG图像(背景活动缺少连续性,周期性不完整)能有效预测远期神经发育的不良结果,诊断智力发育迟缓的患儿比例明显增高[27]。另外,aEEG图像也是决定晚期早产儿住院时间的因素之一,aEEG呈明显周期性变化、下边缘振幅值更高的晚期早产儿,住院时间更短[28]。 4 影响aEEG的其他因素 aEEG监测结果不仅与脑发育的成熟度和脑损伤有关,许多其他因素,如性别、出生体质量、电极的安置位置、母亲孕期情况、药物的使用等均会影响早产儿aEEG的结果。 4.1 性别及出生体质量 早产儿的aEEG图像存在性别差异,男性SWC较少,且BS的次数更多。对比相同神经发育不良结局早产儿的早期aEEG结果发现,男童比女童的aEEG图像更加不成熟,推测可能与男性神经发育较女性迟缓有关[29]。此外,相同胎龄的早产儿中,小于胎龄儿的aEEG图像较适于胎龄儿最大振幅更大、背景活动呈低电压、成熟的SWC少、更易出现癫痫样惊厥活动,推测可能与胎儿宫内发育不良导致大脑发育过程中结构与分化的异常,从而导致大脑皮质电生理成熟延迟有关[6,30]。随着PMA的增加以及临床干预,小于胎龄儿可逐渐呈现正常的aEEG成熟度,但在出生24个月对比评估神经发育测试结果提示,小于胎龄儿较适于胎龄儿差[30]。 4.2 电极位置 aEEG通常使用的是单导联(由一对电极记录)或双导联(由4个电极记录,每侧脑半球设2个电极),有学者对比在早产儿不同电极区域(双侧额区、双侧中央区、双侧枕区、额区-中央区、中央区-枕区5种位置)放置电极片获得的aEEG图像,发现不同电极位置对早产儿aEEG图像有显著影响,放置在双侧额区的aEEG图形整体偏高[31]。然而关于aEEG电极放置的最适宜位置,尚有待于进一步研究。 4.3 其他因素 孕母产前使用皮质类固醇治疗可使早产儿aEEG图像波谱带变窄;先兆子痫可使早产儿出生48 h内睡眠周期缩短,aEEG图像不成熟;孕母患有绒毛膜羊膜炎可使早产儿aEEG波谱带变窄;胎盘-胎膜及脐带异常、母孕期高血压也会使早产儿aEEG异常,但确切机制尚不清楚,推测上述产前因素可能通过影响母亲和胎儿的血氧交换,使胎儿在子宫内发生慢性缺氧,从而引发早产儿缺氧缺血性脑病的发生[6,32]。对于早产儿而言,急性高碳酸血症可使aEEG背景活动暂时性被抑制;药物(吗啡、咖啡因、吲哚美辛、肺表面活性剂、正性肌力药)的使用、机械通气、新生儿脓毒血症、动脉导管未闭等因素均可使aEEG图像异常[6,26,33,34]。有报道称,极早产儿出生12 h,上腔静脉血流量也会影响aEEG图像,但二者相关性在出生24 h后消失,出生48 h内aEEG图像与平均动脉压无关,而48 h后平均动脉压显著影响aEEG图像[35]。 5 aEEG存在的问题及局限性 因为aEEG比EEG电极数目少,aEEG记录可能会丢失部分癫痫发作活动,所以aEEG对癫痫监测的敏感度不如EEG好。虽然EEG在向aEEG的转化过程中丢失了部分信息,但是与背景图像连续性和振幅相关的重要信息都被整合到aEEG中[36]。在新生儿重症监护病房中,应根据早产儿具体情况交替使用2种监测方法:高危早产儿早期应用aEEG,待患儿情况平稳后使用EEG,以监测aEEG无法描绘出的微小异常情况。在aEEG的临床使用中,操作者应熟练掌握aEEG的正确操作、伪迹的鉴别及排除,同时加强抗干扰能力强的脑功能监护仪器及配件的研发。 PMA是影响早产儿aEEG图像的主要因素之一,目前临床上缺少针对早产儿不同PMA的aEEG参考标准,同时还需考虑到早产儿性别、出生体质量、电极位置、母孕情况、药物干预等因素,从而便于对早产儿神经系统发育进行准确客观的评价。 综上所述,虽然aEEG被逐渐应用于新生儿临床监测,对于早产儿脑成熟度的评估及WMI和ICH的早期识别有一定的临床价值,但对于某些颅内疾病的诊断,MRI的准确性及敏感性明显高于aEEG,而颅脑超声常作为初诊及随访追踪的方法推广应用于临床工作中。因此,在使用aEEG的同时,还应与颅脑超声、MRI等其他方法相结合,以充分发挥aEEG在早产儿中的临床应用价值。返回搜狐,查看更多 |
【本文地址】