神外科普|胶质瘤的纳米药物治疗 |
您所在的位置:网站首页 › 胶质瘤的治疗药物 › 神外科普|胶质瘤的纳米药物治疗 |
神外科普|胶质瘤的纳米药物治疗
|
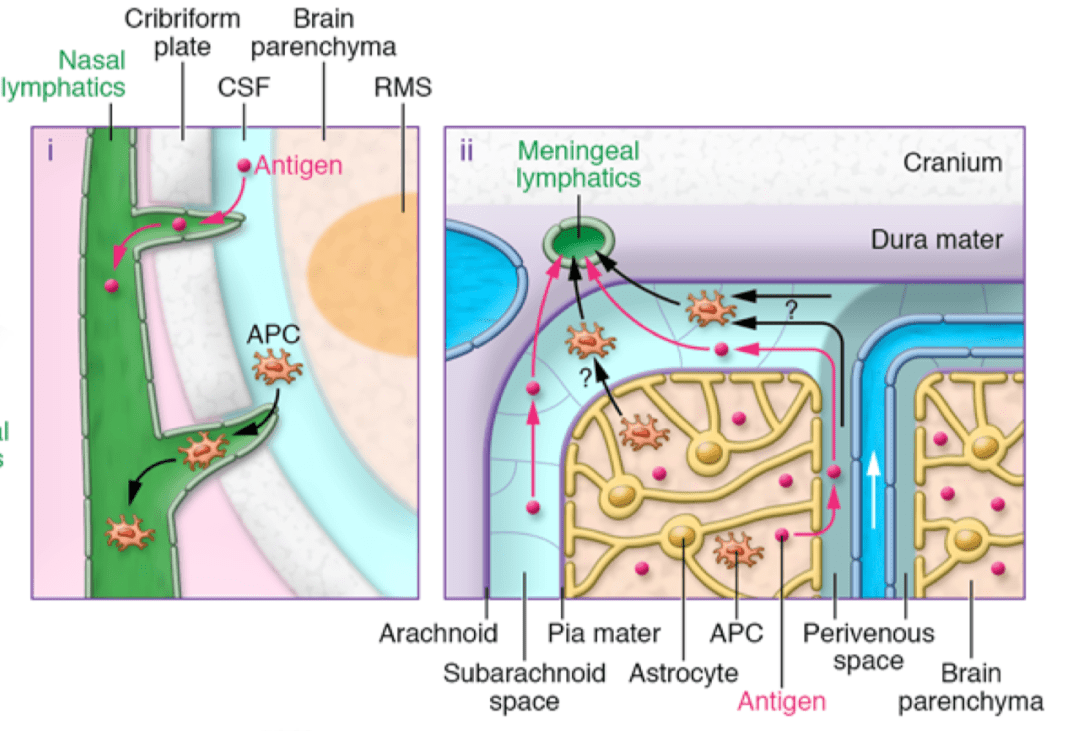
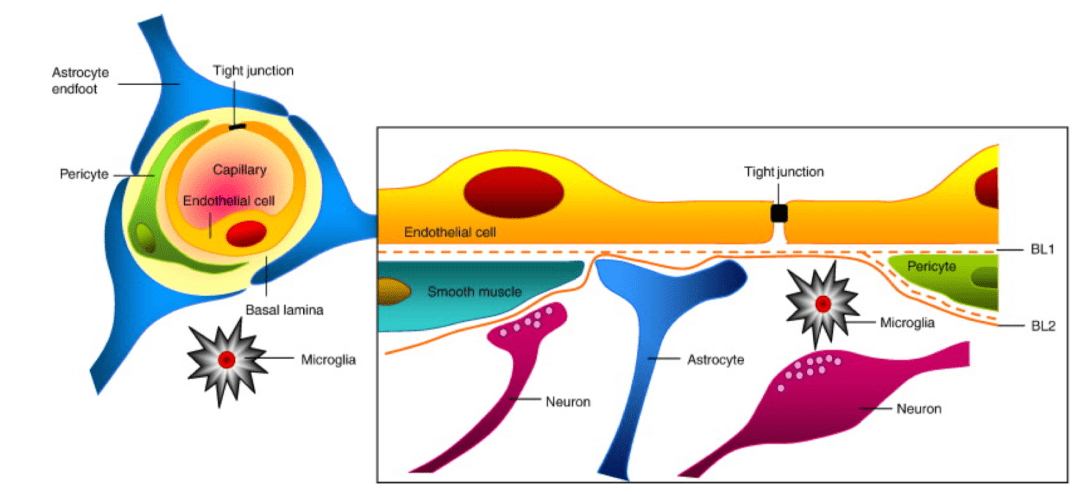
抗原和抗原呈递细胞退出中枢神经系统的途径 由于脑脊液的内部循环机制,抗原通过脑膜淋巴管从大脑传递到颈深部淋巴。然而,反应性却很低;因此,需要相当数量的抗原或二次信号来产生这种效应。 人脑是人体中保护最好的器官之一。颅骨、脑膜和脑脊液提供保护屏障:血脑屏障。然而,也正是这些保护层减少了治疗药物进入病变状态的大脑。抑制药物进入大脑的主要途径主要包括以下三种屏障: 血脑屏障 脑肿瘤周围血脑屏障的存在是递送治疗药物的重大障碍。血脑屏障由大脑毛细血管内皮细胞、星形胶质细胞、周细胞、基底膜构成,具有有限的转运及内吞作用。由于P糖蛋白在脑内皮细胞上的过表达,导致最大程度活跃的外排过程渗透发生。
血脑屏障组成示意图 此外,包括抗癌药物在内的各种大分子及大部份小分子颗粒都不能通过中枢神经系统结缔细胞中微小而紧密的孔。因此,由于血脑屏障的阻碍,现代化疗很难达到预期治疗目标。 血脑脊液屏障 克服血脑屏障后,下一个障碍是血-脑脊液屏障(BCFB),其由脉络膜丛(CP)的上皮细构成。脉络膜丛上皮(CPE)是一种分泌型上皮,基于参与平衡细胞转运的分泌机制,是最有效的组织类型之一。与血脑屏障类似,这种上皮屏障系统将血液和脑脊液分开。CPE由多种特异性外排转运蛋白和解毒酶组成,两者都能阻止潜在致命化合物进入中枢神经系统。目前已经开发了几种给药方案,其中大多数针对微血管内皮细胞,适用于血脑屏障。除了血脑屏障外,靶向脉络膜上皮形成的血脑脊液屏障对于中枢神经系统疾病的治疗也很重要。 多重耐药蛋白 近年来,血脑屏障被认为是一种静态脂膜屏障。血脑屏障膜对多种循环化合物选择性的物理特征是由于大脑内皮细胞连接紧密、缺乏囊泡以及高电阻等因素导致。然而,研究已证实脑内皮细胞具有广泛的代谢酶(如谷胱甘肽转移酶、碱性磷酸酶和细胞色素P450酶)和外排转运蛋白(能量依赖),包括排列不规则的P-糖蛋白和多药耐药蛋白,起着屏障的作用。P-糖蛋白(P-gp) (170-180 kDa)是一种质膜相关蛋白,是血脑屏障中必不可少的ATP依赖性外排转运蛋白之一。P-糖蛋白是一种由MDR1基因编码的多药耐药蛋白,它限制了各种药物的可及性,使其无法达到精确的治疗目的。研究表明当P-gp表达被抑制时,到达中枢神经系统的药物数量增加。 挑战: 免疫疗法具有治疗胶质母细胞瘤(GBM)的潜力。由于GBM: 其强大的适应能力 相对缺乏的免疫原性 免疫抑制的肿瘤微环境 肿瘤内异质性穿越血脑屏障治疗GBM仍然具有挑战性。目前普遍认为,中枢神经系统具有独特的、激活的、适应性的免疫系统,其中小胶质细胞是抗原提呈、toll样受体(TLRs)的表达和补体成分组成的重要细胞。中枢神经系统因其表达免疫抑制介质也被认为是一个“免疫不活跃”的位点。基于这些事实,中枢神经系统疾病是延迟或阻碍免疫反应的重要原因。 二 纳米药物靶向胶质瘤治疗 最近,基于GBM疗法的纳米药物得到了广泛关注。在传统靶向药物中,存在小部分以非特异性的方式通过血脑屏障富集于脱靶组织的现象,进而导致严重的副作用。使用纳米颗粒将药物输送到大脑不仅可以增加穿过血脑屏障的药物百分比,同时可减少非特异性药物在其他组织中的积聚。例如,装载钆的纳米载体系统将药物穿透和靶向能力提高到游离钆的100倍。具有配体修饰表面的NPs可辅助脑肿瘤的成像。在另一项研究中,纳米颗粒的聚乙二醇修饰被用于药物输送,以保护纳米颗粒不受网状内皮系统(RES)与血液蛋白相互作用的影响。聚乙二醇修饰的NPs可避免与血浆中的蛋白质的相互作用。 基于纳米药物的方法具有克服CNS的限制和推进中枢神经系统疾病治疗的巨大潜力。纳米颗粒作为药物和药物传递载体的用途已在临床前研究中得到广泛研究,目前正应用于中枢神经系统疾病的临床相关研究:
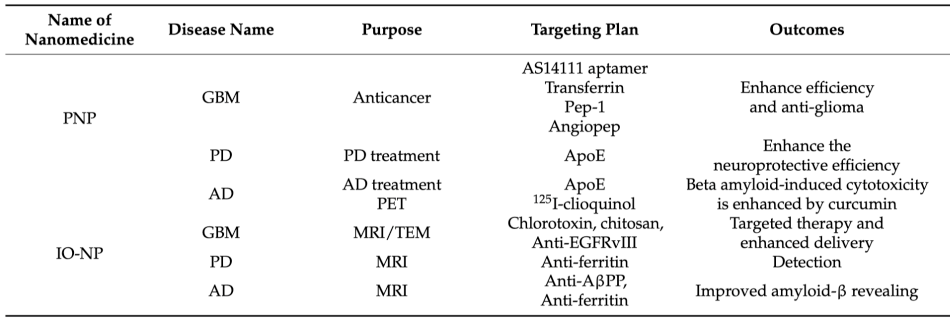
使用NPs治疗脑部疾病的临床试验: 优势: 显著改善中枢神经系统药代动力学和大脑区域的分布; 穿越血脑屏障; 特定配体的表面修饰可以“主动靶向”不同的脑细胞类型;目前,在临床试验中用于靶向中枢神经系统的纳米药物数量较少,因此必须进行全面的临床前研究来挖掘更多具有治疗潜力的纳米药物。近年来,许多研究集中于在中枢神经系统疾病模型中改进和测试纳米药物的各项功能指标,促进这些NPs在中枢神经系统中的临床应用。 纳米药物设计Tips: 纳米药物系统必须是兼容的,并且能够有效地穿过血脑屏障。在设计纳米载体时,需要优化以下参数:大小、形状、结构稳定性、功能表面化学、渗透性、肿瘤循环半衰期、外渗以及利用受体或转运体促进相互作用进入肿瘤的靶向能力。表面共轭化学可能在克服穿越血脑屏障的重大挑战中发挥关键作用。 01 恶性胶质瘤的免疫治疗
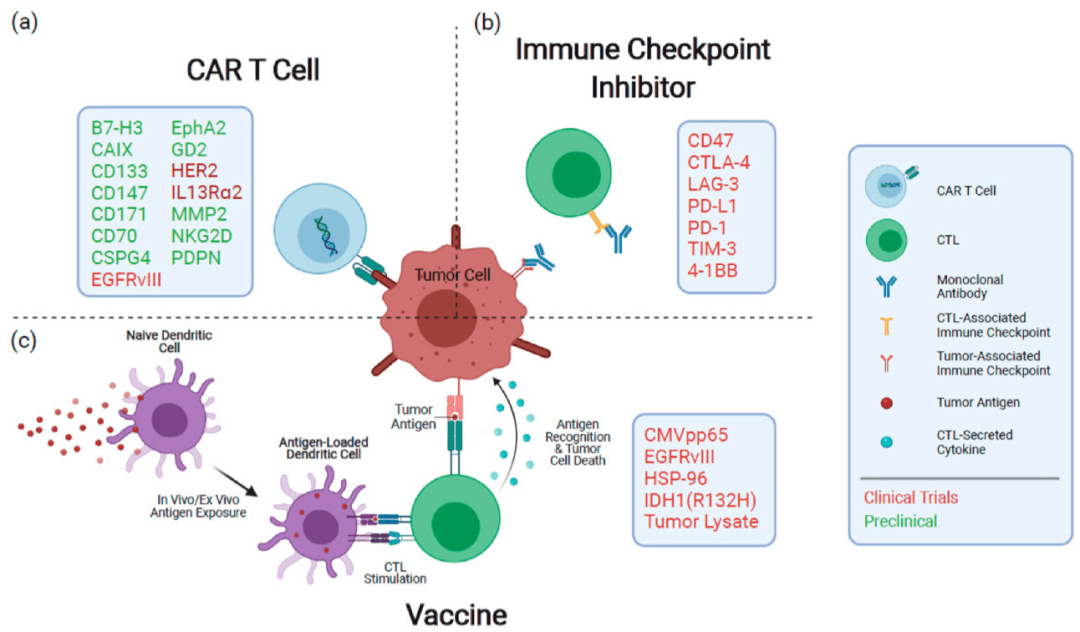
图. 目前正在研究的GBM的免疫治疗技术概述 (a) CAR-T细胞通过基因编辑的细胞外受体识别抗原,在与抗原结合后,诱导胞内T细胞活化和脱颗粒。 (b)免疫检查点蛋白抑制剂限制激活和衰竭期间免疫反应的抑制。 (c)疫苗将抗原呈递细胞暴露给肿瘤抗原,诱导针对目标抗原的免疫反应。 利用NPs可以提高疫苗的效率。它们可以保护疫苗不被降解,并促进APCs的吸收。Kuai等人利用高密度脂蛋白衍生的脂质和多肽制造了纳米圆盘。抗原肽和胆固醇附着在表面。在患有黑色素瘤的小鼠中,纳米圆盘在激发T细胞方面更有效,肿瘤需要更长的时间才能显现出来。在载瘤小鼠模型中,纳米圆盘加抗PD-1治疗可抑制88%动物模型中的肿瘤进展,明显优于单独用药。 不同的纳米结构材料已被用作装载佐剂和药物。Babak等人开发了具有多层碳的纳米管。该纳米管可将siRNA和DNA装载至GL261胶质瘤和BV2小胶质细胞中。该纳米平台具有惰性、可生物降解、无毒等优点,在脑肿瘤免疫基因治疗中具有优势。此外,APCs可以有效地内化纳米颗粒,在大脑的癌细胞中形成免疫级联反应。 目前,很多研究设计了不同的纳米颗粒包载方式及药物用于协同治疗胶质瘤。Zhang等提出搭载TME的iRGD-脂质纳米颗粒可提升胶质瘤患者移植CAR-T细胞的持久性和功能。利用脂质纳米载体的目的是诱导胶质瘤的治疗。一方面,它可以去除肿瘤原体细胞群(“踩刹车”),另一方面,它可以刺激必需的抗肿瘤效应细胞(“踩油门”)。最近,Shi等人开发了装载Angiopep-2和anti-PLK1 siRNA的聚合体。在小鼠研究中,它不仅改善了血脑屏障的通透性,而且极大地刺激了抗GBM活性。此外,另一项研究表明,叶酸靶向聚合胶束可以在原位胶质瘤大鼠模型中传递TMZ和抗BCL2 siRNA。脑内给予这种基于纳米载体的联合治疗可以抑制肿瘤的发展并延长生存期。最近,Kadiyala等人发明了用高密度脂蛋白模拟纳米配方修饰的纳米片(称为sHDL纳米片),该纳米片不仅可以携带胶质瘤肿瘤特异性抗原,还可以作为佐剂和生物活性化合物的载体。为了在体内和体外靶向胶质瘤,sHDL纳米片装载了CpG脱氧核苷酸、toll样受体9 (TLR9)激动剂和化疗药物多西他赛(DTX)。由于生物活性化合物增加了对胶质瘤周围免疫细胞的传递作用,利用DTXsHDL-CpG纳米片的联合化疗-免疫治疗传递系统不仅将药物靶向到肿瘤部位,而且可激活抗肿瘤免疫反应,防止肿瘤的复发。 02 胶质瘤的基因治疗 基因疗法已成为许多人类癌症的新方法,但穿过血脑屏障的转运是抗胶质瘤治疗的一大障碍。纳米颗粒可以弥补传统基因治疗的缺陷,并将治疗基因和免疫治疗药物安全运送到脑肿瘤部位。Gulsah等人开发了一种环肽iRGD修饰的固体脂质纳米颗粒,用于转运抗EGFR和PD-L1的siRNA进行联合治疗,结果显示EGFR水平降低54.7%,PD-L1水平降低58.6%。此外,辐射处理f(SLN)-iRGD: siRNA小鼠的平均寿命可增加到38天。这三种组合显著提高了小鼠的存活率。 根据现有证据,基因治疗在胶质瘤治疗中常担任调节免疫抑制信号和增强全身治疗的角色。这些方法可以以协同的方式增强免疫治疗的免疫反应。然而,关于这方面的研究不多。目前的抗胶质瘤治疗通常包括基因疗法和免疫疗法作为支持疗法。此外,基因和抗原的缺乏仍然是有效治疗的最大障碍。 03 化疗 癌症是一种复杂的疾病,涉及多种复杂的机制,如生长、进展、侵袭等过程。GBM是发生在中枢神经系统的最常见的癌症之一。2005年,一项研究报告显示口服替莫唑胺联合同步放疗的生存率为27.2% ,而单独放疗的生存率仅为10.9%。越来越多的数据表明,在单一治疗策略的情况下,容易产生耐药,导致肿瘤复发和转移。虽然联合多种药物的治疗策略应该能够克服部分困难,但存在药物累积不足、转运限制、肿瘤部位释放少、循环半衰期短等缺点,纳米技术已被研究作为克服生理障碍、增强疗效的新兴方法。 在GBM中,通过吸附或受体介导的内吞作用或载体介导的转运,纳米递送系统可搭载多种治疗药物通过血脑屏障转运,提高肿瘤在脑内的靶向性,减少副作用的产生。此外,在递送系统中引入刺激-敏感反应元件可确保药物最大限度地滞留在所需部位。 三 展望 最近在医学、生物化学、蛋白质工程和材料科学方面的突破导致了纳米靶向技术的飞速发展,但中枢神经系统疾病的纳米靶向治疗尚未应用于临床实践。纳米技术有助于增强免疫治疗、减缓肿瘤进展,提高患者生存率。用于胶质母细胞瘤免疫治疗的纳米药物需要精心设计: 1)需要独特的纳米免疫调节剂来激活巨噬细胞和DC。 2)具有选择性靶向配体(蛋白质、多肽和适体)或细胞膜衍生的囊泡的纳米载体可用于主动穿透屏障并接近APCs。 胶质母细胞瘤高度多样化,临床试验治疗效果难以分析。因此在构建纳米药物时,了解GBM的发病机制非常重要。 文章引自"Role of Nanomedicine-Based Therapeutics in the Treatment of CNS Disorders, 2023" doi:10.3390/molecules28031283返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |