胰岛β细胞再生新途径 |
您所在的位置:网站首页 › 胰岛素胰岛b细胞 › 胰岛β细胞再生新途径 |
胰岛β细胞再生新途径
|
原创 Cell Press CellPress细胞科学 收录于话题 #Cell Press青促会述评 ,71个  生命科学 Life science 作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。 2021年第三十四期(总第71期)专栏文章,由中国科学院动物研究所助理研究员 余大为,就Cell Stem Cell中的论文发表述评。   长按图片扫描二维码阅读论文 全球每11个人中就有1例糖尿病患者,糖尿病已成为危害公共健康的重大难题。导致糖尿病的主要原因是胰岛β细胞的数量减少与功能受损,找到胰岛β细胞内源性再生机制有助于开发更有效的治疗方法,因此揭示β细胞的再生途径是当下关注的一个焦点。β细胞数量的维持以前认为主要是依靠自身的增殖(Dor et al., 2004),随着谱系示踪等新技术的发展,多个研究表明β细胞还能通过不同的机制从其他细胞类型转变而来。其中有观点认为生成β细胞的前体细胞可能来自于胰腺的导管细胞,但仍存在争议。 针对上述观点,近日来自弗朗西斯·克里克研究所Axel Behrens院士等人通过结合谱系示踪、3D成像和单细胞转录组测序等方法证明了胰腺导管来源的Ngn3阳性前体细胞参与成体β细胞生成。该文章于9月2日在线发表于Cell Press旗下的期刊Cell Stem Cell。 首先作者利用Ins1-CreERT和R26-CAG-TdTomato杂交小鼠的谱系追踪系统来追踪表达胰岛素(INS)的细胞,对使用他莫昔芬注射小鼠后1个月和6个月两个时间点进行观测(图1A),免疫荧光分析发现注射他莫昔芬后胰岛β细胞的数量有明显的减少,从78%(注射一月后)降至66%(注射六月后)(图1B)。同时发现在胰岛外的导管内也发现了表达胰岛素的细胞,但是这些细胞不表达成熟β细胞的标记物Urocortin3(UCN3)。作者团队先前的工作曾报道导管细胞是产生小鼠胰岛中INS+细胞随时间推移而稀释的候选群体(Sancho et al., 2014),为了规避早期研究中出现的低谱系示踪效率的潜在问题,作者使用Hnf1b-CreERT;R26-CAG-TdTomato小鼠谱系示踪系统,并对他莫昔芬注射后1周,5周和12周三个时间点进行观测(图1E),观察到1至5周之间,追踪到的胰岛细胞的百分比有明显增加,在12周的时间点只是进一步轻微增加(图1G)。90%以上的示踪细胞表达INS或SST,追踪到的SST+细胞在1至5周显著增加,并在12周观察时显著下降(图1I)。INS+细胞在1至5周百分比变化不明显,而在5至12周出现明显的增加(图1J)。这些结果表明,随着时间的推移,由Hnf1b示踪的细胞会流入胰岛,贡献于维持β细胞的群体数量。 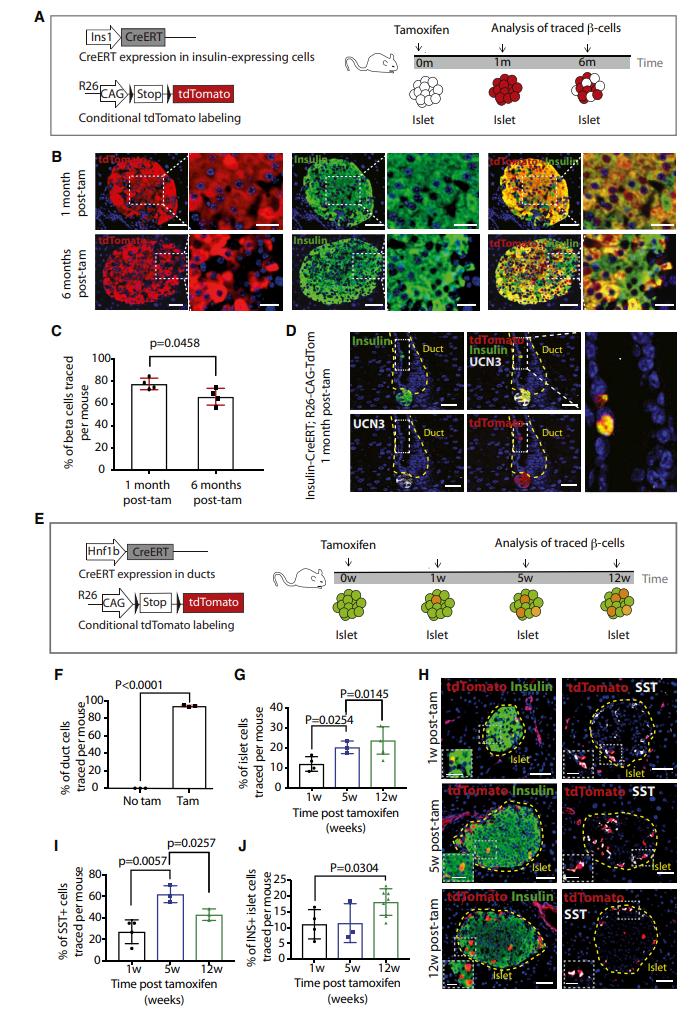 ▲图1 β细胞数量的维持不仅仅是靠自身的增殖 在导管细胞中表达一些转录因子(比如Ngn3)后能使其转分化为β细胞(Al-Hasani et al., 2013; Sancho et al., 2014; Vieira et al.,2018),所以作者认为如果导管细胞转化为β细胞,Ngn3的表达将是必需的。为了分析Ngn3+细胞的分化潜力和后代,作者构建了Ngn3-CreERT;R26-CAG-tdTomato 小鼠,并对他莫昔芬注射后1周,4周和12周三个时间点进行观测(图2A)。在导管和胰岛中都观察到了Ngn3示踪的细胞,并且都表达内分泌标记基因。对抗体染色的胰腺器官进行FLASH三维成像 (Messal et al.,2019) 发现示踪细胞位于导管外和胰岛。成像结果显示,在导管中有一小簇类胰岛细胞表达β细胞的标记C-peptide,以及存在一些表达δ细胞标记SST的细胞,它们经常共同表达C-peptide和INS(图2E)。与注射12周后相比,注射4周后能观察到更多表达激素的Ngn3示踪导管细胞(图2F),表明这些Ngn3示踪的导管细胞可能会随着时间的推移离开导管。三维成像中发现这些细胞的位置和拉长的形态也说明这些细胞可能是迁移性的。结果表明,一小部分导管细胞表达Ngn3和内分泌标记基因,这些细胞可能会迁移离开导管。 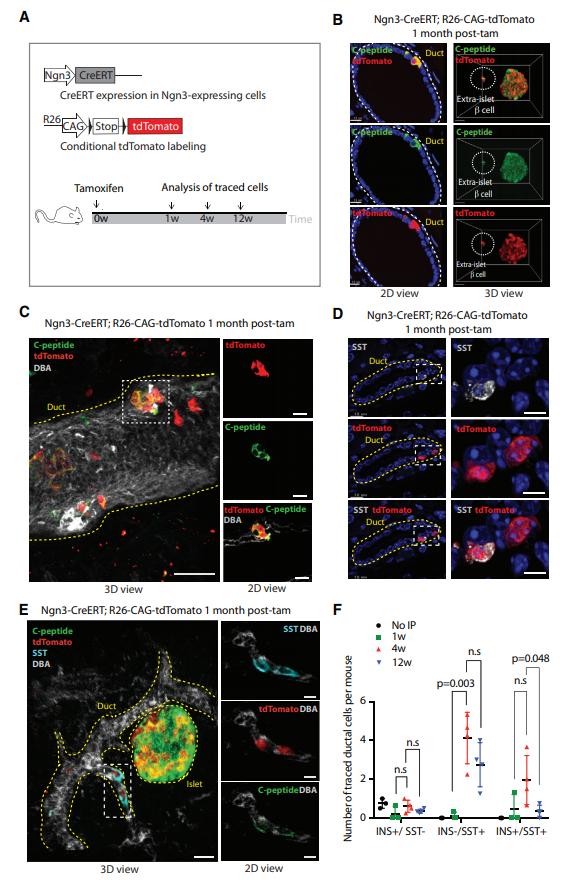 ▲图2 正常生理状态下导管中发现Ngn3标记的细胞表达SST 在正常生理状态下,导管Ngn3+细胞对维持β细胞群体的贡献远小于β细胞自身的增殖。为了确定Ngn3+细胞是否在应对β细胞需求增加时(比如糖尿病)发挥更大的作用,作者使用了AKITA糖尿病小鼠模型(Ron,2002)。与对照组相比,SST+或者INS+的导管细胞在糖尿病小鼠中更加常见,在AKITA小鼠中发现了更多的INS-/SST+导管细胞(图3C)。为了进一步研究Ngn3+导管细胞在糖尿病中的重要性,作者构建了Ngn3-CreERT;R26-CAG-TdTomato;AKITA小鼠,观察到在Tamoxifen给药后,该小鼠导管中追踪到的INS+或SST+的细胞大量增加(图3E-G)。在AKITA背景下使Ngn3的一个等位基因失活,发现Ngn3杂合子不影响野生型小鼠的血糖水平和β细胞区域,而AKITA小鼠中的Ngn3杂合性使得小鼠糖尿病表型恶化,平均血糖水平显著提升(图3I)。这些结果表明,在糖尿病期间,来自Ngn3+导管细胞的内分泌新生水平会显著增强,可能是对β细胞损失的再生反应。 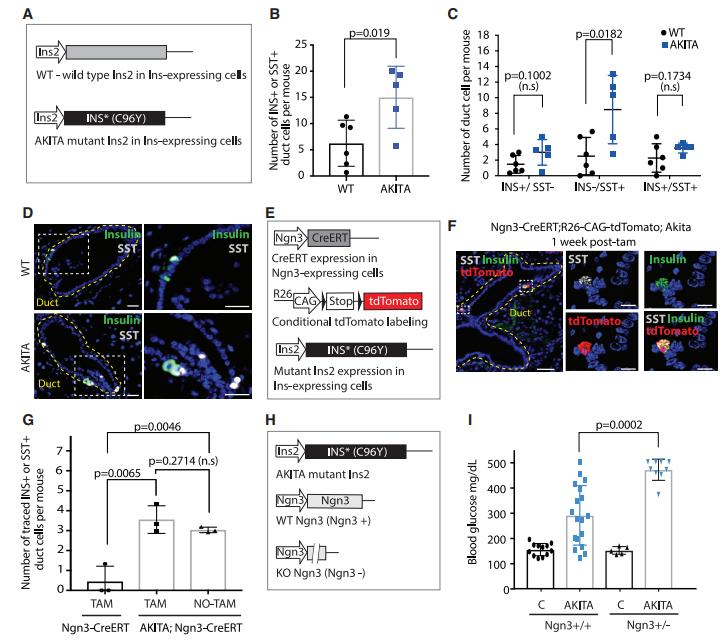 ▲图3 在糖尿病小鼠模型中Ngn3+的导管细胞对内分泌细胞群的贡献有所增加 为了继续分析Ngn3示踪的胰岛细胞的来源,作者对给药10天后的Ngn3-CreERT;R25-CAG-tdTomato小鼠身上分离出来的胰岛进行了10X scRNA-seq(图4A)。最终得到21,813个细胞,降维和聚类分析后发现几个明显的细胞类型,根据细胞标记基因对细胞群体进行注释。有趣的是,发现高表达Ins1的β细胞群体可以细分为Ucn3low/Ins1low的未成熟β细胞和Ucn3high/Ins1high的成熟β细胞群体,以及Gcghigh的成熟α细胞和Gcglow的未成熟α细胞,说明内分泌细胞存在一定的异质性。观察Ngn3+细胞和TdTomato+细胞的分布,发现虽然Ngn3+细胞大多出现在δ细胞中,TdTomato主要在成熟的β细胞中表达。进一步分析发现Ngn3+和tdTomato+细胞中各种胰岛细胞类型标记基因的表达,发现两组细胞表现出显著不同的特征,发现Hnf1b和Sox9在一些Ngn3+和tdTomato+细胞中表达,提示导管细胞的起源。Ngn3+/tdTomato+细胞的拟时序分析发现Ngn3+细胞(起始状态)产生tdTomato+ α(Gcg+)细胞和tdTomato+ δ(SST+)细胞,tdTomato+ δ(SST+)细胞后续分化成tdTomato+ β(Ins+)细胞(图4H)。因此,单细胞RNA测序结果说明由Ngn3+导管细胞衍生的SST+ δ细胞会进一步分化成成体胰腺中的成熟β细胞,这与作者前面谱系示踪的结果相一致。 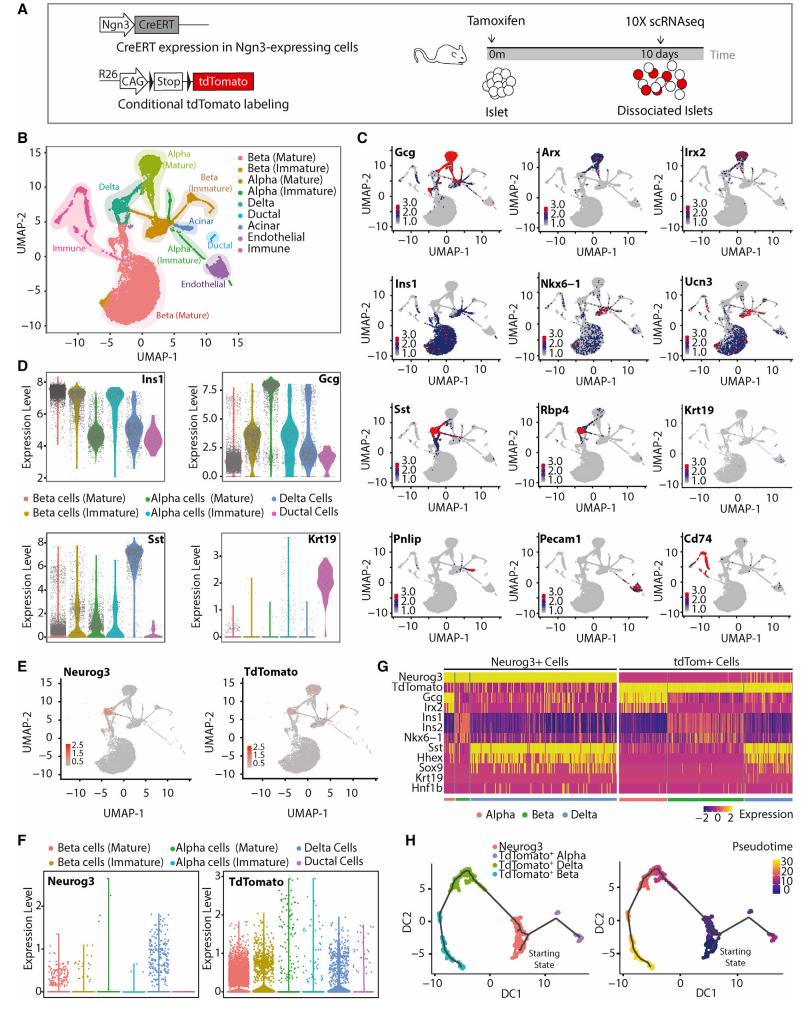 ▲图4 scRNA-seq分析发现一类成体Ngn3+细胞群体能分化成内分泌细胞 简而言之,作者通过使用一系列的谱系示踪系统,结合3D成像和scRNA-seq等技术证明:表达 Ngn3 的导管细胞是正常生理状态下和糖尿病患者中成体 β 细胞生成的一个来源,此生成机制不仅存在于发育过程中的β细胞增殖,还参与成体胰岛 β 细胞类群的维持。 本文参考文献(上下划动查看) [1] Dor, Y., Brown, J., Martinez, O.I., and Melton, D.A. (2004). Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature 429, 41-46. [2] Sancho, R., Gruber, R., Gu, G., and Behrens, A. (2014). Loss of Fbw7 repro- grams adult pancreatic ductal cells into a, d, and b cells. Cell Stem Cell 15, 139–153. [3] Al-Hasani, K., Pfeifer, A., Courtney, M., Ben-Othman, N., Gjernes, E., Vieira, A., Druelle, N., Avolio, F., Ravassard, P., Leuckx, G., et al. (2013). Adult duct-lining cells can reprogram into b-like cells able to counter repeated cycles of toxin- induced diabetes. Dev. Cell 26, 86–100. [4] Vieira, A., Vergoni, B., Courtney, M., Druelle, N., Gjernes, E., Hadzic, B., Avolio, F., Napolitano, T., Navarro Sanz, S., Mansouri, A., and Collombat, P. (2018). Neurog3 misexpression unravels mouse pancreatic ductal cell plasticity. PLoS ONE 13, e0201536. [5] Messal, H.A., Alt, S., Ferreira, R.M.M., Gribben, C., Wang, V.M., Cotoi, C.G., Salbreux, G., and Behrens, A. (2019). Tissue curvature and apicobasal me- chanical tension imbalance instruct cancer morphogenesis. Nature 566, 126–130. [6] Ron, D. (2002). Proteotoxicity in the endoplasmic reticulum: lessons from the Akita diabetic mouse. J. Clin. Invest. 109, 443–445. 论文摘要 胰腺导管细胞被认为是成体 β 细胞生成的一个来源,但目前仍存在争议。通过结合谱系追踪、3D成像和单细胞转录组测序(scRNA-seq)等方法,本文证明了随着胰腺发育时间的进程,导管细胞参与到 β 细胞类群的生成。利用Ngn3-CreERT系的谱系追踪鉴定出表达Ngn3的导管细胞,这些细胞呈δ细胞标志物生长抑素(SST)阳性,某些阶段与胰岛素共表达。在Akita+/-糖尿病小鼠模型中表达激素的导管细胞数量增加,并且ngn3杂合突变加速糖尿病发病。Ngn3 谱系追踪的胰岛细胞经过scRNA-seq 分析显示,表达生长抑素(SST)的导管来源细胞中,其中一部分仍表达导管标记物的细胞生成了 β 细胞。该研究发现表达 Ngn3 的导管细胞是正常生理状态下和糖尿病患者中成体 β 细胞生成的一个来源,此生成机制不仅存在于发育过程中的β细胞增殖,还参与成体胰岛 β 细胞类群的维持。 Ductal cells have been proposed as a source of adult β cell neogenesis, but this has remained controversial. By combining lineagetracing, 3D imaging, and single-cell RNA sequencing(scRNA-seq) approaches, we show that ductal cells contribute to the β cell population overtime. Lineage tracing using the Neurogenin3(Ngn3)-CreERT line identified ductal cells expressing the endocrine master transcription factor Ngn3 that were positive for the δ cell marker somatostatin and occasionally co-expressed insulin. The number of hormone-expressing ductal cells was increased in Akita+/diabetic mice, and ngn3 heterozygosity accelerated diabetes on set. scRNA-seq of Ngn3 lineage-traced islet cells indicated that duct-derived somatostatin-expressing cells, some of which retained expression of ductal markers, gave rise to β cells. This study identified Ngn3-expressing ductal cells as a source of adult β cell neogenesis in homeostasis and diabetes, suggesting that this mechanism, in addition to β cell proliferation, maintains the adult islet β cell population. 向下滑动阅览摘要原文 中文内容仅供参考,请以英文原文为准 述评人简介  余大为 中国科学院动物研究所助理研究员 中国科学院青促会会员 余大为,中国科学院动物研究所助理研究员,中国科学院青年创新促进会会员。研究方向为猪等农业大动物的基因编辑与胚胎工程,致力于运用基因编辑、动物克隆以及干细胞等技术进行大动物疾病模型制备、异种嵌合体与人源化大动物制备等研究工作。以第一作者或通讯作者身份在PNAS、Cell Research、Protein & Cell、 Cell Discovery等杂志发表论文12篇。 Dawei Yu is an assistant researcher in Institute of Zoology(IOZ), Chinese Academy of Sciences (CAS). He has been a “Member of Youth Innovation Promotion Association CAS” since 2021. His research direction is the applications of genome editing and reproductive engineering tools to achieve the agricultural and biomedical applications of pigs. He has published 12 papers in PNAS, Cell Research, Protein & Cell, Cell Discovery, etc. 向下滑动阅览英文简历 相关论文信息 原文刊载于CellPress细胞出版社 旗下期刊Cell Stem Cell上, 点击“阅读原文”或扫描下方二维码查看论文   中国科学院青年创新促进会(Youth Innovation Promotion Association,Chinese Academy of Sciences)于2011年6月成立,是中科院对青年科技人才进行综合培养的创新举措,旨在通过有效组织和支持,团结、凝聚全院的青年科技工作者,拓宽学术视野,促进相互交流和学科交叉,提升科研活动组织能力,培养造就新一代学术技术带头人。 Youth Innovation Promotion Association (YIPA) was founded in 2011 by the Chinese Academy of Science (CAS). It aims to provide support for excellent young scientists by promoting their academic vision and interdisciplinary research. YIPA has currently more than 4000 members from 109 institutions and across multiple disciplines, including Life Sciences, Earth Science, Chemistry& Material, Mathematics & Physics, and Engineering. They are organized in 6 discipline branches and 13 local branches. 阅读原文 |
【本文地址】
今日新闻 |
推荐新闻 |