靶向代谢专题 |
您所在的位置:网站首页 › 胆汁酸的生成过程 › 靶向代谢专题 |
靶向代谢专题
|
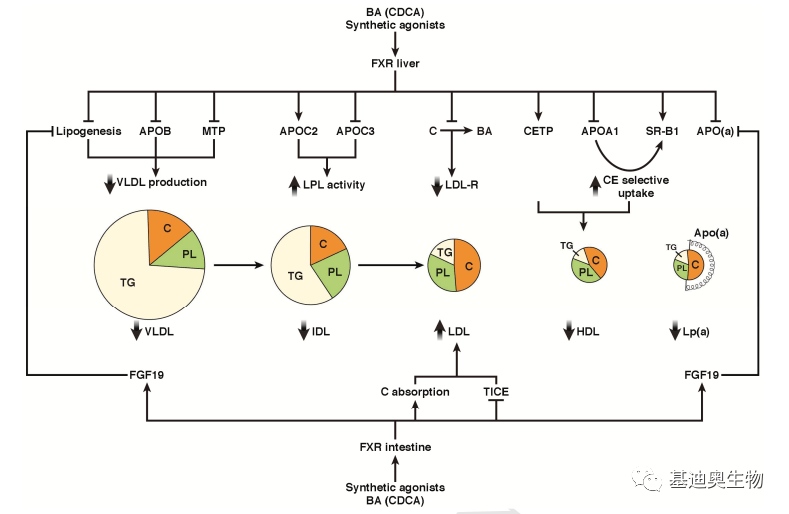
图1 胆汁酸合成途径 胆汁酸对生物体的调节作用[3] 作为一种信号分子,胆汁酸合成受到自身的负反馈调节,还可通过与肝脏中的法尼酯X受体(farnesoid X receptor, FXR)和武田G蛋白偶联受体5(TGR5)协调调节代谢和炎症过程。这些受体可激活转录网络和信号级联,控制胆汁酸、脂质和碳水化合物代谢、葡萄糖代谢、能量消耗和炎症相关基因的表达和活性。 1. 调节炎症疾病过程 FXR可在肝脏、肠道、肾脏、肾上腺、免疫细胞等多个器官中表达。胆汁酸中CDCA、DCA、CA、LCA可上调FXR丰度。配体结合的FXR与视黄酸-x-受体(RXR α,β,γ)形成异二聚体,调节靶基因表达。同时,FXR被乙酰化修饰后,可通过干扰其泛素化和反式抑制活性以增加炎症和恶化葡萄糖代谢过程。 TGR5主要在肠内分泌细胞、胆囊、骨骼肌、大脑中表达,胆汁酸中LCA、DCA、CDCA、CA可不同程度的激活TGR5。TGR5具备一定的抗炎活性,可通过激活TGR5-camp-pka轴抑制小鼠NLRP3炎症小体以减少高脂饮食(HFD)诱导的葡萄糖不耐受、胰岛素抵抗和炎症过程。 2. 胆汁酸对脂蛋白代谢的调控过程 FXR可通过肝脏脂肪生成、脂蛋白分泌、血管内重塑和血浆清除以及肠道胆固醇吸收等过程,来调节脂质和脂蛋白代谢。 在上述过程中,FXB可通过抑制肝脏中SREBP1C的表达,降低脂肪生成(Lipogenesis),还可抑制微粒体甘油三酯转移蛋白(MTP)和载脂蛋白B(APOB)的表达,以减少VLDL的分泌(下图右);在血管内重塑过程的调节中,FXB通过增强APOC2丰度,降低APOC3丰度以增强脂蛋白脂肪酶(LPL)活性,刺激TG(甘油三酯)在血管内分解;在胆固醇吸收的调节过程中,肝脏内FXR和FGF19相互作用可减少肝脏载脂蛋白(a)(Apo(a))基因丰度,进而导致动脉粥样硬化脂蛋白Lp(a)水平下降。此外,FXR还可通过降低APOA1,增加SR-B1和CETP的丰度从而增加HDL-C的清除以降低生物体血浆中HDL-C水平,反向调控胆固醇转运(RCT)和HDL代谢。
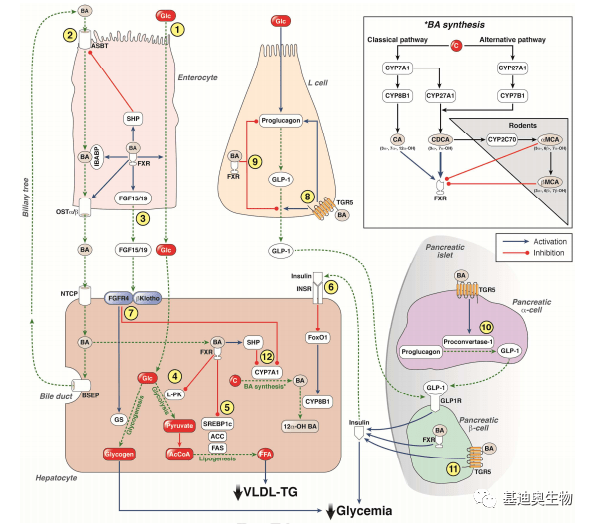
图2 胆汁酸对脂蛋白代谢的调控过程 3. 胆汁酸对葡萄糖稳态的调节 胆汁酸对葡萄糖的调节过程主要通过其直接作用于肠道、肝脏和胰腺中的FXR和TGR5。在肠道中,FXR通过抑制肝脏糖酵解和脂肪生成以减少餐后葡萄糖的分解。同时,肠内L-cell中BA与TGRS共同促进,与FXB共同抑制以平衡胰高血糖素素样肽-1(GLP-1)的分泌。慢性BAs治疗可使肠道L细胞、肠细胞、肝细胞中的FXR失活,增加GLP-1的合成和分泌,减少肠道葡萄糖吸收,增强肝脏糖酵解和脂肪生成,促进内脏葡萄糖利用。而在胰腺β细胞中FXR ,TGR5的激活以正向调节胰岛素的合成和诱导葡萄糖分泌,维持葡萄糖稳态。
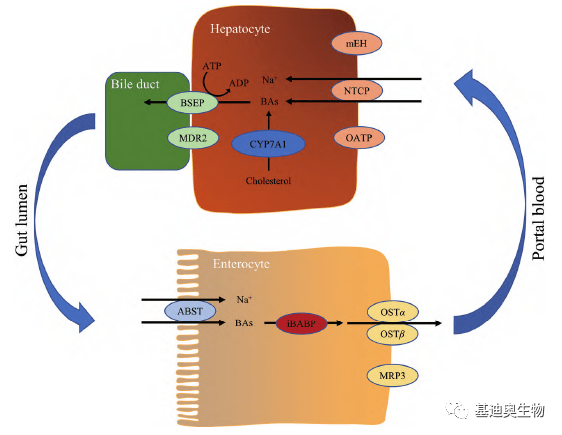
图3 胆汁酸对葡萄糖稳态的调控过程 胆汁酸的研究领域 1. 微生物菌群-宿主胆汁酸研究 胆汁酸稳态是由肠道微生物组通过复杂的相互作用和严格的调控机制,来调节全身代谢,其可作为“洗涤剂”直接改变肠道的微生态,主要表现为其可抑制细菌生长,能够阻止细菌黏附到肠道黏膜的顶端,破坏细菌膜完整性。也可以激活FXB,维持肠道菌群稳态、防止细菌移位、增强黏膜屏障防御作用。同时,肠道菌群也可反向调节胆汁酸池的大小以及各胆汁酸成分的比例,其对胆汁酸分子的修饰作用包括3种:(1)去结合作用(水解结合胆汁酸上的牛磺酸和甘氨酸集团);(2)差向异构作用;(3)脱羟基作用,作用于游离初级胆汁酸,去结合是脱羟基作用的前提 [1] 。 在小鼠热量限制饮食后体重快速反弹的研究中发现,饮食热量受到限制后,肠道内厚壁菌门,拟杆菌门的比率显著提高,其变化趋势与高脂饮食小鼠中肠道微生物群的变化模式一致。而能够产生次级胆汁酸的狄氏副拟杆菌( Parabacteroides distasonis )丰度显著减少,小鼠血清中熊去氧胆酸和石胆酸等非12α-羟基胆汁酸显著降低。当恢复饮食后,获取能量更高效的肠道微生物群显著增加,导致体重反弹。而在小鼠恢复饮食中补充狄氏副拟杆菌或非12α-羟基胆汁酸可改善节食后的体重反弹 [4] 。 2. 微生物菌群-宿主胆汁酸研究 肠道中,胆汁酸可促进脂质与脂溶性维生素的消化与吸收,并在回肠中被有效吸收,通过门静脉血运回肝脏再分明到胆汁中。此过程为胆汁酸的肠肝循环(enterohepatic circulation, EHC)。在胆汁酸的转运过程中,有4种主要的转运体被确定为EHC中的驱动因素:胆盐输出泵(bile salt export pump, BSEP)、顶端钠依赖性胆汁酸转运体(apical sodium-dependent bile acid transporter, ASBT)、有机溶质转运体α/β, OSTα/β)、牛磺胆酸钠协同转运多肽(sodium taurocholate cotransporting polypeptide, NTCP) [5] 。
图4 4种转运体介导的胆汁酸肠肝循环过程 研究表明,当胆汁酸转运体基因出现缺陷会导致肠肝循环被破坏,引发严重的代谢性疾病,以胆汁酸转运体为靶点的新药物研发逐渐成为热点领域。如对肝硬化的研究中借助scRNA-seq、蛋白质组、胆汁酸含量检测,发现组蛋白乙酰化调节因子—MCRS1,通过调节肝细胞中的组蛋白乙酰化来控制NTCP下调,进而触发肝纤维化,诱导肝损伤和炎症的发生。NTCP的下调导致BA池的异常分布,肝窦内BAs积累通过激活中肝星状细胞(HSCs)的FXR,促进肝纤维化 [6] 。 基迪奥胆汁酸检测特色 1. 多种检测方案并举。 1)标曲绝对定量。针对每种物质,独立构建标曲,实现胆汁酸的绝对定量,定量精度更精准;
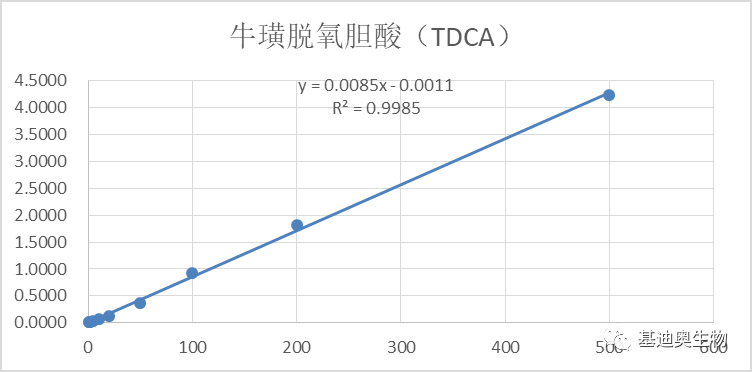
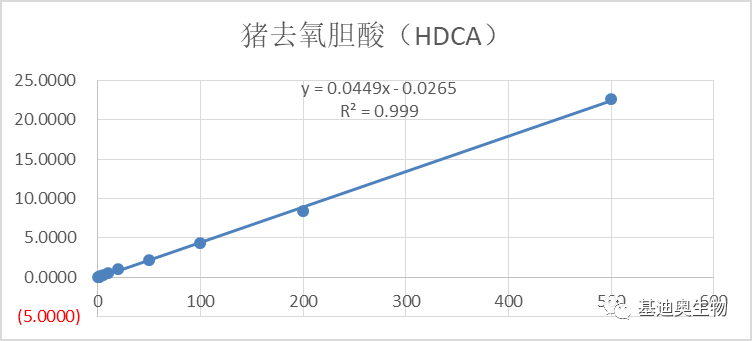
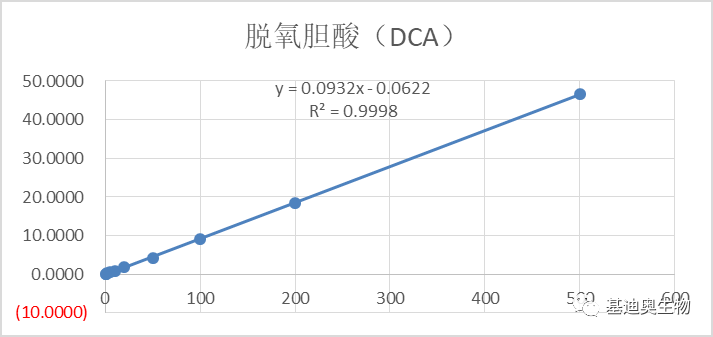
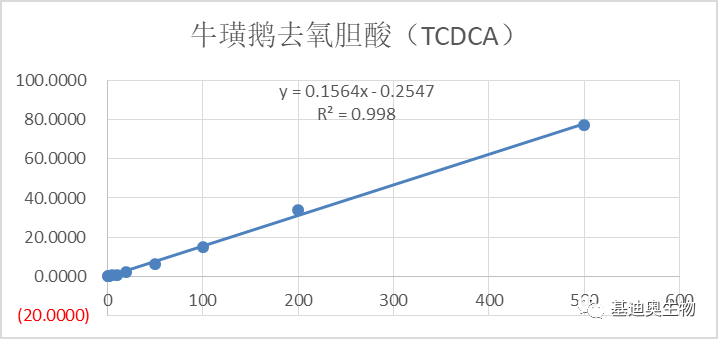
图5 部分胆汁酸标曲 2)同位素内标半定量。将一定重量的同位素纯物质作为内标物加到一定量的被分析样品混合物中,根据测试样和内标物的质量比及其相应的色谱峰面积之比及相对校正因子来计算被测组分的含量,可获得有具体单位的浓度信息。相对于1)中的绝对定量,其检测成本更低。 2. 项目经验更丰富。样本类型涉及菌类发酵产物、人、小鼠、血清、粪便等多种类型,样本处理经验更成熟。 3. 组学关联策略更成熟,项目经验更丰富。 1)靶向胆汁酸—16S关联方案:揭示胆汁酸-肠道菌群的串扰对生物体疾病进程的调控。
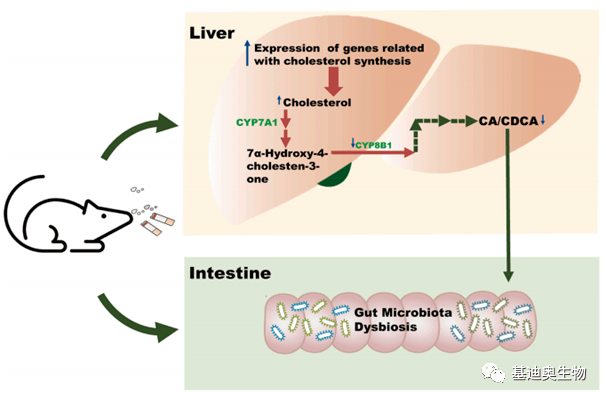
基迪奥客户文章 Toxicology(2021):4.099 图6 吸二手烟会导致肝脏中与胆固醇合成相关的基因在mRNA和蛋白水平上表达上调,CYP8B1蛋白表达降低,进而导致肝脏中TC含量升高,CA/ CDCA比值降低,肠道菌群发生变化,最终影响机体健康 [7]
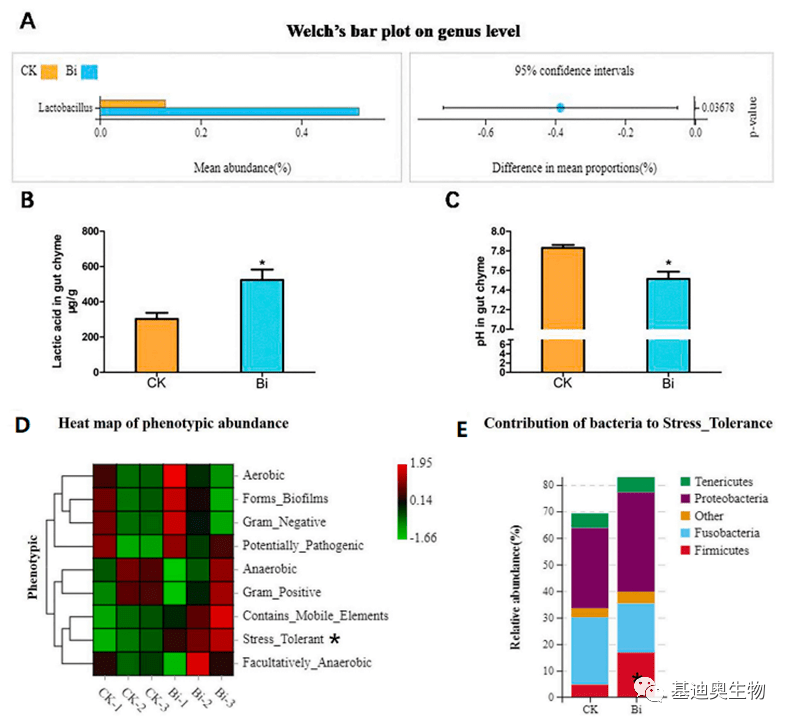
基迪奥合作客户文章 Fish and Shellfish Immunology (2022):4.581 图7 饲料中添加BAs可增加厚壁菌门(Lactobacillus)中乳酸菌(Lactic acid)的丰度(图A),乳酸菌的增加导致乳酸水平升高和pH降低(图B,C)。同时,厚壁菌门丰度的增加可提升细菌的耐压性(图D,C) [8] *注:CK为不含胆汁酸饲料,Bi组为每公斤添加900mg胆汁酸的饲料 2)靶向检测胆汁酸-转录组关联方案:借助转录组解决编码胆汁酸转运体相关基因的失调对胆汁酸积累的调控作用,进而分析疾病加重or缓解的调控机制。
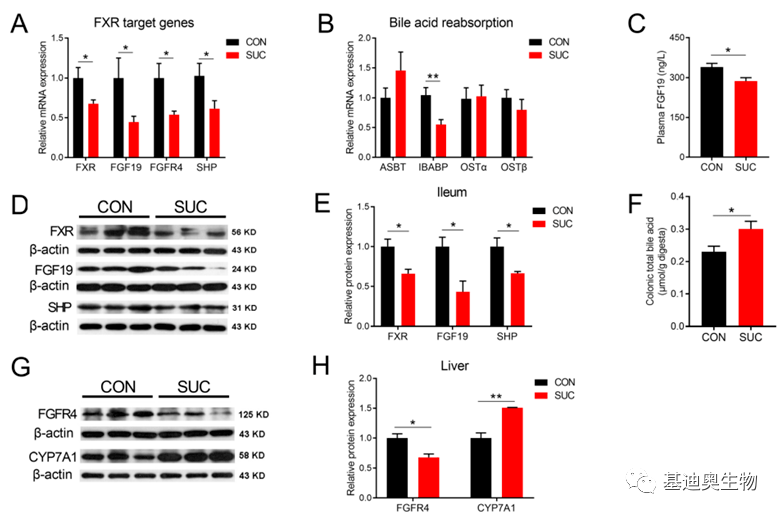
基迪奥合作客户文章 Food & Function(2022):6.317 图8 琥珀酸可抑制猪回肠中FXR的靶基因mRNA水平并增强肝胆汁酸合成 *注:CON为基础饮食,SUC为添加琥珀酸饮食。A:FXR靶基因mRNA水平;B:胆汁酸重吸收相关基因的mRNA水平;C:血浆中成纤维细胞生长因子19(FGF19)浓度;D-E:回肠FXR、FGF19和Shp蛋白水平;F:结肠总胆汁酸浓度;G-H:肝脏FGFR4和CYP7A1蛋白水平 [9] 3)靶向检测胆汁酸-单细胞转录组关联方案:以单个细胞为单位,了解不同细胞群间的互作或重点细胞群内基因表达对胆汁酸积累的调控作用。 基迪奥部分胆汁酸检测种类
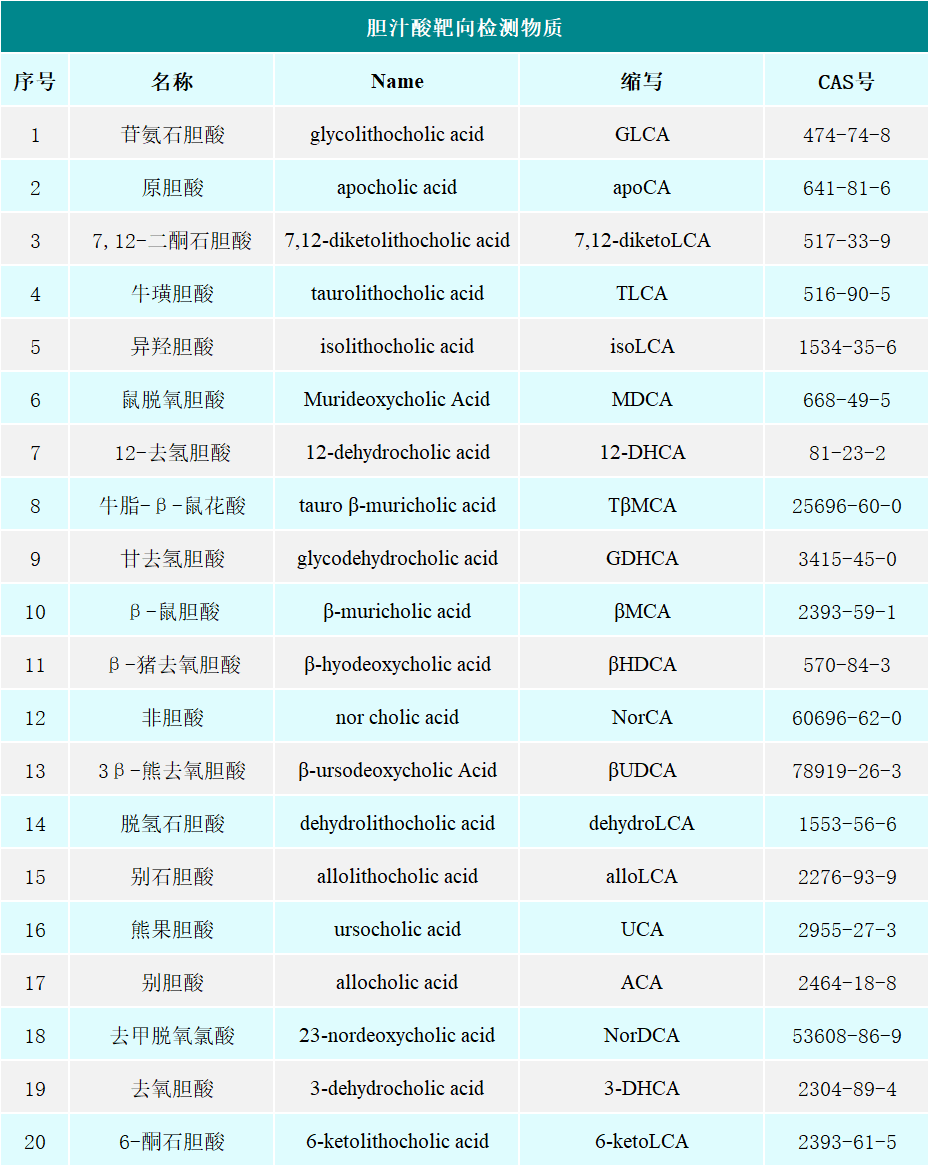
*注:表格仅列部分物质,详情可咨询基迪奥当地销售~ 参考文献 [1] 赵元辰, 崔乃强. 胆汁酸与肠道菌群相关性研究进展[J]. 中国中西医结合外科杂志, 2018, 24(5):6. [2] Thomas C, Pellicciari R, Pruzanski M, et al. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 2008 Aug;7(8):678-93. [3] Chávez-Talavera O, Tailleux A, Lefebvre P, et al. Bile Acid Control of Metabolism and Inflammation in Obesity, Type 2 Diabetes, Dyslipidemia, and Nonalcoholic Fatty Liver Disease. Gastroenterology. 2017 May;152(7):1679-1694.e3. [4] Li M, Wang S, Li Y, et al. Gut microbiota-bile acid crosstalk contributes to the rebound weight gain after calorie restriction in mice. Nat Commun. 2022 Apr 19;13(1):2060. [5] 段晓延, 扈金萍. 胆汁酸转运体与相关疾病及药物研发进展[J]. 药学学报, 2022, 57(12):11. [6] Garrido A, Kim E, Teijeiro A,et al. Histone acetylation of bile acid transporter genes plays a critical role in cirrhosis. J Hepatol. 2022 Apr;76(4):850-861. [7] Yang Y, Yang C, Lei Z, et al. Cigarette smoking exposure breaks the homeostasis of cholesterol and bile acid metabolism and induces gut microbiota dysbiosis in mice with different diets. Toxicology. 2021 Feb 28;450:152678. [8] Zhang Y, Feng H, Liang XF, et al. Dietary bile acids reduce liver lipid deposition via activating farnesoid X receptor, and improve gut health by regulating gut microbiota in Chinese perch (Siniperca chuatsi). Fish Shellfish Immunol. 2022 Feb;121:265-275. [9] Li X, Ren Y, Huang G, et al. Succinate communicates pro-inflammatory signals to the host and regulates bile acid enterohepatic metabolism in a pig model. Food Funct. 2022 Oct 31;13(21):11070-11082. *未经许可,不得以任何方式复制或抄袭本篇文章之部分或全部内容。版权所有,侵权必究。 基迪奥生物|专业定制测序服务 联系方式:020-39341079;[email protected]返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |