胃可能 尽所能 |
您所在的位置:网站首页 › 胃癌晚期存活期 › 胃可能 尽所能 |
胃可能 尽所能
|
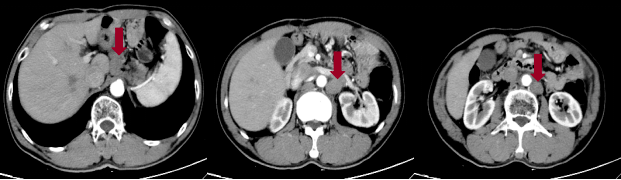
广东省器官医学与技术学会肿瘤精准医学专业委员会常委 广东省临床医学学会消化肿瘤综合治疗青年专业委员会常委 广东省临床医学学会肿瘤学专业委员会青年委员 广东省抗癌协会靶向与个体化治疗专业委员会青年委员 主持国家自然科学基金项目 基本情况 病例资料 患者:男性,59岁。 主诉:残胃癌术后6年余,发现多发淋巴结转移3年余。 既往史:1984年因“胃穿孔”行“胃毕II式”手术。2014年发现残胃低分化腺癌,并行手术治疗,围术期曾行6周期FOLFOX方案化疗(具体不详)。 既往一线治疗 2017年因腰部酸痛就诊,CT提示腹膜后淋巴结转移,4周期CapeOX方案姑息化疗后疼痛缓解,未返院行后续治疗。 2019年初再次出现腰部和骨盆疼痛,CT提示腹膜后新发较多转移性淋巴结,1周期CapeOX方案化疗,化疗后疼痛缓解;第2周期化疗期间出现奥沙利铂过敏。改为顺铂+卡培他滨(XP)5周期后卡培他滨维持至2020-05,最佳疗效PR。 本次入院后检查 2020-05月患者再次出现腰部隐痛不适入院。 影像检查:CT提示腹膜后淋巴结明显增大。
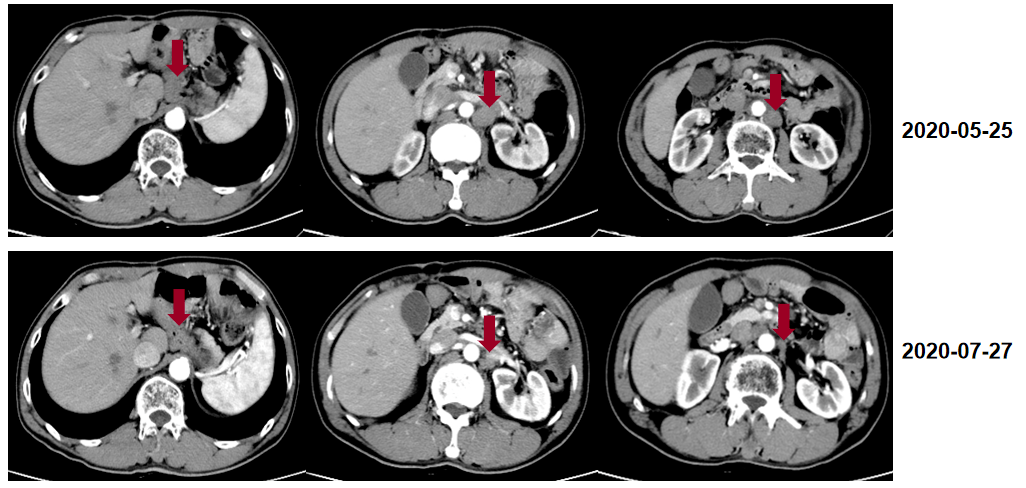
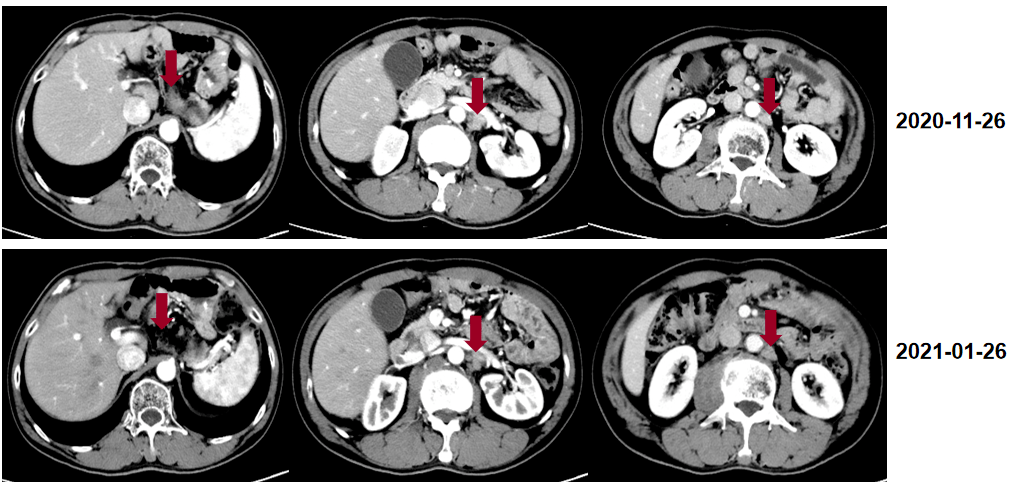
诊断 胃癌伴多发淋巴结转移。 二线治疗 2020-05至2020-09阿帕替尼 0.25g qd+卡瑞利珠单抗 200mg d1+伊立替康 280mg d1,Q14d,共8周期。期间发生III-IV度白细胞降低,应用长效升白支持。 疗效评估 患者腰部疼痛缓解。 影像学评估4周期后达PR。
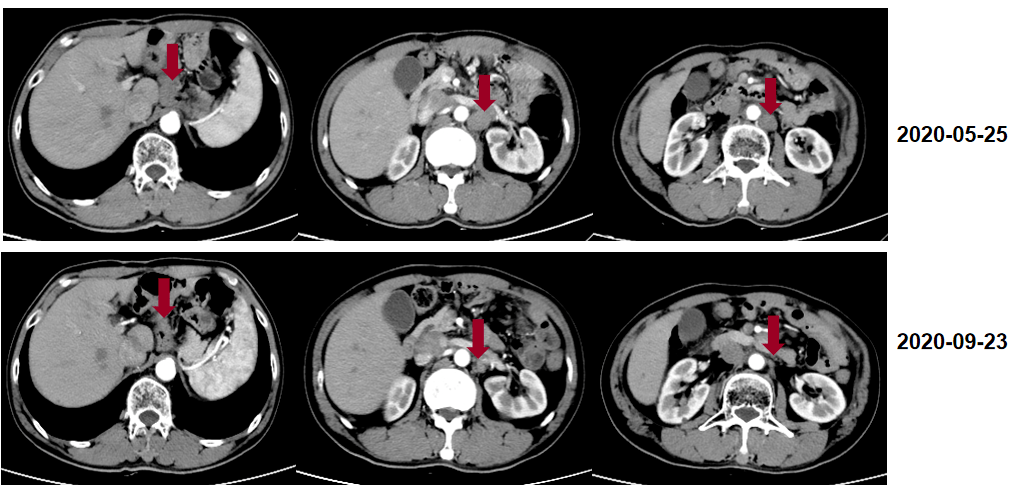
影像学评估至8周期,肿瘤继续缩小。
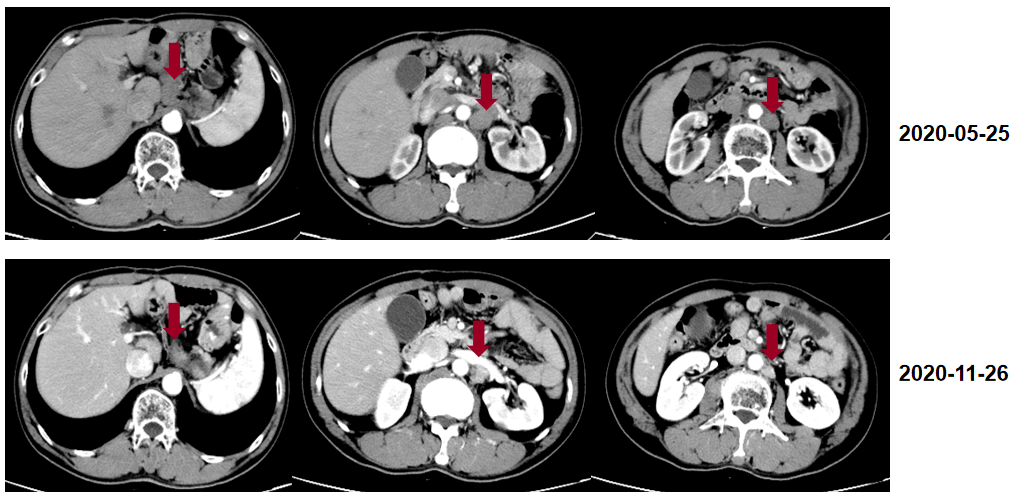
维持治疗 患者为食管上段鳞状细胞癌(cT4aN0M0 IIIB期),进行新辅助治疗+全腔镜食管癌根治术+术后辅助治疗。新辅助治疗给予2周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。全腔镜食管癌根治术后患者恢复可,术后12天顺利出院,术后分期为ypT0N0M0 0期。术后辅助治疗给予4周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。 2020-09月至2022-12月,阿帕替尼 0.25g qd+卡瑞利珠单抗 200mg,d1 Q14d。 疗效评估 患者为食管上段鳞状细胞癌(cT4aN0M0 IIIB期),进行新辅助治疗+全腔镜食管癌根治术+术后辅助治疗。新辅助治疗给予2周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。全腔镜食管癌根治术后患者恢复可,术后12天顺利出院,术后分期为ypT0N0M0 0期。术后辅助治疗给予4周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。 患者耐受良好,影像学定期评价为疾病稳定(SD)。
后续随访 患者为食管上段鳞状细胞癌(cT4aN0M0 IIIB期),进行新辅助治疗+全腔镜食管癌根治术+术后辅助治疗。新辅助治疗给予2周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。全腔镜食管癌根治术后患者恢复可,术后12天顺利出院,术后分期为ypT0N0M0 0期。术后辅助治疗给予4周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。 患者于2023-03月返院,食欲、体重下降明显,腹腔淋巴结较前增大且有新发→PD;因无法耐受后续抗肿瘤治疗,而采用对症支持治疗。 病例总结 患者为食管上段鳞状细胞癌(cT4aN0M0 IIIB期),进行新辅助治疗+全腔镜食管癌根治术+术后辅助治疗。新辅助治疗给予2周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。全腔镜食管癌根治术后患者恢复可,术后12天顺利出院,术后分期为ypT0N0M0 0期。术后辅助治疗给予4周期免疫治疗+化疗,治疗过程顺利,患者无明显恶心、呕吐不适。
本次分享的是一例胃癌伴多发淋巴结转移患者,腰痛症状明显。明确诊断后一线治疗前后共计应用CapeOX方案22周期,至2020年5月时复查提示疾病进展(PD)。二线治疗采用阿帕替尼+卡瑞利珠单抗+伊立替康方案,患者腰痛缓解,疗效评估为PR。后继续阿帕替尼+卡瑞利珠单抗维持治疗至2023-03月,期间多次随访结果显示患者耐受良好,疗效评估持续SD,PFS长达35个月。
石 敏教授 南方医科大学南方医院肿瘤内科副主任,消化肿瘤亚专科主任 主任医师,教授,博士生导师,博士后合作导师 中国临床肿瘤学会(CSCO)胃癌专家委员会委员 中国抗癌协会肿瘤靶向治疗专业委员会委员 中国抗癌协会肿瘤营养专业委员会精准肿瘤营养专家协作组副组长 广东省医师协会肿瘤内科医师分会副主任委员 广东省医学教育学会肿瘤学专业副主任委员 广东省抗癌协会抗肿瘤药物专业委员会副主任委员 广东省预防医学会肿瘤防治专业委员会副主任委员 广东省药理学会肿瘤药理专业委员会副主任委员 广东省医学会肿瘤学分会常委 广东省抗协会肿瘤靶向治疗专业委员会常委 主持国家自然科学基金面上项目4项,近年来以通讯作者身份在Molecular Cancer、Cancer Research、Oncogene等杂志发表研究性文章 选择匮乏,晚期胃癌二线治疗亟待破局 胃癌是全球第四大癌症死亡原因,疾病负担无比沉重。此外,大部分胃癌患者在确诊时常常已是晚期,预后较差且治疗选择有限。免疫治疗的出现为胃癌带来全新的希望,也带来了一线治疗失败后二线治疗如何选择的疑问。对于绝大多数晚期胃癌患者,我国临床实践中仍以推荐单药化疗为主,例如多西他赛、伊立替康或紫杉醇等等,这些方案给患者带来的临床获益非常有限。 自2012年曲妥珠单抗获批晚期胃癌一线治疗后,二线治疗也开始进入了靶向药物探索阶段,但由于胃癌生物学特性复杂,到目前为止,大部分靶向治疗研究均以失败告终。基于RAINBOW-Asia研究成果,雷莫西尤单抗于2022年获批用于胃癌二线治疗,但正如研究结果所示,雷莫西尤单抗联合紫杉醇虽提升了无进展生存期(PFS),但并未显著改善患者总生存期(OS),二线治疗仍有待突破。 阿帕替尼联合免疫疗效显著,有望塑造胃癌治疗格局,未来可期 阿帕替尼于2014年获批晚期胃癌三线治疗适应症,近十年来独自肩负着中国绝大多数三线及后线治疗患者的重担,是一个疗效可靠且更具有经济优势的选择。从机制角度来看,阿帕替尼是一种高选择性、强效的口服血管内皮生长因子受体(VEGFR)-2抑制剂,其独特的设计使激酶选择性更高,以达到更低的脱靶毒性、更高的耐受性及对靶点更加稳定的覆盖。 从阿帕替尼单药到“阿帕替尼+免疫±化疗”治疗模式,临床研究的探索也在不断为广大患者带来新的希望。山东大学齐鲁医院刘联教授及其团队开展的一项阿帕替尼联合免疫与SOX化疗用于局部进展期胃癌新辅助/转化治疗的Ⅱ期临床研究取得了积极结果,前期发表于Nature Communications杂志。在刚刚落幕的ESMO 2023上,由朱正纲教授牵头开展的AHEAD-G208研究数据重磅公布,取得了积极成果,这是最早将免疫治疗、抗血管生成治疗和化疗三者有机结合的研究,填补了当前国内外在局部进展期胃癌围术期治疗中采用化靶免三联疗法的空白,有望革新围术期的治疗选择。期待“阿帕替尼+”治疗模式可以提供更高级别的循证证据,造福更多的胃癌患者。 在靶向冶疗时代,胃癌可选择的药物有限,靶向药物集中在抗血管生成的大分子单抗类药物(雷莫西尤单抗为代表)和小分子抑制剂(以阿帕替尼为代表)。进入免疫治疗时代,胃癌的免疫治疗和靶向治疗同样进展喜人,除了主要作用于微环境的免疫治疗之外,抗血管生成治疗也亟需重新评估其应用场景。期望在未来,胃癌的免疫治疗时代和重回靶向治疗时代相结合,真正地为患者带来飞跃式提升的生存获益。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |