二代测序临床报告解读哪些是重点内容?如何理解和应用? |
您所在的位置:网站首页 › 肿瘤二代测序基因检测 › 二代测序临床报告解读哪些是重点内容?如何理解和应用? |
二代测序临床报告解读哪些是重点内容?如何理解和应用?
|
2. 体细胞变异注释及临床解读
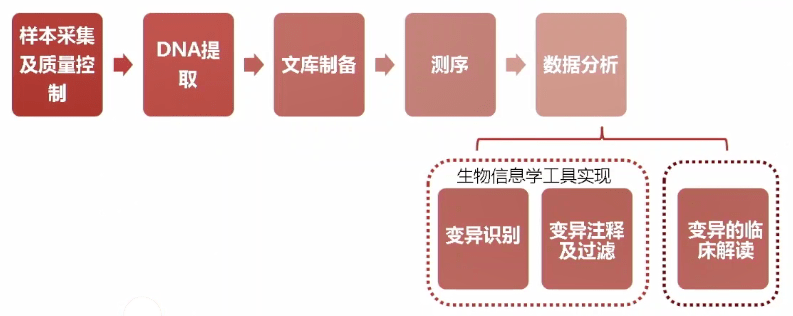
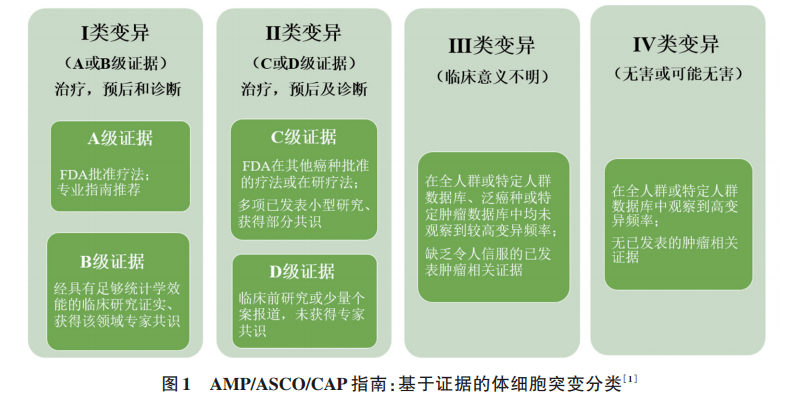
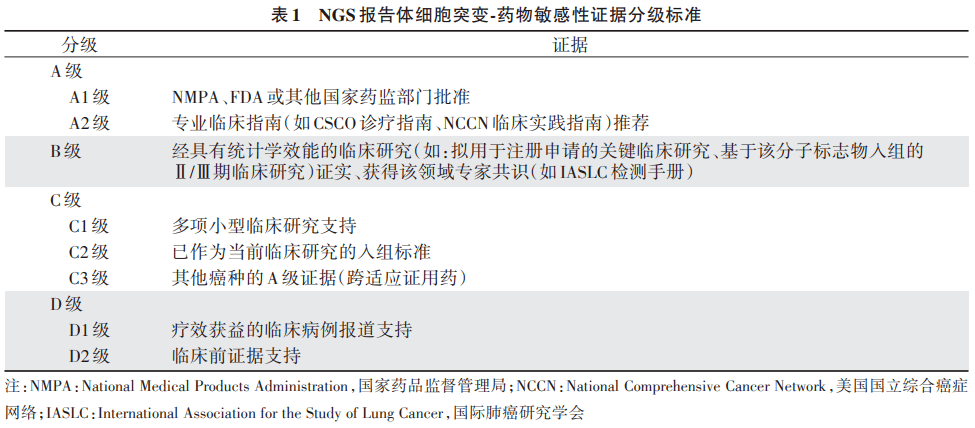
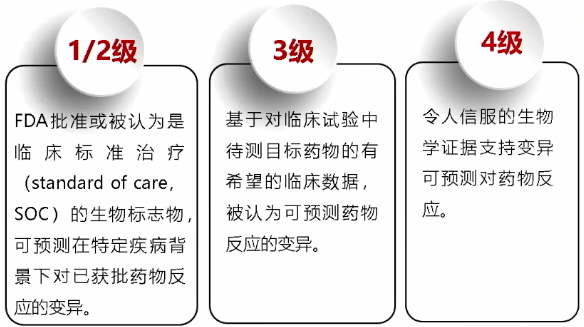
基于NGS技术检测肿瘤体细胞变异的实验流程 变异的临床解读需根据当前公共数据库及已发表文献,建立基因变异的临床解读知识库,最终将与送检样本的对应癌种及检出的基因变异相匹配的临床意义(如药物敏感性信息)及其证据级别呈现在NGS报告中。目前有多个循证分级系统可用于指导基因体细胞变异的临床解读。 ●2017年美国分子病理学协会 (AMP)/ 美国临床肿瘤学会 (ASCO) /美国病理学家协会 (CAP) 联合制定的体细胞变异解读指南 AMP/ASCO/CAP指南将基因变异按照其临床意义的重要性分为四个等级,详见图1。体细胞变异在不同癌种中对应的药物敏感性证据分为四个等级,体细胞变异对特定肿瘤的诊断及预后价值,亦给出相应分级。许多第三方NGS检测公司的临检报告即遵循该指南的分级原则对基因变异进行解读,在国内影响范围最广,详见表1。
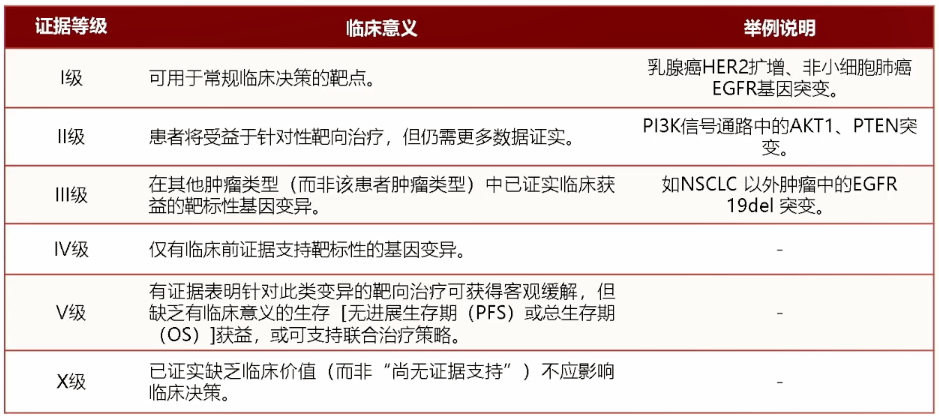
●2018年欧洲肿瘤内科学会 (ESMO) 发布的分子靶点临床可操作性量表 (ESCAT) ESCAT量表将基因变异分为六个级别。 ESCAT分类系统及其临床意义
●纪念斯隆 ⁃凯特琳癌症中心(MSKCC)的精准医疗肿瘤数据库 (OncoKB)证据等级规则 OncoKB数据库基于FDA、NCCN、ASCO指南等权威资料及其他科学文献,以及疾病专家小组的建议,对不同变异的药物预测价值进行证据分类。
医生在阅读一份NGS报告时应先了解其变异解读证据的证据分级原则及其采用知识库的局限性,以帮助自己更好地理解报告内容。
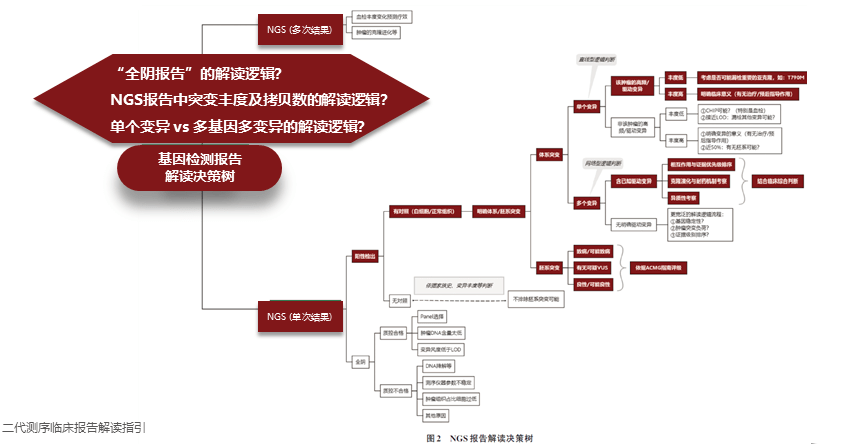
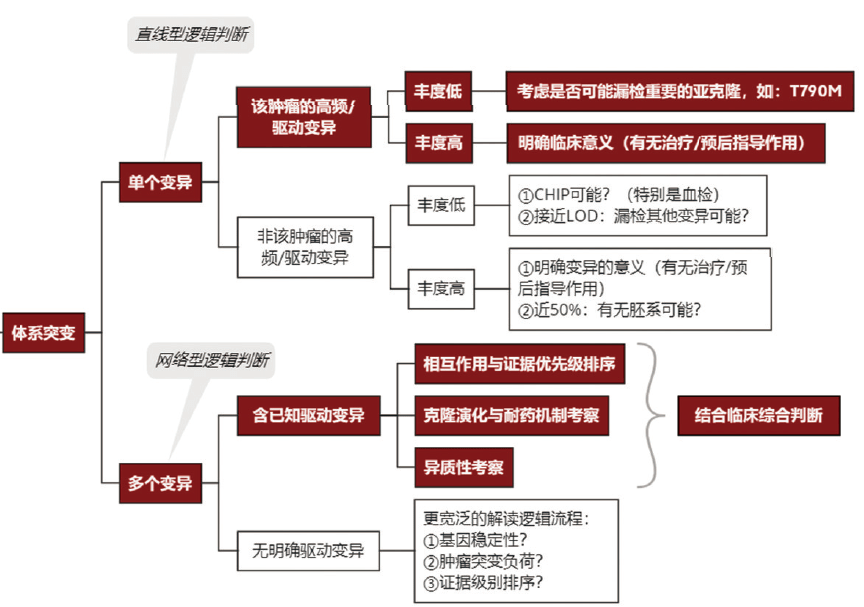
基因检测报告解读临床决策 ■针对全阴报告的解读逻辑 当医生面对一份体细胞变异“全阴报告”(即一份样本未能检出任何肿瘤体细胞突变)时,应考虑以下几方面因素,(1)技术问题:NGSPanel选择不合适;DNA提取量过低;变异丰度低于LOD。 (2)样本问题:DNA降解;组织肿瘤细胞占比过低。 (3)其他原因:测序仪参数不稳定。 ■针对突变丰度及拷贝数的解读逻辑 当医生拿到一份NGS阳性报告时,可能对其中检出的突变/重排的丰度(AF)及拷贝数变异(CNV)的拷贝数(CN)存在疑问。基于不同的样本类型,对AF及CN的理解可能存在一定差异。 首先对AF绝对数值的解读。对于组织检测结果,可以基于如下公式,根据X基因突变(或重排)的AF以及样本中的肿瘤占比,粗略判断该变异在肿瘤中的克隆占比: X基因变异AF=肿瘤占比×肿瘤中X变异克隆占比×0.5(杂合突变)[或1.0(纯合突变)/中性拷贝数LOH]。 对于CNV的解读,首先需要注意CNV有不同的报告形式,最常见的包括拷贝数(CN)及扩增倍数(ratio)。前者即一份样本提取的DNA混合物(包含肿瘤DNA及非肿瘤来源DNA)中检出的某基因的平均拷贝数(正常CN为2);后者即前者与2的比值。基于NGS检测得到的CNV的非校正CN或ratio值与荧光原位杂交(FISH)检测得到的CN值或ratio值之间存在较大差异,详见表2。 在已知肿瘤细胞占比的情况下,可通过以下公式粗略换算目标基因的肿瘤细胞CNV(即校正CNV):报告CNV=校正CNV×肿瘤占比+2×(1⁃肿瘤占比)。 ■针对单个变异对比多基因多变异的解读逻辑
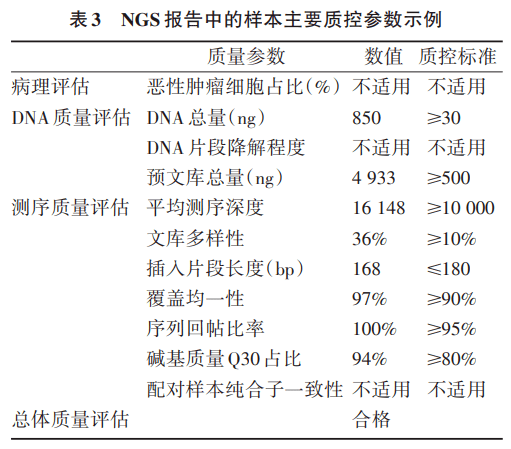
根据不同NGS Panel的可报告范围,一份NGS阳性报告中的变异可能有多有少。对于不同情况,临床医生应采取不同的解读逻辑流程。对于多基因变异、特别是多个潜在驱动变异共存的情况,要结合肿瘤类型、既往治疗史、相对突变丰度、既往分子检测结果等信息综合判读,以推测不同变异之间的逻辑关系,进一步指导后续治疗。 3.胚系突变分级注释 对检出的胚系突变,应参照美国医学遗传学与基因组学学会(ACMG)推荐的胚系突变解读流程进行注释及解读。基于当前证据,胚系变异的致病性分为5级:5级,致病;4级,可能致病;3级,意义未明(VUS);2级,可能不致病;1级,不致病。仅有4/5级胚系变异具有相应的临床指导价值。比如谈及PARP抑制剂与BRCA1/2胚系突变的相关性,或BRCA相关卵巢癌、乳腺癌的风险评估,均默认仅针对4/5类BRCA1/2突变。 4.NGS可报告的基因组标签 随着免疫治疗的快速发展,FDA已经批准肿瘤突变负荷(TMB)、微卫星不稳定(MSI)/错配修复(MMR)作为指导免疫治疗疗效的生物标志物,并且写进多个指南中。因此,基因检测报告中也应重点关注这两个生物标志物。 目前,业界对组织TMB检测有几点共识:①编码区覆盖大于1Mb(大概相当于300个以上基因的全外显子区域);②基于经过验证的可靠生物信息分析算法;③样本需满足一定肿瘤占比;④不同检测平台可能导致TMB绝对数值的差异,直接采用某一家公司/产品的肿瘤突变负荷的阈值来定义其他检测产品的肿瘤突变负荷高低是不合适的;⑤查看TMB数值时,除关注TMB绝对值,还应关注该数值在已检测的肿瘤样本中的相对排序等。 NGSpanel用于MSI检测需要整合一定数量的有效微卫星位点、构建相应的MSI算法并经过临床样本验证。对于MSI检测结果,应综合样本肿瘤占比(可参考肿瘤突变丰度)、TMB水平(微卫星高度不稳定性的肿瘤往往TMB高)、肿瘤突变谱特征(MSI-H可由MMR基因失活性突变导致,且基因突变谱往往以Indel为主)等信息综合分析。 5.可报告范围及质量控制 当临床医生拿到一份NGS报告时,应关注其样本主要质控参数、可报告范围(检测内容)、检测方法及其局限性等相关内容,具体示例详见图3及表3。相关内容可能部分位于报告首页后(如检测内容概述),而更多详细信息则以附录形式出现在报告主体内容后,故往往容易被忽略。但一份报告的结果是否真实可信,或者是否能够回答临床医生最关心的问题,恰恰严重依赖这些信息。医生应当认识到它们的重要性。
6.总结 分子检测领域的发展不仅推动了对检测的需求,也推动了对复杂结果解释和报告服务的需求。医生需要对基因检测结果进行个体化临床解读,特别是NGS大panel或WES/WGS,要把报告写得清楚明白、通俗易懂,让非遗传学专家人士如临床医生或患者也能看懂。医生在拿到一份NGS报告后,不应拘泥于一条条检测报告结果本身,而应抽提出具体信息,整合到患者的实际临床背景中去讨论,结合患者的基本临床信息以及既往的临床的诊疗综合情况来判断,并给予临床的决策指导。 专家简介
|来源:妇产科在线 点击加入基因俱乐部 成就行业精英 目前已有500+行业精英加入基因俱乐部返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |