综述|肾移植和供体特异性抗体 |
您所在的位置:网站首页 › 肾脏scr是什么意思 › 综述|肾移植和供体特异性抗体 |
综述|肾移植和供体特异性抗体
|
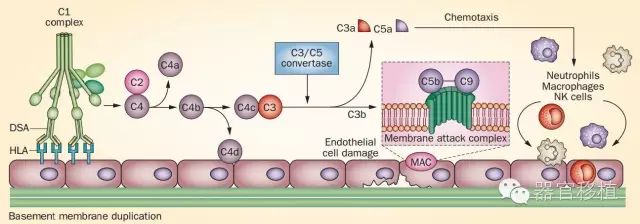
预存DSA的发生率约为14%~18%,对肾移植结果的影响与DSA的类型和强度有关。预存DSA与体液性排斥反应、细胞性排斥反应的发生,及移植物存活率降低有明显相关性。Kanter等[1]还发现预存DSA与慢性排斥反应及更差的移植结果有关,Ⅱ类DSA阳性导致移植预后更差。当补体依赖淋巴细胞毒性试验(CDC)阴性时,低水平的预存DSA与AMR相关,与急性细胞性排斥反应无相关性。固相检测技术可以量化抗体水平,从而对AMR的风险进行分层分析。平均荧光强度(meanfluorescence intensity,MFI)越高,AMR的风险越大。 1.3 新生供体特异性抗体及其对移植结果的影响 dnDSA的出现会加促抗体介导的损伤和移植物丢失,尤其是HLA-DQDSA。相对预存DSA而言,移植后dnDSA的MFI值越高,提示AMR的发生率越高。dnDSA在慢性排斥反应中亦起着重要作用。出现dnDSA的受者依临床情况可以分为以下3类:(1)急性移植物失功,即受者在两个月内血清肌酐(Scr)上升超过25%,其dnDSA的产生时间也是移植肾失功的开始时间;(2)慢性移植物失功,即受者24h尿蛋白定量超过0.5g或在移植后两个月Scr上升超过25%,其dnDSA产生至临床上移植物失功的时间平均为9个月;(3)肾功能稳定,无移植物失功,其dnDSA是在日常检查中监测到的。 dnDSA会影响移植肾功能且明显降低移植物的存活率。在一项评价儿科移植患者dnDSA的回顾性研究中,出院后随访期间(平均4.3年),dnDSA阳性组患者的Scr水平明显升高,而群体反应性抗体(PRA)阳性但非DSA阳性组患者的Scr水平无明显变化。关于dnDSA对移植物生存影响的研究报道,相对HLAⅠ类DSA多次出现,HLAⅡ类DSA的移植肾受者预后更差。dnDSA的存在使移植物失功的风险提高10倍。dnDSA的产生时间是决定移植肾生存的重要因素之一,移植后1年内产生的dnDSA至移植物失功的潜伏时间为5.1年;移植后1年之后才产生的dnDSA导致移植物丢失率较低,这类受者80%在移植后10年肾功能依然正常。HLAⅠ类DSA产生时间较早(移植后6.6个月),主要与急性移植物丢失有关,而HLAⅡ类DSA产生较晚(移植后12.5个月),主要与慢性移植性肾小球病有关。 检测到能与补体结合的DSA可以更好地预测抗体介导的损伤和移植物丢失。C1q是补体激活经典途径的第一步,因此被认为与抗体的细胞毒有关。移植前预存DSA和移植后dnDSA与C1q结合后会导致患者预后更差,且在Luminex试验中MFI值更高。Loupy等发现在移植后第1年内检测到能与C1q结合的dnDSA是5年移植物存活率明显降低的一个独立因素,而且与移植后第1年内AMR的发生、微血管炎症和损伤、肾小管周围毛细血管C4d沉积,以及第1年肾小球滤过率下降有关。 2供体特异性抗体介导免疫损伤的机制及病理改变 AMR损伤移植物的机制为同种抗体如DSA等,与移植物血管内皮细胞表面的相应抗原特异性结合后,可通过以下4条途径损伤血管内皮细胞:(1)抗原-抗体复合物通过经典途径激活补体系统,形成攻膜复合物直接损伤血管内皮(图1);(2)补体系统被激活后形成的可溶性补体片段可募集和趋化炎症细胞,导致血管内皮细胞的损伤(图1);(3)吞噬细胞可通过表达补体片段受体与沉积于内皮细胞表面的补体片段结合,发挥补体的免疫调理作用并损伤血管内皮细胞;(4)补体非依赖性抗体介导细胞毒作用(ADCC)慢性体液排斥反应对移植物的损伤机制与超急性排斥反应不同,主要通过进行性的损伤-修复-损伤的病理过程,引起血管内皮细胞和平滑肌细胞不断增生,进而导致血管壁增厚、管腔变窄甚至闭塞、动脉血管硬化、肾组织间质纤维化和肾小管萎缩、肾周毛细血管壁出现补体裂解产物C4d沉积等,从而导致移植物功能进行性减退直至完全失功。对于DSA介导免疫损伤的机制,仍有不明之处,如虽然IgM也能激活补体途径,但由IgM引起的CDC阳性对移植结果无影响。
图1 DSA损伤移植物的补体依赖性机制 AMR常常伴随着急性细胞排斥反应的发生,这两种排斥反应相互影响和促进。急性细胞排斥反应导致的炎症损伤可能会上调HLA,导致被受者B细胞识别的几率升高,从而提高DSA产生量。Willicombe等在147例移植后发生细胞性排斥反应的患者中发现,37.4%的受者移植肾存在DSA或C4d沉积,这些受者比单纯发生细胞性排斥反应的患者预后更差。Moreso等报道早期亚临床细胞性排斥反应与慢性AMR的晚期发展有关。因此,细胞炎症似乎是随后产生dnDSA和慢性AMR发展的一个危险因素。Reeve等报道干扰素(IFN)-γ诱导的转录与细胞性排斥反应有很强的相关性。移植肾上皮细胞持续表达的主要组织相容性复合体Ⅰ和Ⅱ能被IFN-γ上调。因此,我们可以假设在细胞性排斥反应中肾小管周围毛细血管在IFN-γ的诱导下,上调HLA抗原,随后活化B细胞,提高dnDSA的产生量。 早期的Banff标准中,AMR的诊断依据是存在DSA并伴随特定的组织病变以及有C4d沉积。在关于血清DSA阳性的发生率与特定组织损伤的关系的研究中,Hidalgo等发现在移植后晚期更多的患者(34%)在检出dnDSA的同时,活检出现微循环炎症改变,如肾小球肾炎、毛细血管炎、肾小球病或者毛细血管基层双轨化、C4d沉积等,提示dnDSA会加重微循环损伤。在2007年的Banff标准中,AMR的诊断需要有C4d沉积,但Sis等发现即使没有C4d沉积,内皮细胞特定基因的表达和血清中的DSA也能引起抗体介导的损伤,这也称为C4d阴性的AMR。随后,越来越多的研究发现C4d对AMR诊断并非完全特异,因此2013年的Banff会议对AMR的诊断标准进行了修改:存在血清DSA和组织损伤,并有C4d沉积或者移植物活组织检查(活检)内皮损伤中特定基因转录增加。 根据组织损伤类型的不同,Banff标准又将AMR分为急性AMR和慢性AMR。急性AMR的组织形态特征是急性肾小管损伤,中性粒细胞和单核细胞在小管周围毛细血管和肾小球的浸润,毛细血管血栓和纤维化坏死或动脉内膜炎。根据急性AMR的发生时间又可以分为早期急性AMR和晚期急性AMR。早期急性AMR多数发生在致敏患者移植后1年内,通常与预存DSA有关。而晚期急性AMR常常是由dnDSA引起,患者通常比较年轻,有对药物依从性不佳或者免疫抑制不充分的特点。与急性AMR相比,慢性AMR组织形态特点是肾小球病和毛细血管基层双轨化,其发作时间晚,进程缓慢,是晚期移植物丢失的主要原因。目前越来越多的证据显示急性AMR治疗不充分会发展为慢性AMR。 3供体特异性抗体相关抗体介导的排斥反应的治疗和预防 目前对于DSA相关AMR的预防和治疗的策略主要有:(1)通过血浆置换(plasmapheresis)清除抗体;(2)通过联合抗CD20抗体(利妥昔单抗,rituximab)+FK506+MMF或单用蛋白酶体抑制剂硼替佐米(bortezomib)来抑制B细胞,减少抗体的产生;(3)利用补体C5单克隆抗体依库珠单抗(eculizumab)阻断补体活化;(4)静脉注射免疫球蛋白(intravenousimmunoglobulin,IVIG);(5)脾脏切除。 3.1 急性AMR的治疗 暂时还没有治疗急性AMR的国际指南,仅改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes, KDIGO)推荐单独或联合使用肾上腺皮质激素(激素)、血浆置换、IVIG、利妥昔单抗或者B细胞抗体药物来治疗急性AMR。很多研究报道,单独使用血浆置换或联合低剂量IVIG、单独使用高剂量IVIG对急性AMR有一定的治疗效果。但在这些研究中,血浆置换液种类、剂量以及置换次数,IVIG给药量和给药时间都各不相同,这给治疗规范化带来一定的难度。已有研究在此基础上尝试联合利妥昔单抗、依库珠单抗或者硼替佐米,来改善急性AMR的预后,其中关于联合利妥昔单抗的研究最多。Lefaucheur等报道,与单独使用高剂量IVIG组相比,联用利妥昔单抗+血浆置换+IVIG治疗组的移植物第3年的存活率从50%上升到90.1%。但综合其它相关研究,利妥昔单抗的治疗效果依然存在争议。虽然有很多研究报道硼替佐米对急性AMR有治疗效果,但其不良反应却不能忽视。关于使用依库珠单抗治疗急性AMR的研究很少。Stegall等报道,依库珠单抗能降低急性AMR的发生率,但对移植后DSA的产生没有影响,此外延长依库珠单抗的使用时间,对慢性AMR发生率并无改变。脾脏切除术是治疗顽固性急性排斥反应的最后手段。目前已有至少3项研究报道脾脏切除术能有效治疗顽固性急性AMR,但仅在硼替佐米和依库珠单抗不能有效治疗顽固性急性AMR的情况下,才推荐使用脾脏切除术。 目前研究推荐,对于急性AMR治疗的第一步是选择激素冲击疗法或者用血浆置换、IVIG来清除抗体;第二步是使用硼替佐米或利妥昔单来治疗持续性移植肾功能减退。最后再采用依库珠单抗和脾脏切除术。 3.2 AMR的治疗 相对急性AMR,慢性AMR发生时间晚,进展缓慢,而且伴有dnDSA会影响其预后。目前报道对慢性AMR有治疗效果的方法有IVIG联合利妥昔单抗,但只有部分患者的DSA水平会下降,而且对于伴有大量蛋白尿,严重肾小管炎以及曾发生过急性AMR的慢性AMR患者,其治疗效果很差。 有数项研究对慢性AMR提倡预防性的治疗方案。Trivedi等在11例患者移植后给予硼替佐米治疗,治疗22d后有9例dnDSA水平下降。Trivedi认为,早期使用硼替佐米可以避免慢性抗体介导的损伤的发生,此项研究为蛋白酶体抑制剂能有效控制DSA的产生提供了进一步的证据,但尚需长期的临床数据支持。 目前对伴有dnDSA的慢性AMR患者的治疗效果不理想,关于该类患者的治疗研究很少。Wiebe等报道,常规免疫抑制剂、IVIG和激素冲击对dnDSA和组织病理均无改善。Walsh等报道,晚期慢性AMR几乎都存在Ⅱ类DSA,这些受者会产生针对B细胞或浆细胞治疗的免疫耐受。 3.3 AMR的预防 移植前检测有预存DSA的高致敏受者通常移植预后较差,通过脱敏可以降低这一类患者的免疫风险。目前的脱敏方案主要有注射高剂量免疫球蛋白或者进行血浆置换并注射低剂量免疫球蛋白。 血浆置换是目前预防AMR最为成熟的技术。血浆分离置换技术能快速有效地移除有害的血液成分,但必要的蛋白成分(如凝固因子和白蛋白)也伴随着抗体被一起移除。而A蛋白免疫吸附能够选择性地移除抗体,阻止有用的血浆成分丢失。 虽然现有的脱敏方案能明显改善患者和移植物的存活率,但脱敏后移植AMR的发生率依然很高。Vo等尝试联合脱敏和利妥昔单抗来降低AMR的发生率,研究显示相对用血浆置换、IVIG脱敏的AMR患者,联用利妥昔单抗的患者脱敏效果改善,有效抑制移植后DSA的反弹并预防AMR和移植性肾小球病。但在2015年的美国移植大会上,Duerr报道联用利妥昔单抗并不能增强硼替佐米对移植肾存活的改善效果,反而会增加不良反应发生率。很多新药被尝试用于降低AMR的发生率,例如依库珠单抗和硼替佐米。依库珠单抗对C5有高亲和力,能阻断C5裂解成促炎因子,从而抑制DSA介导的免疫损伤。依库珠单抗本身并不会抑制DSA的产生,但能使AMR的发生率下降。Stegall等在对高致敏患者传统的脱敏方案的基础上使用依库珠单抗,移植后急性AMR的发生率由41.2%降至7.7%,但对慢性AMR没有预防作用。已经有很多研究发现以硼替佐米为基础的脱敏疗法能够明显降低HLA抗体水平,并有望代替IVIG。 4总结 综上所述,由于目前尚没有治疗急性AMR和慢性AMR的有效方法,通过DSA监测来预防AMR具有重要临床意义。移植后DSA的监测有利于早期发现体液排斥反应,对患者进行药物预防和治疗,当受者存在DSA发生的危险因素时,应维持充分的免疫抑制。由于受者的依从性与DSA的产生密切相关,临床上应引起重视。 作者单位 作者单位:510515 广州,南方医科大学第一临床医学院临床八年制(李凯群);南方医科大学南方医院器官移植科(苗芸)返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |