膀胱癌诊疗规范(2018年版) |
您所在的位置:网站首页 › 肾癌组织学分级 › 膀胱癌诊疗规范(2018年版) |
膀胱癌诊疗规范(2018年版)
|
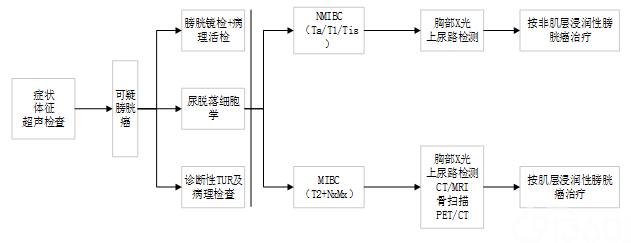
图1 膀胱癌临床诊断流程 (一)膀胱癌的临床症状及体征 血尿是膀胱癌患者最常见的临床表现,约80%~90%的患者以间歇性、无痛性全程肉眼血尿为首发症状。尿色可呈淡红色或深褐色不等,多为洗肉水色,可形成血凝块。初始血尿的患者,常提示膀胱颈部病变,终末血尿提示病变位于膀胱三角区、膀胱颈部或后尿道。少数患者仅表现为镜下血尿。 血尿的严重程度、持续时间长短及出血量与肿瘤恶性程度、分期、大小、数目、形态并不一致。 另一常见的症状是膀胱刺激征,即尿频、尿急、尿痛,这类情况常见于肌层浸润性膀胱癌或者原位癌。其他症状包括肿瘤阻塞输尿管所致的腰部不适、下肢水肿等。晚期患者在就诊时已出现体重减轻、肾功能不全、腹痛或者骨痛等晚期表现。 部分患者是体检或因其他疾病进行例行检查时偶然发现膀胱肿瘤。 体征:膀胱癌患者一般无临床体征,因此查体对早期患者(如Ta、Tl期等)的诊断价值有限。触及盆腔包块是局部晚期肿瘤的表现。 (二)影像学检查 影像学检查包括超声检查、CT及 CT尿路造影(CTU)、MRI及磁共振泌尿系水成像(MRU)、静脉尿路造影(IVU)、胸部X线摄片/胸部CT等。主要目的是了解膀胱病变程度、胸腹盆腔脏器、腹膜后和盆腔淋巴结及上尿路情况,利于判断膀胱癌临床分期。 1.超声检查 超声检查是诊断膀胱癌最常用、最基本的检查项目,包括腹、盆腔超声检查,同时检查肾脏、输尿管、前列腺、盆腔和腹膜后淋巴结及其他脏器(如肝脏等)情况。 超声检查可通过经腹、经直肠/阴道、经尿道三种途径进行。经腹超声检查诊断膀胱癌的敏感度为63%~98% ,特异度为99%。可以同时检查肾脏、输尿管和腹部其他脏器。 经直肠/阴道超声检查只须有适当的尿量即可进行,能清楚显示膀胱三角区、膀胱颈和前列腺,能近距离观察肿瘤基底部,对判断肿瘤浸润深度优于经腹部超声检查,适用于膀胱不能充盈的患者。 经尿道超声检查需在尿道表面麻醉下进行,虽然其影像清晰,判断肿瘤分期准确度比较高,但属于有创伤性检查,未广泛应用。 彩色多普勒超声检查可显示肿瘤基底部血流信号,但肿瘤血流征象对肿瘤分期、分级判断价值有限。 对比增强超声(CEUS)及三维超声联合CEUS对改善膀胱肿瘤的发现率和预测其浸润程度具有一定意义。 超声图表现:膀胱肿瘤的在超声上表现为突向膀胱腔内的低回声、斑片状或水草样病变,不随体位移动;或膀胱壁表面不规整,膀胱壁层次结构中断消失;或强回声或混合回声结节或肿块,呈乳头状或菜花状,有蒂或无蒂;肿瘤可单发或多发。彩色多普勒检查能显示肿瘤内或边缘的血流信号。 2.CT检查 CT检查(平扫+增强扫描):能诊断和评估膀胱肿瘤浸润范围。若膀胱镜检查显示肿瘤为宽基底无蒂、恶性度高、有肌层浸润的可能时建议CT检查以了解肿瘤的浸润范围。CT检查可以发现较小肿瘤(1~5mm),判断淋巴结及临近器官的是否受侵犯及转移;但对原位癌及输尿管显示欠佳;难以准确区分非肌层浸润膀胱癌(Ta、T1)和T2期膀胱癌,难以鉴别肿大淋巴结是转移还是炎症。研究显示肌层浸润性膀胱癌患者CT检查的准确率为54.9%,39%分期偏低,6.1% 分期偏高。 CT检查表现为膀胱壁局部增厚或向腔内突出的肿块。肿块形态多种多样,常表现为乳头状、菜花状和不规则形。外缘一般较光滑,肿瘤向壁外侵犯时可显示为膀胱壁外缘毛糙。较大肿块内缘常见砂粒状钙化影,大而表浅的肿瘤可出现膀胱轮廓变形。平扫肿块CT值30~40HU,增强后呈不均匀明显强化。肿瘤向壁外生长时,表现为膀胱轮廓不清楚,膀胱周围脂肪层消失,并可累及邻近的组织器官,可显示盆腔或腹膜后肿大淋巴结。 CT泌尿道成像(CTU):膀胱多发性肿瘤、高危肿瘤及膀胱三角区肿瘤患者建议行CT/CTU检查,CTU能提供更多的泌尿系统信息(包括上尿路、周围淋巴结和邻近器官的状态),可替代传统IVU 检查。 3.MRI检查 MRI检查具有良好的软组织分辨率,能够诊断并进行肿瘤分期。膀胱癌T1WI表现为尿液呈极低信号,膀胱壁为低至中度信号,而膀胱周围脂肪为高信号。T2WI表现尿液呈高信号,正常逼尿肌呈低信号,而大多数膀胱肿瘤为中等信号。低信号的逼尿肌出现中断现象提示肌层浸润。 动态增强MRI能显示是否有肌层浸润,准确度高于CT或非增强MRI;对<T3a的肿瘤准确率优于CT检查,对淋巴结的显示与CT相仿。MRI对膀胱癌的分期评估准确率为72%~96%,32%出现分期过高,但在鉴别肿瘤是否浸润肌层以及是否局限于膀胱的准确率为85%和82%。在评估是否有骨转移方面MRI敏感度高于CT,甚至优于核素骨扫描。 膀胱肿瘤的平均表观弥散系数(ADC)较周围组织低,弥散加权成像(DWI)在评估肿瘤侵犯周围组织中有价值。 磁共振水成像(MRU)检查:在不使用对比剂的情况下,MRU能显示整个泌尿道,显示上尿路梗阻部位及原因、是否有上尿路肿瘤等。MRU特别适用于对比剂过敏或肾功能不全患者、IVU检查肾脏不显影及伴有肾盂输尿管积水患者。 4.静脉尿路造影检查 (IVU) IVU检查的主要目的是显示是否伴有上尿路肿瘤。由于IVU检查诊断上尿路肿瘤的阳性率低,漏诊风险比较高,特别是小的上尿路肿瘤或尿路积水不显影时更容易漏诊。CTU、MRU检查可获得更清晰的图像,现已经逐步替代IVU检查。 5.X线摄片/胸部CT检查 胸部正、侧位X线摄片是膀胱癌患者手术前的常规检查项目,了解有无肺部转移,是判定临床分期的主要依据之一,也是术后随访的常规检查项目。肺转移瘤在胸部X线片上可表现为单个、多发或大量弥漫分布的圆形结节性病灶。对肺部转移最敏感的检查方法是胸部CT,对肺部有结节或肌层浸润性膀胱癌拟行全膀胱切除的患者推荐行胸部CT以明确有无转移。 6.全身骨显像 主要用于检查有无骨转移病灶以明确肿瘤分期,不是常规检查项目。膀胱癌患者出现骨痛或血清碱性磷酸酶升高,怀疑有骨转移可能时推荐进行检查;拟行根治性膀胱切除的患者若怀疑有骨转移风险时建议检查。 全身骨显像是目前临床上检测骨转移最常用的方法,敏感度高。可以对全身骨骼进行观察,比X线片提前3~6个月发现骨转移病灶。 膀胱癌骨转移灶为溶骨性改变,多表现为异常放射性浓聚,少数表现为放射性稀疏、缺损。脊柱是骨转移的常见部位,其次为盆骨、肋骨、颅骨及股骨、肱骨的近端。骨显像对骨转移瘤的特异度不高,尤其是对单发或少发病灶的良恶性鉴别需要CT扫描或MRI 检查确认。 7.PET-CT检查 由于示踪剂氟脱氧葡萄糖(FDG)经肾脏排泌到膀胱,影响膀胱内较小肿瘤及膀胱周围区域淋巴结的显影,且费用较高,不是常规检查项目。PET-CT诊断淋巴结转移的准确率优于CT和MRI,可应用于肌层浸润性膀胱癌患者的术前分期、对晚期膀胱患者了解转移情况及疗效评价。因显像机制不同,PET-CT 尚不能取代MRI和骨扫描在骨转移瘤诊断方面作用。 (三)尿细胞学及肿瘤标记物检查 尿液相关检查包括尿脱落细胞学检查和尿肿瘤标志物的检测。 1.尿脱落细胞学检查 针对尿液或膀胱冲洗标本的尿细胞学检查是膀胱癌诊断和术后随诊的主要方法之一。尿液中检测出癌细胞是肾盂癌、输尿管癌和膀胱癌的定性诊断之一。尿脱落细胞学检查的敏感度约为13%~75% ,特异度约为85%~100%。尿脱落细胞学检查的敏感度与肿瘤分级呈正相关,高级别肿瘤(包括原位癌)有较高的敏感度,G3和高级别尿路上皮癌及原位癌者阳性率可高达84%;在G1和低级别肿瘤中的敏感度为16%。虽然尿细胞学结果评估会受到脱落细胞少、尿路感染、结石或膀胱灌注治疗等因素影响,但总体特异度超过90%。尿中发现可疑癌细胞患者,需多次检查核实,避免假阳性结果。尿细胞学检查必须与膀胱镜检查及影像学检查同时进行,以降低漏诊率。 由于在尿液中长时间浸泡会造成脱落细胞退变,建议留取晨起第二次小便的尿液并尽快送检。 流式细胞分析技术可应用于尿细胞学检查,但临床上不能替代常规尿细胞学检查。 2.尿液膀胱肿瘤标志物检查 由于尿液细胞学的敏感度低,目前研究出多种尿液膀胱肿瘤标志物检查技术,美国FDA批准的膀胱癌尿液标志物检测方法包括核基质蛋白22(NMP22)、膀胱肿瘤抗原(BTA)、免疫-细胞检查(ImmunoCyt)、纤维蛋白原降解产物(FB/FDP)和荧光原位杂交(FISH)等。其他包括:端粒酶、存活素、微卫星分析、细胞角蛋白检查等,在检测膀胱癌的临床研究中显示了较高的敏感度,但是特异度均低于尿细胞学检查。 因尿液肿瘤标志物检测的敏感度高但特异度相对较低,尚未在临床上广泛应用。迄今为止,对膀胱癌患者,没有任何一种尿肿瘤标志物能够取代膀胱镜检查和尿细胞学检查。 (四)膀胱镜检查及活检 膀胱镜检查和活检是诊断膀胱癌最可靠的方法,也是术后复发监测的主要手段之一。原位癌主要依靠膀胱镜检查,常规影像学方法很难诊断(CT尿路造影、IVU或超声等)。膀胱镜检查包括普通硬性膀胱镜及软性膀胱镜检查,鼓励常规行无痛膀胱镜检查。若有条件,建议使用软性膀胱镜检查,与硬性膀胱镜相比,该方法具有损伤小、视野无盲区、相对舒适等优点。 膀胱镜检查可以明确膀胱肿瘤的数目、大小、形态(乳头状的或广基的)、部位、生长方式及周围膀胱黏膜的异常情况,同时可以对肿瘤和可疑病变进行活检以明确病理类型及分化程度。 当尿脱落细胞学检查阳性或膀胱黏膜表现异常时,建议行选择性活检,以明确诊断和了解肿瘤范围。尿细胞学阳性而膀胱黏膜正常、怀疑有原位癌存在时,应考虑行随机活检。原位癌、多发性癌或肿瘤位于膀胱三角区或颈部时,伴发尿道前列腺部癌的危险性增加,建议行前列腺部尿道活检明确病理。 由于发现原位癌的可能性很低(低于2%),目前不推荐对非肌层浸润性膀胱癌的正常膀胱黏膜进行常规的随机活检或选择性活检。 膀胱镜检查有可能引起泌尿男生殖系统感染、尿道及膀胱出血、尿道损伤和尿道狭窄等并发症。 1.荧光膀胱镜(fluorescence cystoscopy): 荧光膀胱镜检查是通过向膀胱内灌注光敏剂,如: 5-氨基酮戊酸(5-ALA)、HAL、吡柔比星,产生的荧光物质能高选择性积累在新生的膀胱黏膜组织中,在激光激发下病灶部位显示为红色荧光,与正常膀胱黏膜的蓝色荧光形成鲜明对比,能够发现普通膀胱镜难以发现的小肿瘤或原位癌,检出率可以提高14%~25%。 怀疑有膀胱原位癌或尿细胞学检查阳性而普通膀胱镜检查黏膜正常时,建议选择荧光膀胱镜检查。 荧光膀胱镜检查诊断膀胱癌的特异度63%,低于普通膀胱镜(81%)。特异度相对不高的原因与炎症、近期膀胱肿瘤电切术和膀胱灌注治疗等会导致假阳性结果。 2.窄谱光成像膀胱镜(narrow band imaging,NBI) NBI的原理是通过滤光器过滤掉普通内镜光源所发出红、蓝、绿中的宽带光谱,选择415nm、540nm窄带光。与传统白光模式内镜相比,显示膀胱黏膜表面微细结构和黏膜下血管较清楚,立体感更强,有助于微小病灶的早期发现与诊断,能提高膀胱原位癌的检出率,能降低术后复发率。文献报道NBI膀胱镜对膀胱原位癌诊断的敏感度、特异度和准确率均优于普通膀胱镜。只能通过NBI发现而普通膀胱镜未发现的肿瘤占17.1%。约42%尿细胞学阳性而普通膀胱镜检阴性患者在接受NBI膀胱镜检查时发现膀胱肿瘤。 3.诊断性经尿道膀胱肿瘤电切术(transurethral resection of bladder tumors,TURBt) 如果影像学检查发现膀胱内有肿瘤样病变,可以省略膀胱镜检查,直接行诊断性TURBt。目的包括:切除肿瘤;明确肿瘤的病理诊断和分级、分期,为进一步治疗以及预后判断提供依据。 四、膀胱癌的组织病理学及分期 (一)膀胱癌的组织学类型 目前,膀胱肿瘤组织学分类推荐采用2016年《WHO泌尿系统及男性生殖器官肿瘤分类》分类标准(第4版)。包括最常见的尿路上皮肿瘤,其他如鳞状细胞肿瘤、腺性肿瘤、脐尿管癌、神经内分泌肿瘤、黑色素细胞肿瘤、间叶来源肿瘤等。膀胱癌主要包括尿路上皮(移行细胞)癌、鳞状细胞癌和腺癌,其中,膀胱尿路上皮癌最为常见,占膀胱癌的90% 以上,膀胱鳞状细胞癌约占3%~7% ;膀胱腺癌比例50%)和P53蛋白表达有助于该类型的诊断。尿路上皮异型增生和浸润性尿路上皮癌发生相关,进展的发生率为15%~19%。
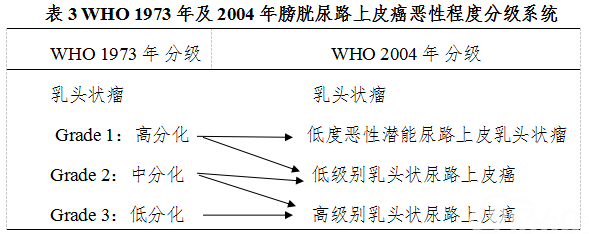
(二)膀胱癌的组织学分级、免疫组化及分子分型 膀胱癌的分级与复发和侵袭行为密切相关。膀胱肿瘤的恶性程度以分级(Grade)表示。目前普遍采用WHO分级法(WHO 1973,WHO 2004)。1973年WHO分级标准根据癌细胞的分化程度将膀胱癌分为高分化、中分化和低分化3级,分别用Grade 1、2、3或Grade I、Ⅱ、Ⅲ表示 。 WHO 2004年分级标准将尿路上皮肿瘤分为乳头状瘤、低度恶性潜能乳头状尿路上皮肿瘤(Papillary urothelial neoplasms of low malignant potential,PUNLMP)、低级别乳头状尿路上皮癌(low grade)和高级别乳头状尿路上皮癌(high grade)。推荐采用2004年及2016版的分级标准(表3、图2)。
免疫组化检测应用和分子分型:近年来国际病理协会(ISUP)提出了常用的标志物。Uroplakin III最特异,但是敏感度较低(19%~60%)。而Uroplakin Ⅱ和Uroplakin III一样特异,敏感度更高(63%~77%)。GATA3是另一个常用的标志物,67%~90%的尿路上皮癌表达。100%的病例表达CK7,而67%的病例表达CK20,50%~62%的病例共同表达CK7和CK20。14%的高级别尿路上皮癌不表达CK7和CK20。而高级别尿路上皮癌表达CK34βE12。P63是另一个高表达的蛋白(81%~92%)。还有S-100P也是尿路上皮癌一个有用的标志物。 尿路上皮癌分子分型根据CK5/6、CD44、CK20和P53表达情况分为基底样型(Basal)、管腔样型(Luminal)和野生型P53样型,与预后相关,基底样型预后最差,野生型P53样型预后最好。 (三)膀胱癌的分期 采用最广泛的是美国癌症分期联合委员会(American Joint Committee on Cancer Staging,AJCC)制订的TNM分期系统,推荐应用2017年第8版。根据肿瘤是否浸润膀胱肌层分为非肌层浸润性膀胱癌(Non-muscle-invasive Bladder Cancer NMIBC)和肌层浸润性膀胱癌(Muscle-invasive Bladder Cancer MIBC)(表4)。
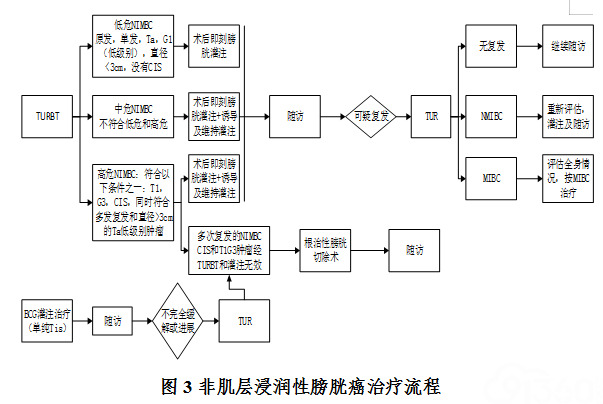
膀胱癌诊断及病理分级、分期的基本原则如下。 1.需询问病史,体格检查、超声、泌尿系CT/MRI 检查或CTU/MRU检查、胸部X 线/或胸部CT检查。 2.怀疑膀胱癌的患者应行膀胱镜检查;对可能需要行根治性膀胱切除术或需要化疗的患者,建议同时病理活检;部分患者行诊断性TURBT明确病理结果及病理分期。 3.怀疑原位癌、尿脱落细胞阳性而无明确肿瘤、无黏膜异常者应考虑随机活检,可选择荧光膀胱镜或NBI 膀胱镜检查。 4.肌层浸润性膀胱癌有骨痛或碱性磷酸酶升高怀疑有骨转移者,建议骨扫描检查。 5.尿膀胱肿瘤标志物是一种无创检查方法,对可疑尿路上皮肿瘤诊断;中、高危尿路上皮癌患者术后是否复发转移有辅助作用。 6.推荐采用膀胱癌2017 TNM分期系统(AJCC)进行病理学分期;推荐采用2016版WHO膀胱尿路上皮癌分类标准。 五、膀胱癌的治疗原则 非肌层浸润性膀胱尿路上皮癌(non-muscle-invasive bladder cancer,NMIBC)的标准治疗手段首选经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBt),术后根据复发危险决定膀胱内灌注治疗方案。非肌层浸润性膀胱癌治疗流程 (图3)。
肌层浸润性膀胱尿路上皮癌(muscle-invasive bladder cancer,MIBC)、鳞状细胞癌、腺癌、脐尿管癌等以外科手术为主的综合治疗,手术主要为根治性膀胱切除术;部分患者可选择行膀胱部分切除术;T2-T4aN0M0期膀胱尿路上皮癌可选择术前新辅助化疗,术后根据病理结果的高危因素决定是否辅以术后全身化疗和(或)放疗。转移性膀胱癌以全身化疗为主,可用姑息性手术、放疗缓解症状。肌层浸润性膀胱癌治疗流程(图4)。
六、非肌层浸润性膀胱癌的治疗(NMIBC)(Ta,T1和Tis) (一)非肌层浸润性膀胱癌的危险度分级 非肌层浸润性膀胱癌是指局限于膀胱黏膜层(Tis、Ta)及固有层(T1),且肌层未见浸润的膀胱乳头状恶性肿瘤,既往称为表浅性膀胱癌(superficial bladder cancer),约75%的患者初诊时为非肌层浸润性膀胱癌,其中Ta占70%、T1占20%、Tis占10%。Ta和T1分期虽然都属于非肌层浸润性膀胱癌,但两者的生物学特性有显著不同,固有层内血管及淋巴管丰富,因此T1期容易发生扩散。 影响NMIBC复发和进展的危险因素包括:肿瘤的数量、大小、分期、分级、复发频率、是否存在原位癌。 与复发相关的主要危险因素包括肿瘤的数量(≥8个)和复发频率(>1次/年);与进展相关的主要危险因素包括分期(T1)、分级(G3或高级别)和存在原位癌。根据复发风险及预后的不同,NMIBC 可分为以下3组(表5)。
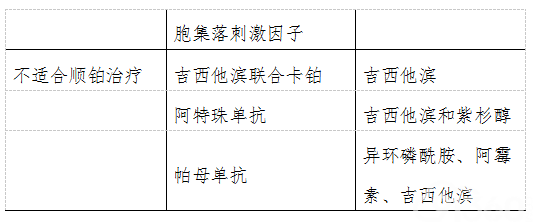
(二)手术治疗 1.经尿道膀胱肿瘤切除术(TURBt)及并发症 (1)TURBt既是非肌层浸润性膀胱癌的标准治疗方式,也是重要诊断方法,因其具有创伤小、出血少、术后恢复快的优点,是非肌层浸润性膀胱癌的首选治疗方式。膀胱肿瘤确切的病理类型、分级、分期均可根据首次TURBt后的病理结果确定。 TURBt两个目的:一是切除肉眼可见的全部肿瘤,二是切除肿瘤组织进行病理分级、分期。 肿瘤完全切除的方式包括分块切除(包括肿瘤、膀胱壁基底及切除区域边缘)或整块切除(用单极或双极电切、铥激光或钬激光整块切除肿瘤是可行的,约96%~100%的患者切除标本中有逼尿肌)。 如果肿瘤较小(小于1cm),可以将肿瘤与其基底的部分膀胱璧一起切除送病理检查;如果肿瘤较大,则行分块切除,先切除肿瘤的突起部分、然后切除肿瘤的基底部分,切除直至露出正常的膀胱壁肌层,标本中需包含膀胱肌层成分。在所有可见肿瘤被切除完毕后,应用电切环多切一片基底组织或用活检钳钳取小块基底组织送病理检查,利于确定病理分期及下一步治疗方案。TURBt时尽量避免烧灼,以减少对标本组织的破坏。 门诊膀胱镜检查时发现的复发小Ta/G1肿瘤可选择直接电灼治疗,能减轻治疗负担,是可选择的治疗手段之一,目前尚无前瞻性比较研究来评估肿瘤的预后。 Meta分析12项随机对照研究,共2258例肌层非浸润性膀胱癌采用荧光膀胱镜引导下手术,与常规手术相比能显著降低术后复发率、延长首次复发时间间隔,延长无复发生存时间,提高肿瘤检出率,但未能显著降低进展为肌层浸润性膀胱癌的风险。 研究显示NBI指示下进行膀胱肿瘤电切手术,与白光下电切术相比,能够降低低危非肌层浸润性膀胱癌患者术后1年复发率(5.6%及27.3%)。 根据上述研究结果,采用荧光引导下的电切或NBI引导下TURBt,能提高肿瘤的发现率,但能否提高患者总体疗效尚有待进一步证实。 (2)TURBt术后并发症:TURBt术后早期最常见的并发症是少量血尿和膀胱刺激症状,常能自行缓解,主要并发症包括膀胱穿孔、持续性出血和尿道狭窄。 1)膀胱穿孔:应分辨穿孔属于腹膜内还是腹膜外。对于腹膜外穿孔,可延长留置导尿管时间,一般可以自愈。对于腹膜内穿孔,建议进行开放性手术修补。在TURBt手术过程中,应注意避免过度充盈膀胱、切除侧壁肿瘤时可配合应用肌松剂防止闭孔反射等来防止膀胱穿孔。 2)术后出血:TURBt术后血尿,积极保守治疗无效的患者,常需要进行内镜下电凝处理,除了处理原先切除的创面外,还需彻底检查其余的膀胱黏膜和膀胱颈,彻底取出血块。内镜止血后应嘱患者暂停抗凝药物并避免增加腹压的动作。 3)尿道狭窄:TURBt手术时尽量避免损伤尿道。轻度尿道狭窄首选尿道扩张术,操作时应手法轻柔,避免出血。 2.非肌层浸润性膀胱癌二次电切 NMIBC电切术后,肿瘤残余是肿瘤术后复发是重要原因之一。研究显示,TURBt 术后肿瘤残留与肿瘤分期、大小、数目以及医师技术相关,单发肿瘤残留率为22%,多发肿瘤的残留率达45%,直径50ml/min。 MIBC患者术前放疗:MIBC患者术前接受放射剂量45~50 Gy放疗(RT),4~6周后出现病理降期(pCR)达 (9%~34%)。有研究认为术前RT能减少根治性膀胱切除术后的局部复发率。但目前缺乏高质量研究证据支持术前RT能减少MIBC患者根治性膀胱切除术后的局部复发率,能提高患者生存率。五项随机试验的荟萃分析显示MIBC患者术前新辅助放疗五年生存率无显著差异。因此目前不推荐术前放疗。 (四)MIBC术后辅助化疗(adjuvant chemotherapy) 肌层浸润性膀胱癌患者膀胱切除术后是否进行辅助化疗目前尚没有结论。目前尚缺乏前瞻性 对照研究证据。有多项Meta荟萃分析显示:MIBC患者术后行辅助化疗使死亡风险降低23%,提高无复发生存期(DFS)。回顾性研究5653例行根治性膀胱切除术患者,术后23%进行辅助化疗,显示辅助化疗能提高患者总生存期。 目前研究显示,术后辅助化疗对于未转移的MIBC患者生存期的改善,循证医学证据不如新辅助化疗。临床研究证实有高危复发风险的患者术后接受含顺铂的联合化疗可以降低肿瘤复发率,支持肌层浸润性膀胱癌[pT3/4和(或)PN+M0],特别是未进行术前新辅助化疗的高复发风险的患者进行术后辅助化疗。目前临床中多采用以铂类为基础的联合化疗方案。 (五)保留膀胱的综合治疗 对于身体条件不能耐受根治性膀胱切除术,或不愿接受根治性膀胱切除术的肌层浸润性膀胱癌患者,可以考虑行保留膀胱的综合治疗。但目前尚存在不同程度的争议,需慎重考虑及选择。 保留膀胱的手术方式有两种:TURBt和膀胱部分切除术。对于多数要求保留膀胱的MIBC患者,通过TURBt最大限度切除肿瘤后进行放化疗是此类患者的基本治疗方案。 由于肌层浸润性膀胱癌淋巴结转移比例较高,需要与选择保留膀胱治疗的患者进行仔细沟通,对肿瘤性质、浸润深度进行综合评估,选择保留膀胱的手术方式,并辅以术后辅助化疗和放疗,术后需密切随访,必要时行挽救性膀胱切除术。 肌层浸润性膀胱癌患者施行保留膀胱综合治疗的5年总体生存率为45%~73%,10年总体生存率为29%~49%。 目前保留膀胱的治疗方法有以下几种。 (1)单纯TURBt 部分肿瘤局限于浅肌层,且对肿瘤基底二次电切术活检阴性的患者可采用,术后行BCG膀胱灌注治疗。 (2)TURBt 联合外放射治疗 主要适用于不适合根治性膀胱切或不能耐受化疗的患者。这组患者5年存活率为30%~60%,肿瘤特异存活率从20%~50%。 (3)TURBt联合化疗 病理完全反应率为8%~26%。对T3/4期患者使用顺铂为基础的化疗,其CR和PR率分别为11%和34%。3周期化疗后,通过膀胱镜和活检再次评估是否有残余病灶,如病灶仍存在,则行挽救性根治性膀胱切除术。 (4)TURBt联合放、化疗 最大限度TURBt手术后,以顺铂为基础的化疗联合放疗可使完全缓解率达到60%~80%。40%~45%的患者保留膀胱存活4~5年,长期存活达50%~60%(与根治性膀胱切除术相仿)。若联合治疗不敏感,推荐早期行根治性膀胱切除术。 (5)膀胱部分切除术联合化疗 约5%的肌层浸润性膀胱癌可通过膀胱部分切除达到治愈的目的,约27% 的患者避免根治性膀胱切除术。 由于单一的治疗手段难以达到理想的保留膀胱的效果,目前保留膀胱的治疗多采取手术、化疗和放疗的三联综合治疗。该治疗方案的选择指征必须严格控制,患者必须具有良好的依从性,才能得到较好的治疗效果。 (6)体外放射治疗(EBRT) 一项包含340例MIBC患者的研究,分为单纯EBRT、EBRT同步化疗或新辅助化疗联合EBRT治疗组。总CR率为55%,10年疾病特异生存(DSS)和总生存(OS)分别为35%和19%。单纯EBRT后,完全缓解率为64%,同步化疗为79%,新辅助化疗为52%。年龄越小,肿瘤分期越低,无Tis与生存率的改善显著相关。 作为保留膀胱综合治疗一种手段,EBRT适用于不耐受或不接受膀胱切除术的MIBC患者,不推荐单纯放疗。 (六)cT4b期及淋巴结阳性患者的治疗 cT4b期且淋巴结阴性患者推荐的基本治疗是系统化疗或放疗联合化疗。化疗2~3个周期后评估疗效,40~45Gy剂量放疗3周后评估疗效。若没有肿瘤则继续巩固治疗或姑息性膀胱切除术。若有肿瘤残存,可选择更改化疗方案、放疗或姑息性膀胱切除术。 cT4b期伴淋巴结阳性患者的治疗:建议行系统化疗或同步放化疗,若评估无进展,可增加放疗剂量或姑息性膀胱切除术。如伴发严重血尿、输尿管肾盂严重积水等可姑息性膀胱切除并尿流改道。 (七)尿流改道术 根治性膀胱切除时应同期行永久性尿流改道手术,对年老体弱不能耐受较大手术或因肿瘤引起肾功能严重受损的患者,应先行尿流改道手术,再择期行根治性膀胱切除手术。 尿流改道术尚无标准治疗方案。目前有多种方法可选,包括不可控尿流改道、可控尿流改道及肠代膀胱手术等。 手术方式的选择需要根据患者的具体情况,如年龄、伴发疾病、预期寿命、盆腔手术及放疗史等,并结合患者的要求及术者经验认真选择。保护肾功能、提高患者生活质量是治疗的最终目标。 随着腹腔镜技术的普及,腹腔镜手术和机器人辅助的腹腔镜手术也己应用于多种尿流改道术。现多采用在腹腔镜下行膀胱切除术后通过小切口在腹腔外行尿流改道术。腹腔镜下尿流改道方式选择原则与开放性手术基本相同。 目前主要有以下几种尿流改道术式。 1.原位新膀胱术( orthotopic neobladder) 原位新膀胱术由于患者不需要腹壁造口,保持了生活质量和自身形象,已逐渐成为根治性膀胱切除术后尿流改道的主要手术方式之一。首选末段回肠去管化制作的回肠新膀胱,如Studer膀胱,M形回肠膀胱等。有报道显示去带乙状结肠新膀胱亦取得较好疗效,升结肠、盲肠、胃应用相对较少。术后1年日间控尿率可达87%-96% ,夜间控尿率可达72%-95%。 缺点:可能出现尿失禁和排尿困难,部分患者需要长期导尿或间歇性自我导尿。 原位新膀胱应满足以下条件:①尿道完整无损和外括约肌功能良好;②术中尿道切缘阴性;③肾脏功能良好;④肠道无明显病变。 禁忌证:高剂量术前放疗、复杂的尿道狭窄、生活不能患者、肿瘤侵犯膀胱颈及尿道。 2.回肠膀胱通道术(ileal conduit) 回肠通道术是一种经典的简单、安全、有效的不可控尿流改道的术式,是不可控尿流改道的首选术式,也是最常用的尿流改道方式之一。 主要缺点是需腹壁造口、终身佩戴集尿袋。术后早期并发症可达48%,包括尿路感染、肾孟肾炎、输尿管回肠吻合口漏或狭窄。主要远期并发症是造口相关并发(24%)、上尿路的功能和形态学上的改变(30%)。各种形式的肠道尿流改道中,回肠通道术的晚期并发症要少于可控贮尿囊或原位新膀胱。 伴有短肠综合征、小肠炎性疾病、回肠受到广泛射线照射的患者不适于此术式。 无法采用回肠的患者,可采用结肠通道术(colon conduit)作为替代术式。横结肠膀胱术对于进行过盆腔放疗或输尿管过短的患者可选用。 3.输尿管皮肤造口术(Ureterocutaneostomy) 输尿管皮肤造口术是一种简单、安全的术式。适用于预期寿命短、有远处转移、姑息性膀胱切除、肠道疾患无法利用肠管进行尿流改道或全身状态不能耐受手术者。 输尿管皮肤造口术后出现造口狭窄和逆行泌尿系感染的风险比回肠通道术高。 4.其他尿流改道方法 (1)经皮可控尿流改道术 由肠道去管重建的低压贮尿囊,抗反流输尿管吻合和可控尿的腹壁造口组成,患者术后需间歇性自行插管导尿。该术式并发症发生率高,目前已趋于淘汰。 (2)利用肛门控尿术式 利用肛门括约肌控制尿液的术式包括:①尿粪合流术,如输尿管乙状结肠吻合术;②尿粪分流术,如直肠膀胱术。 无论采用何种尿流改道方式,患者术后应定期复查,了解是否存在上尿路梗阻、感染以及结石情况,及时治疗以保护肾功能。 八、转移性膀胱尿路上皮癌的治疗 膀胱癌患者确诊时约10%~15%已发生转移,根治性膀胱切除术的患者术后约50%出现复发或转移,其中局部复发占10%~30%,其余大部分为远处转移。 主要治疗方法包括全身化疗、化疗联合放疗或单纯放疗等。基于顺铂的联合化疗是转移性膀胱尿路上皮癌的最重要的标准治疗方案。 尿路上皮癌细胞已被证明对于铂类、吉西他滨、阿霉素及紫杉醇等化疗药物敏感。常用的一线化疗方案包括:GC、DD-MVAC(改良MVAC强化方案)和MVAC等方案。转移性膀胱尿路上皮癌患者对于含铂类药物的联合化疗方案总体反应率可达50%左右,几乎所有人都会进展,中位生存时间约为14个月,五年生存率约5%~20%。 (一)化疗 化疗是转移性膀胱尿路上皮癌患者最重要的治疗方法(表7)。 1.转移性膀胱癌的一线化疗方案 能耐受顺铂的患者:吉西他滨联合顺铂;DD-MVAC联合粒细胞集落刺激因子(G-CSF)。 不能耐受顺铂的患者:卡铂联合吉西他滨;Atezolizumab(阿特珠单抗)及Pembrolizumab (帕姆单抗);吉西他滨联合紫杉醇。或异环磷酰胺、多柔比星、吉西他滨序贯化疗(肾功能及身体状态好)。 (1)GC方案(吉西他滨联合顺铂) GC方案是目前临床最常用的标准一线治疗方案,不良反应较MVAC方案较低而疗效相似。吉西他滨1000mg/第1、8天静脉滴注,顺铂70mg/m2,第2天静脉滴注,每3周(21天方案)为一个周期。GC方案的CR为15%,PR为33%,中位疾病进展时间为23周,中位总生存时间为13.8 个月。 (2)改良MVAC强化方案(DD-MVAC) DD-MVAC方案:甲氨蝶岭30mg/m2 第1天静脉漓注,长春碱3mg/m2,阿霉素30mg/m2,顺铂70mg/m2 第2天静脉滴注,每2周重复,化疗期间常规预防性应用粒细胞集落刺激因子。由于不良反应低而疗效与MVAC方案相当,已经逐渐取代MVAC方案。 (3)CMV 方案 甲氨蝶呤30mg/m2 、长春碱4mg/m2,1,8天静脉滴注,顺铂100mg/m2 第2 天静脉滴注,每3周为一个周期。一般应用三个周期。一项三期临床实验中,CMV新辅助化疗被证明可降低死亡风险16%,提高10年生存率6% ,因而可用于新辅助化疗。 2. 转移性膀胱癌的二线治疗 在二线线治疗中可选择的药物包括:多西他赛、紫杉醇、吉西他滨、培美曲塞、异环磷酰胺、阿霉素等药物,根据患者耐受情况可选择单药或联合化疗。 可选择应用唑来膦酸治疗骨转移瘤。 (二)转移性膀胱尿路上皮癌的免疫治疗 以铂类药物为基础的联合化疗是转移性膀胱尿路上皮癌的基本治疗手段,总生存时间为9~15个月,若患者化疗后再次复发,中位生存时间为5~7个月。 1.PD-1/PD-L1 抑制剂 PD-1/PD-L1免疫治疗是应用针对程序性细胞死亡-1(PD-1)蛋白或其配体(PD-L1)的抗体,通过阻断PD-1/PD-L1信号通路,利用人体自身的免疫系统抵御癌症,使癌细胞死亡,改善患者总生存期(OS)(表8)。 目前美国FDA已经批准免疫药物包括PD-L1抑制剂: Atezolizumab(阿特珠单抗);Durvalumab;Avelumab。 PD-1抑制剂:Pembrolizumab(派姆单抗);Nivolumab(纳武单抗)。 主要用于接受以铂类为基础的联合化疗治疗中或治疗后12个月内出现进展的局部进展期或转移性尿路上皮癌患者。Atezolizumab及Pembrolizumab批准为不能耐受以铂类药物为基础的化疗患者的一线治疗选择。Pembrolizumab是既往接受铂类药物化疗后出现进展和转移患者的二线治疗方案。 (1)阿特珠单抗(Atezolizumab) Atezolizumab是美国FDA批准的第一个转移性膀胱癌靶向治疗药物,阿特珠单抗属于免疫检查点调节剂,特异性抑制PD-L1,在高表达PD-L1的膀胱癌患者中效果良好,对于低表达PD-L1的患者也有一定的作用,不良反应相对较小。 Atezolizumab:II期研究310例既往接受过铂类药物治疗的转移性膀胱尿路上皮癌患者,治疗组总反应率为15%,显著高于对照组10%,84%的患者在大约一年后仍然对这种药物产生反应。另一项II期临床研究,目的是评估Atezolizumab作为一线治疗不能耐受铂类药物化疗的局部晚期或转移性尿路上皮癌患者;共入组119例,客观反应率为23%,9%患者达到CR,中位OS为15.9个月。三级及以上 的副反应为16%。一项多中心III期随机对照研究,比较Atezolizumab 与化疗(紫杉醇、多西他赛、长春碱)。共931例既往接受过铂类药物化疗后出现复发或进展的晚膀胱尿路上皮癌患者。Atezolizumab治疗组中位OS为11.1个月,与化疗组(10.6个月)没有明显区别,客观反应率分别为23%及22%,没有显著差别。三级及以上的不良反应为20%,而化疗组为43%。阿特珠单抗常见不良反应有:疲劳、食欲下降、恶心、呼吸困难、腹泻(18.6%)、发热、皮疹、呕吐、关节痛、无力、瘙痒。 (2)Durvalumab Durvalumab可用于治疗局部晚期或转移性尿路上皮癌的患者。 II期临床研究分析191例PD-L1阳性不适合手术或转移性膀胱尿路上皮癌,接受以铂类药物为基础的化疗后进展的患者。患者总客观反应率为(ORR)17.8%(PD-L1高表达者为27.6%;低表达或不表达者为5.1%),中位OS为18.2个月。55%患者随访1年时存活。3级以上不良反应发生率为6.8%。 (3)Avelumab 一项II期临床研究共249例既往以铂类药物化疗无效或不适合铂类药物治疗的转移性膀胱尿路上皮癌患者,Avelumab治疗的客观反应率为17%,其中6%为CR,11%为PR。三级及以上的不良反应为8%。 (4)派姆单抗(Pembrolizumab) 一项开放性III期随机对照研究(KEYNOTE-045研究):比较Pembrolizumab与化疗(紫杉醇、多西他赛、长春碱),共542例既往接受过铂类药物化疗后复发或进展的晚期膀胱尿路上皮癌患者。Pembrolizumab治疗组中位OS为10.3个月,明显优于化疗组(7.4个月)且不良反应轻。 在不同PD-L1表达的亚组中保持一致,不论患者的年龄、ECOG评分、以前是否接受治疗、肝转移状态、组织学类型和化疗方案如何,派母单抗组的OS明显优于化疗组。派母单抗组与化疗组18个月的生存率分别为36.1%(30.1%~42.0%)和20.5%(15.2%~25.8%)。两组间的PFS没有差异。与化疗组相比,派母单抗组的ORR较高(21.1%对11.0%),中位缓解持续时间更长。 另一项II期临床研究,评估Pembrolizumab作为一线治疗不能耐受铂类药物化疗的晚期尿路上皮癌患者;共入组370例,总有效率为24%,5%患者达到CR,三级及以上 的副反应为16%。 (5)纳武单抗(Nivolumab) Nivolumab的II期研究,265例既往接受过铂类药物治疗出现进展的转移性膀胱尿路上皮癌患者,治疗组客观反应率为19.6%,中位OS 8.74个月,三级及以上的不良反应为18%。PD-L1表达率1%患者,OS为5.95个月~11.3个月。 目前Atezolizumab、Durvalumab、Avelumab、Pembrolizumab、Nivolumab作为以铂类药物为基础的化疗无效后的二线治疗手段,而Atezolizumab 及Pembrolizumab可作为不适合铂类药物为基础的化疗的患者的一线治疗选择。 2.其他治疗药物 许多研究也聚焦于其他靶向治疗药物对于转移性膀胱尿路上皮癌患者的疗效,主要包括VEGF抑制剂贝伐单抗、舒尼替尼、索拉菲尼;针对EGFR的西妥昔单抗、吉非替尼、曲妥单抗、厄洛替尼等;针对MET和VEGFR2的卡博替尼、针对CTLA-4的单克隆抗体Ipilimumab 等治疗药物在临床实验之中。
九、膀胱癌的放疗 肌层浸润性膀胱癌患者如不愿意接受根治性膀胱切除术、全身状态不能耐受根治性膀胱切除手术,或肿瘤已无法根治性切除时,可选用放射治疗或化疗联合放疗。但对于肌层浸润性膀胱癌,单纯放疗患者的总生存期短于根治性膀胱切除术。 膀胱癌的放疗可分为根治性放疗、辅助性放疗和姑息性放疗。 (一)根治性放疗 膀胱外照射方法包括常规外照射、三维适形放疗及调强适形放疗。单纯放射治疗靶区剂量通常为60~66Gy,每天剂量通常为1.8~2Gy ,整个疗程不超过6~7 周。目前常用的放疗日程为:① 50~55Gy,分25~28次完成(>4周);② 64~66Gy ,分32-33 次完成。放疗的局部控制率约为30%~50%。 肌层浸润性膀胱癌患者5年总的生存率约为40%~60%,肿瘤特异生存率为35%~40% ,局部复发率约为30%。最近有文献报道,对于肌层浸润性膀胱癌患者保留膀胱,放疗联合化疗不会增加副反应,但能有效的提高局部控制率。 (二)辅助性放疗 术前4~6周的放疗,肿瘤降期的患者约40%~65% ,10%~42% 的患者提高局部肿瘤控制率,但根治性膀胱切除术前放疗对延长患者生存是否有益尚不明确,因此不推荐术前放疗。根治性膀胱切除或膀胱部分切除术未切净的残存肿瘤或术后病理切缘阳性者,推荐行术后辅助放疗。 (三)姑息性放疗 保守治疗无效、保留膀胱治疗后复发;非尿路上皮癌的治疗(对放疗及化疗反应差);局部晚期膀胱癌(cT4b,侵及盆腔或腹壁)合并严重血尿、疼痛、排尿困难及尿路梗阻、瘘管形成。cT4bN0~XM0 MIBC,经化疗或放疗后疗效显著者也可选择膀胱切除。 通过短程放疗(7Gy×3天,3~3.5Gy×10天)可减轻因膀胱肿瘤引起无法控制的症状,如血尿、尿急、疼痛等。但这种治疗可增加急性肠道并发症的危险,包括腹泻和腹部痉挛疼痛等。 十、不能根治的膀胱癌患者的治疗 (一)姑息性膀胱切除 对于手术无法治愈的局部晚期膀胱癌患者(T4b),常伴有出血、疼痛、排尿困难和尿路梗阻。对于顽固性血尿的晚期膀胱癌的患者,姑息性膀胱切除及尿流改道是有效治疗方法。但手术风险较高,一般仅在没有其他选择的情况下采用。 局部晚期膀胱癌导致输尿管梗阻、尿毒症,可选择姑息性膀胱切除及输尿管造口或永久性肾造瘘术以解除梗阻,改善肾功能,利用化疗。 (二)对症治疗 不能根治的膀胱癌患者常存在以下问题:疼痛、出血、排尿困难和上尿路梗阻。支持治疗在这些患者中有重要的意义。 1.出血和疼痛 对于无法根治的膀胱癌患者出现血尿,首先要明确患者是否存在凝血功能障碍或是否有使用抗凝药物。对于肿瘤填满膀胱腔的患者,难以进行经尿道电凝或激光凝固止血,予膀胱内灌注1%硝酸银或1%~2%的明矶可以达到较好的止血效果,且无需麻醉。放疗具有一定的止血、止痛作用。若上述各种方法均无法控制出血,膀胱切除+尿流改道是最后的选择。 2.上尿路梗阻 输尿管内支架(首选)、肾造瘘可以有效解决上尿路梗阻,若输尿管支架管难以顺利置入,尿流改道(加或不加姑息性膀胱切除)也是解除上尿路梗阻的有效措施之一。 十一、随访 膀胱癌患者接受根治性膀胱切除术和尿流改道术后必须进行长期随访,随访重点包括肿瘤复发和与尿流改道相关的并发症。 有学者推荐pTl期患者每年进行一次体格检查、血液生化检查、胸部X 线检查和B 超检查(包括肝、肾、腹膜后等);pT2 期患者6个月进行一次上述检查而pT3 期肿瘤患者每3个月进行一次。此外,对于pT3 期肿瘤患者应该每半年进行一次胸腹盆腔CT 检查。 上尿路影像学检查对于排除输尿管狭窄和上尿路肿瘤很有价值,上尿路肿瘤虽然并不常见,但是一发现往往需要手术治疗。 MIBC及转移性MIBC患者治疗的基本原则见图4。 1.对于肌层浸润性膀胱尿路上皮癌(T2~T4a,N0M0)首选根治性膀胱切除术,并同时进行标准盆腔淋巴结清扫,必要时行扩大盆腔淋巴结清扫。 2.若肿瘤侵犯男性尿道前列腺部及(或)其远端、女性膀胱颈部及(或)其远端尿道,或手术尿道切缘阳性时,应行全尿道切除术。如果边缘阴性,可保留尿道。 3.特殊情况下可选择保留膀胱的治疗方法,须与患者充分沟通并告知风险,应辅以放、化疗,并密切随访。 4.尿流改道方式的选择应与患者充分沟通,告知尿流改道的术式及其优缺点。回肠膀胱术并发症相对较少,是首选的尿流改道方式之一。在有条件的医疗中心,对有适应证的患者可推荐采用原位新膀胱术。输尿管皮肤造口术适用于高龄、身体状态差、肠道无法使用的患者。 5.对于cT2~cT4a期肌层浸润性膀胱拟行根治性膀胱切除术治疗的患者,推荐术前新辅助化疗。推荐GC方案或DD-MVAC或CMV 方案。不推荐应用卡铂和非铂联合化疗。病理为pT3~4/N+ 患者,推荐术后辅助化疗。 6.PD-1/PD-L1免疫治疗是转移性膀胱尿路上皮癌患者可选择的治疗方案。推荐作为化疗失败患者的二线治疗方案;以及作为不能耐受以铂类药物为基础的化疗患者的一线治疗选择。 7.对于肌层浸润性膀胱癌,化疗及放疗是保留膀胱综合治疗的手段。 8.有转移或局部浸润明显不能根治性切除的患者,可以选择姑息性放疗或姑息性膀胱切除,提高生活质量。如有上尿路梗阻,可选用肾造瘘、输尿管内支架、输尿管造口等方法解除,改善肾功能。 9.根治性膀胱切除术后患者需根据肿瘤分期确定随访方案并进行终身随访。 十二、膀胱非尿路上皮癌 (一)膀胱鳞状细胞癌(Squamous cell carcinoma,SCC) 膀胱鳞状细胞癌(SCC)可分为非血吸虫病性膀胱SCC和血吸虫病性膀胱SCC,在我国主要是前者。 细菌感染、异物、慢性下尿路梗阻或膀胱结石等引起的慢性炎症以及膀胱黏膜白斑、长期留置导尿管等可能与膀胱SCC的发生有关。 膀胱SCC 多发于膀胱三角区和侧壁,主要是溃疡和浸润,很少呈乳头样生长,约8%膀胱SCC确诊时已经发生转移。 血尿是主要的临床表现,93%的患者伴有泌尿系统感染。诊断主要靠膀胱镜活检。 单纯的膀胱SCC患者推荐行根治性膀胱切除术。根治性膀胱切除术疗效优于放疗,术前放疗加根治性膀胱切除术比单纯根治性膀胱切除术效果更好,有助于预防盆腔复发。单纯放疗效果差,不推荐单独应用。膀胱SCC化疗有效率低,缺乏权威有效的化疗方案。NCCN指南认为部分患者可以选择紫杉醇、异环磷酰胺及顺铂方案化疗;另外,顺铂、吉西他滨及异环磷酰胺对膀胱SCC有效。膀胱SCC的5年生存率约为50%。 (二)腺癌(Adenocarcinoma) 根据组织来源膀胱腺癌可分为三种类型:原发性非脐尿管腺癌、脐尿管腺癌、转移性腺癌。膀胱镜活检,超声、CT以及MRI等检查可显示肿瘤大小、侵犯范围及临床分期,特别是对脐尿管腺癌。 1.非脐尿管腺癌 非脐尿管腺癌与移行上皮腺性化生有关系。长期的慢性刺激、梗阻及膀胱外翻则是引起化生的常见原因,常伴腺性膀胱炎。 膀胱腺癌主要症状有血尿、尿痛、膀胱刺激症状、黏液尿。 原发性膀胱腺癌发生于膀胱三角区及膀胱侧壁,病变进展较快,多为肌层浸润性膀胱癌。 临床就诊时大多数已属局部晚期,推荐行根治性膀胱切除术。经尿道切除或膀胱部分切除术的疗效差。术后辅以放疗,可以提高肿瘤无复发生存率。进展期和已远处转移的患者可以选择化疗,推荐选用5-氟尿嘧啶为基础的化疗方案。 2.脐尿管腺癌 脐尿管腺癌与脐尿管上皮增生及其内覆移行上皮腺性化生有关,约占膀胱腺癌的1/3。脐尿管腺癌发生在膀胱顶部前壁,可浸润到膀胱壁深层、脐、Retzius间隙及前腹壁。脐尿管腺癌诊断时分期较高,有较高的远处转移风险。 脐尿管腺癌的治疗:手术治疗是其最主要的治疗手段,包括扩大性膀胱部分切除术和根治性膀胱切除术。放疗和化疗的效果不佳。 扩大性膀胱部分切除术:整块切除膀胱顶、脐尿管和脐,切除范围包括部分腹直肌、腹直肌后鞘、腹膜及弓状线。术后复发和转移是治疗失败的主要原因。 手术切缘是否阴性及淋巴结是否转移是影响预后的重要因素,总体5 年生存率为40% ,平均生存46个月。 3.转移性腺癌 转移性腺癌的原发病灶包括来自直肠、胃、子宫内膜、乳腺、前列腺和卵巢。治疗上以处理原发病为主的综合治疗。 (三)膀胱小细胞癌(Small cell carcinoma) 组织学上类似肺小细胞癌。肿瘤多发于膀胱两侧壁和膀胱底部。膀胱小细胞癌瘤体较大,平均约5cm。侵袭性高且容易转移。就诊时患者往往已有深肌层浸润。 膀胱小细胞癌的诊断包括膀胱镜检查及活检、影像学检查明确侵犯范围及是否存在远处转移。 治疗一般采用化疗联合局部治疗的综合治疗方案。推荐采用小细胞肺癌的化疗方案进行辅助化疗或新辅助化疗;局部治疗方案包括外科手术或放疗。研究认为新辅助化疗有助于提高生存率,手术治疗应选择根治性膀胱切除术,病理分期为T3、T4期考虑术后辅助化疗,一般选用顺铂联合依托泊甙的化疗方案。 膀胱非尿路上皮癌患者的治疗原则如下。 1.膀胱非尿路上皮癌的治疗原则是选择根治性膀胱切除术。 2.高分级、高分期的膀胱鳞状细胞癌术前放疗可改善预后。 3.膀胱脐尿管腺癌推荐选择扩大性膀胱部分切除术,非脐尿管腺癌建议行根治性膀胱切除术,术后可选择辅助放疗和(或)化疗。 4.推荐T3,T4期膀胱小细胞癌术后行辅助化疗。 十三、膀胱癌患者的生活质量 健康相关生活质量(HRQL)研究目前已被广泛应用于肿瘤临床治疗方法的筛选、治疗效果的评价等方面。 膀胱癌患者生活质量评估包含身体、情绪、社会活动方面的内容以及相关的并发症(如排尿问题、尿瘘、皮肤问题、性功能问题等)。生活质量测定主要是通过量表评估。目前膀胱癌研究中应用较多的生活质量测定量表包括FACT、EORTC QLQ-C30、FACT-BL和FACT-VCI。 泌尿外科医师需充分重视膀胱癌患者治疗后的健康相关生活质量。治疗前,医师应该与患者就治疗方法选择及其并发症进行充分讨论,以使患者治疗后获得最佳的生活质量。 【本订阅号为非盈利学术交流订阅号,部分资料来源于网络,如涉及版权问题请及时联系管理员处理;所有文章仅供公益交流,不代表本订阅号立场。欢迎提供素材、资料等,投稿邮箱:[email protected],一经采纳将给予稿费。】返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |