基于多肽组学的美洲大蠊肽类组分分析及促创面修复活性多肽筛选 |
您所在的位置:网站首页 › 美洲大蠊中药名字 › 基于多肽组学的美洲大蠊肽类组分分析及促创面修复活性多肽筛选 |
基于多肽组学的美洲大蠊肽类组分分析及促创面修复活性多肽筛选
|
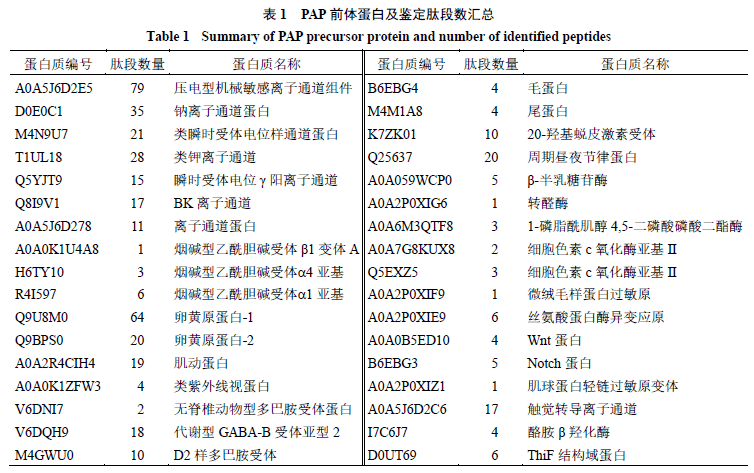
Ultimate 3000 毛细管高效液相色谱仪、Q Exactive TMHybridQuadrupole-Orbitrap TM电喷雾- 组合型离子阱Orbitrap 质谱仪,美国Thermo Fisher Scientific 公司;Concentrator plus 真空离心浓缩仪,德国Eppendorf 公司;Sartorius BP211d 分析天平,瑞士Sartorius 公司;Microfuge 22R Centrifuge 低温高速离心机,美国Beckman Coulter 公司;BPH-9042 恒温培养箱,上海一恒科学仪器有限公司;D1008 掌上离心机、MX-S 涡旋仪,美国Scilogex 公司。 Pierce 定量比色肽分析试剂盒,美国Thermo Fisher Science 公司;石油醚,分析纯,成都市科隆化学品有限公司;乙腈,质谱级,Fisher Chemical 公司;甲酸(质谱级)、碳酸氢铵(质谱级)、二硫苏糖醇(DTT ,分析纯)和碘乙酰胺(IAA ,分析纯)购自Sigma-Aldrich 公司;DMEM 培养基和MEM 培养基购自赛默飞世尔生物化学制品(北京)有限公司;胎牛血清购自浙江天杭生物科技股份有限公司;马血清购自北京索莱宝科技有限公司;胰酶购自博士德生物科技有限公司;CCK-8 试剂购自兰杰柯科技有限公司;超纯水经Millipore 纯水系统纯化;美洲大蠊干燥虫体来自四川好医生攀西药业有限责任公司,经成都中医药大学裴瑾教授鉴定为蜚蠊科大蠊属昆虫美洲大蠊P. americana (L.) 的干燥虫体。 2 方法与结果 2.1样品前处理 2.1.1分子筛分离取美洲大蠊干燥虫体用打粉机粉碎过40 目筛,加入石油醚加热回流去除油脂,60 ℃烘干。取1 mg 粉末溶于1 mL ddH 2O 配制成1 mg/mL 样品溶液。取300 mL 美洲大蠊虫体溶液至截留相对分子质量为3000 的超滤管中,于4 ℃、12 000 r/min 转速下离心10 min ,将小于相对分子质量3000 的多肽样品收集于1.5 mL EP 管中,即为美洲大蠊多肽样品(PAP )。 2.1.2 肽段定量采用Pierce 定量比色肽分析试剂盒对样品多肽质量浓度进行计算。具体操作如下,配制质量浓度为1000 、500 、250 、125 、62.5 、31.3 、15.6 µg/mL 的标准品溶液。分别取20 µL 标准品及样品于微孔板中,每孔中加入180 µL 工作试剂。在微孔板振荡器上混合30 s 后,于37 ℃孵育15 min 。冷却至室温后,在多功能酶标仪上测量480 nm 处的吸光度(A )。制备标准曲线并计算样品质量浓度。 2.1.3 还原烷基化取20 µg PAP 肽段样品并加入ddH 2O 溶液至100 μL ,加入DTT 溶液使其终浓度为10 mmol/L ,于56 ℃水浴中还原1 h 。加入IAA 溶液使其终浓度为50 mmol/L ,避光反应40 min ,使用自填脱盐柱脱盐,于45 ℃真空离心浓缩仪中挥干溶剂。 2.2LC-MS/MS检测 2.2.1 毛细管液相色谱条件Ultimate 3000 毛细管高效液相色谱仪,预柱为Acclaim PepMap RPLC C 18 (300 μm ×5 mm ,5 μm ),分析柱为AcclaimPepMap RPLC C 18 (150 μm ×150 mm ,1.9 μm );进样体积为5 μL ,流动相A 为0.1% 甲酸和2% 乙腈水溶液,流动相B 为0.1% 甲酸和80% 乙腈水溶液,线性梯度洗脱:0 ~2 min,4%~8% B;2 ~45 min,8%~28% B;45 ~55 min,28%~40% B;55 ~56 min,40%~95% B;56 ~66 min ,95% B ;体积流量600 nL /min ;分析时间66 min 。 2.2.2质谱条件选用Q Exactive TMHybrid Quadrupole-Orbitrap TM质谱仪进行肽段分析。一级质谱参数:分辨率m / z 70 000 ;自动增益控制(AGC )目标3 ×10 6 ;最大驻留时间(IT )40 ms ;扫描范围:m / z 100 ~1500 。二级质谱参数:分辨率m / z 17 500 ;AGC 目标1 ×10 5 ;最大IT 60 ms ;Top N :20 ;碰撞能量(NCE/stepped NCE )27% 。 使用Byonic 软件检索,选择美洲大蠊蛋白数据库,检索参数设置为半胱氨酸碘乙酰化固定修饰,甲硫氨酸氧化可变修饰,N - 端乙酰化;允许3 个位点误切;非酶切;其他为默认参数,检索所得分值有显著意义(P <0.01 ),被认定为有效鉴定结果。 2.3美洲大蠊多肽分析及其前体蛋白鉴定 美洲大蠊经过超滤得到相对分子质量小于3000 的多肽,多肽质量浓度为(3.17 ±0.03 )mg/ mL 。通过LC-MS 进行分析,总离子流色谱图(total ion current ,TIC )如图1 所示,共得到43 743 张二级质谱图,其中鉴定出449 条多肽的氨基酸序列,通过美洲大蠊蛋白数据库检索出这449 条多肽来自34 个前体蛋白。前体蛋白及多肽数量分布如表1 所示,离子通道相关蛋白(A0A5J6D2E5 、D0E0C1 、M4N9U7、T1UL18、Q5YJT9、Q8I9V1、A0A5J6D278、A0A0K1U4A8 、H6TY10 、R4I597 )是前体蛋白中的主要一类蛋白,参与美洲大蠊Na +、K +、Ca 2+等离子的跨膜转运过程,离子通道蛋白的总肽段数占比48.11% 。其次为卵黄原蛋白(Q9U8M0 、Q9BPS0 ),为卵黄蛋白的前体及美洲大蠊胚胎和幼体早期发育主要的营养来源。
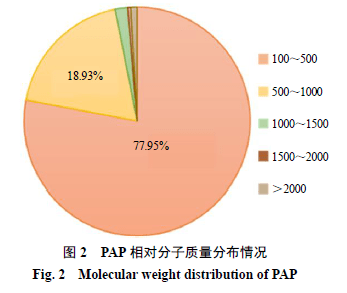
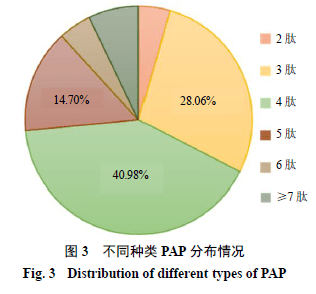
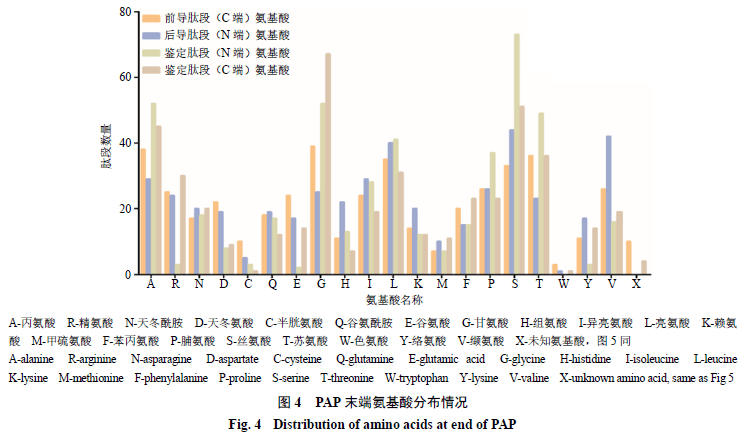
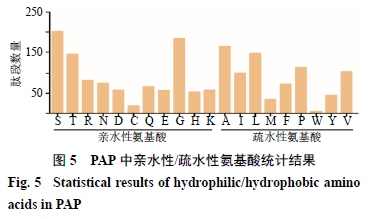
PA 鉴定肽段相对分子质量结果如图2 所示。结果显示肽段相对分子质量的分布集中在100 ~500 阶段,相对分子质量在1000 以下的肽段占比达到96.88% 。在鉴定的多肽中以3 肽、4 肽和5 肽的数量较多,分别占28.06% 、40.98% 、14.70% (图3 )。另外对鉴定肽段的末端氨基酸及连接的前导肽段/ 后续肽段进行分析(图4 ),鉴定肽段的C 端分布较多的氨基酸残基依次为甘氨酸(G )、丝氨酸(S )、丙氨酸(A )、苏氨酸(T );N 端分布最多的氨基酸为丝氨酸(S ),其次为丙氨酸(A )、甘氨酸(G )、苏氨酸(T );鉴定肽段的前导肽段和后续肽段的氨基酸残基分布也很广泛,说明美洲大蠊体内分布多种类型的剪切酶作用在不同的位点。进一步对氨基酸的亲水性进行分析(图5 ),通过统计亲水性氨基酸共出现996 次,包括丝氨酸(S )、苏氨酸(T )、精氨酸(R )、天冬酰胺(N )、天冬氨酸(D )、半胱氨酸(C )、谷氨酰胺(Q )、谷氨酸(E )、甘氨酸(G )、组氨酸(H )、赖氨酸(K );疏水性氨基酸共出现784 次,包括丙氨酸(A )、异亮氨酸(I )、亮氨酸(L )、甲硫氨酸(M )、苯丙氨酸(F )、脯氨酸(P )、色氨酸(W )、络氨酸(Y )、缬氨酸(V ),说明美洲大蠊中相对分子质量小于3000 的多肽更偏向于亲水性。
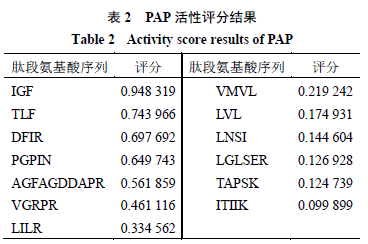
2.4多肽筛选及活性预测 通过美洲大蠊蛋白数据库共检索出449 条肽段,其中评分≥100 的肽段共有29 条,相对丰度>0 的多肽共有220 条,同时满足相对丰度大于0 及评分大于100 的肽段共有13 条。使用在线工具PeptideRanker(http://distilldeep.ucd.ie/PeptideRanker/)对这13 条肽段的生物活性进行预测,活性评分高于0.5 则被标记为具有生物活性,13 条多肽的氨基酸序列及评分结果如表2 所示,评分大于0.5 的肽段共有5 条,氨基酸序列分别为IGF 、TLF 、DFIR 、PGPIN 、AGFAGDDAPR 。将这5 条肽段的氨基酸序列输入BIOPEP 数据库(https://biochemia.uwm. edu.pl/biopep-uwm/ )搜索是否有相匹配的已知功能肽段,结果并未搜索到相匹配的肽段。
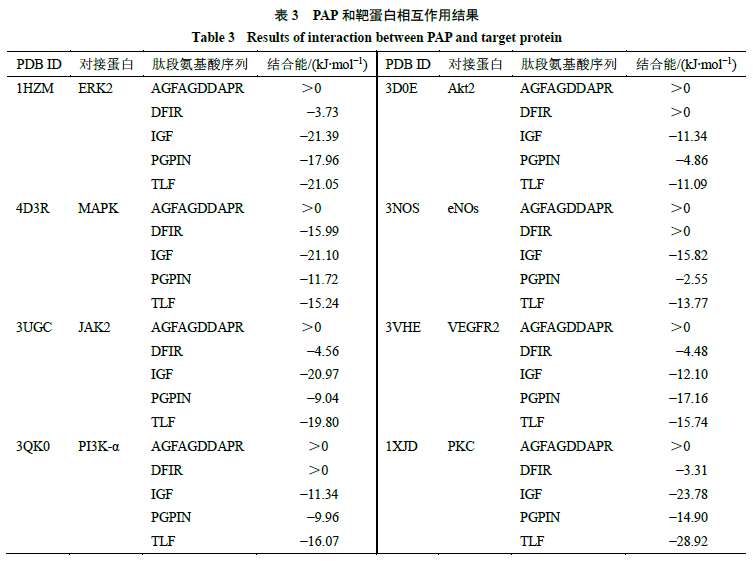
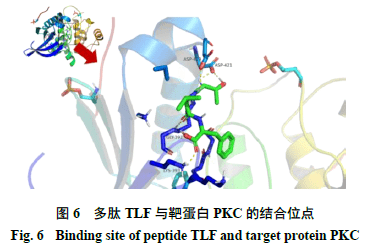
2.5分子对接 美洲大蠊具有养阴生肌的功效,在烧烫伤、慢性创面、溃疡等多种创面上应用发挥功效,为了预测多肽是否为美洲大蠊用于创面修复的活性成分,课题组选择了几个与炎症相关的通路蛋白,分别为胞外信号调节激酶2 (extracellular regulated proteinkinases 2 ,ERK2 )、丝裂原活化蛋白激酶(mitogen- activated protein kinase ,MAPK )、酪氨酸激酶(Janus kinase 2 ,JAK2 )及与血管生成相关的通路蛋白,分别为胞内磷脂酰肌醇激酶(phosphoinositide3-kinase α ,PI3K-α )、蛋白激酶B (protein kinase B ,Akt )、一氧化氮合成酶(endothelial nitric oxidesynthase ,eNOs )、血管内皮生长因子受体2 (vascular endothelial growth factorreceptor 2 ,VEGFR2 )、蛋白激酶C (protein kinase C ,PKC )作为靶蛋白[15-18]。使用PDB 蛋白数据库(https://www.rcsb.org/ )搜索靶蛋白,下载PDB 格式的2D 结构文件。使用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/ )搜索氨基酸,下载sdf 格式的2D 结构文件[19]。通过ChemDraw19.0 软件将氨基酸连接成多肽序列并使用Chem3D 19.0 软件获得多肽的3D 结构文件,选择最低能量构象并保存为mol 格式文件。采用AutoDock 软件包(Molecular Graphics Laboratory of The Scripps Research Institute ,Version 1.5.6 Sep-17-14 )对靶蛋白及多肽进行前处理后使用拉马克遗传算法(Lamarckiangenetic algorith )进行分子对接,遗传算法中所有参数均为默认值。 分子对接结果如表3 所示,结合能(binding energy )小于0 kJ/mol 为有效对接,该值越小说明多肽与靶蛋白的相互作用越稳定。AGFAGDDAPR 与所有靶标蛋白结合后结合能几乎都大于0 kJ/mol ,说明它与靶标蛋白不能有效对接。DFIR 与ERK2 、MAPK 、JAK2 、VEGFR2 、PKC 结合能小于0 kJ/mol 。其他3 种多肽和8 个靶蛋白都能有效结合,PGPIN 与VEGFR2 的结合能小于−17 kJ/mol ,IGF 与ERK2 、MAPK 、JAK2 、PKC 的结合能小于−20kJ/mol ,TLF 与ERK2 、PKC 的结合能小于−20kJ/mol 。TLF 与PKC 蛋白的结合能最小,为−28.92 kJ/mol ,通过Pymol 软件构建TLF 与PKC 蛋白的结合能最小的3D 结合模型,如图6 所示,TLF 可以与PKC 蛋白的4 个位点(LYS393 、GLY392 、ASP419 、ASP421 )的氨基酸残基形成氢键,产生较强结合力。
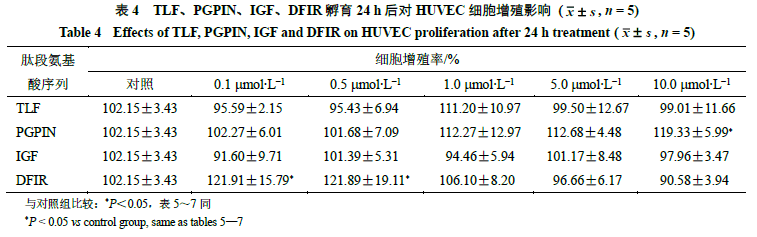
2.6促创面修复活性初步考察 2.6.1细胞培养人脐静脉内皮HUVEC 细胞用含有10% 胎牛血清(FBS )、1% 青霉素- 链霉素(PS )的DMEM 培养基培养。小鼠成纤维L929 细胞用含有10% 马血清、1% PS 的MEM 培养基中培养。细胞在37 ℃的含有5% CO 2培养箱中孵育,当传至3 ~8 代时用于接下来的试验。 2.6.2肽段合成将筛选得到的肽段TLF 、IGF 、PGPIN 、DFIR ,由上海波泰生物科技有限公司进行合成,得到4 个肽段样品(质量分数>95% )。 2.6.3细胞增殖实验HUVEC 、L929 细胞分别以5 ×10 3个/ 孔的密度种在96 孔板上,在培养箱中过夜使其贴壁。吸除原有培养基,每个孔分别加入100 mL 新鲜的含有不同浓度(0.1 、0.5 、1.0 、5.0 、10.0 mmol/L )TLF 、IGF 、PGPIN 、DFIR 肽段的培养基。在培养箱中孵育24 h 后吸除含药培养基,每孔加入100 mL 含有10 mL CCK8 试剂的培养基,避光处理0.5h ,用酶标仪测定其在450nm 波长下的吸光度(A )值。同时设对照组(添加培养基)。计算不同浓度下的细胞增殖率。 细胞增殖率=( A 0-A n)/ A 0 A0表示对照组的吸光度值,A n表示不同肽段n浓度的吸光度值 结果如表4 、5 所示。在0.1 ~10.0 mmol/L 浓度下,TLF 和IGF 2 个肽段对HUVEC 细胞增殖没有显著性的促进作用,PGPIN 的浓度与HUVEC 细胞增殖呈现正相关,在10.0 mmol/L 浓度下可显著促进HUVEC 细胞增殖(P <0.05 )。DFIR 浓度在0.1 、0.5 mmol/L时,可显著促进HUVEC细胞增殖(P<0.05 )。在0.1 ~10.0 mmol/L 浓度下,IGF 和DFIR 2 个肽段对L929 增殖没有显著性影响,但TLF 在0.1 、1.0 、5.0 mmol/L 浓度下能显著促进L929 细胞的增殖(P<0.05),PGPIN(1.0mmol/L)能显著促进L929 细胞的增殖(P <0.05 )。
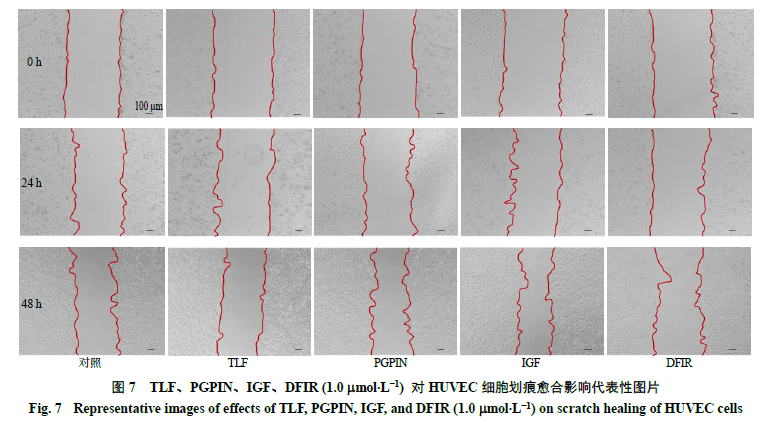
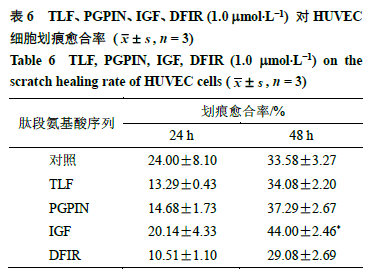
2.6.4细胞划痕试验细胞以2 ×10 5个/ 孔的密度接种在12 孔板上,培养箱中过夜使其贴壁。吸除原有培养基,用200 mL 枪头在孔板底部划一条直线,PBS 清洗2 ~3 次除去划掉的死细胞,分别加入含有TLF 、IGF 、PGPIN 、DFIR 肽段(1.0 mmol/L )的低血清(1% )培养基,此时间点作为0 h 。在0 、24 、48 h 用显微镜在40 倍镜下观察并拍照,通过Image J 1.46r 软件测定划痕面积,计算不同时间点的划痕愈合率。 划痕愈合率=( W 0-W t)/ W 0 W0表示0 h的划痕面积,W t表示th的划痕面积 采用划痕试验考察所筛选肽段对HUVEC 细胞迁移的影响,代表图片如图7 所示,划痕愈合率结果如表6 所示。与对照组相比,4 个肽段(1 mmol/L )处理细胞24 h 后,对HUVEC 细胞的迁移影响都不大;处理细胞48 h 后,IGF 能显著促进HUVEC 细胞的迁移(P <0.05 )。
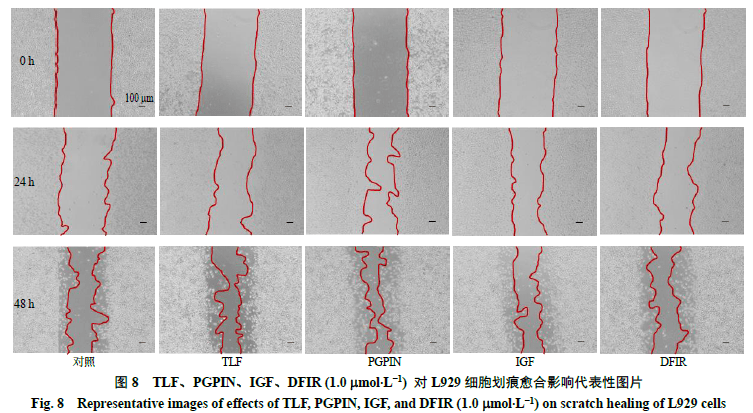
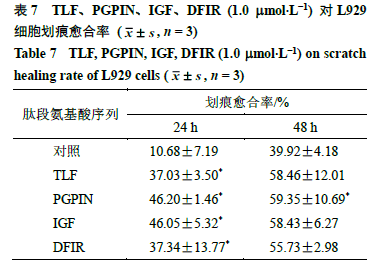
采用划痕试验验证筛选肽段对L929 细胞迁移的影响,代表图片如图8 所示,划痕愈合率结果如 表7所示。与对照组相比,4个肽段(1 mmol/L)处理细胞24 h 后,都显著促进了L929 细胞的迁移(P <0.05 );48 h 时,PGPIN 显著促进L929 细胞迁移作用(P <0.05 )。由此提示,预测筛选所得这几条多肽具有一定的促创面修复相关作用。
3讨论 传统中医认为动物药为“血肉有情之品”和“行走通窜之物”,是中药3 大来源之一。据《中国动物药资源》统计,我国药用动物资源约2215 种,约占全部中药资源的18% 。动物药在我国应用历史悠久,临床功效独特且疗效显著,在治疗某些疾病方面具有植物药无法替代的优势。动物药主要是以蛋白、多肽成分作为其活性物质基础,然而目前所采用的质控指标大多为氨基酸、核苷等小分子次生代谢产物,缺乏物种专属性,且尚不清楚与药效的关联性。目前美洲大蠊常采用的“小分子指标成分”无法代表和控制“大分子为物质基础的动物药”。 如何快速高效的分离鉴定蛋白/ 多肽组成和结构,是目前动物药物质基础探析的关键。多肽的分离方法包括超临界流体萃取法、膜分离法、色谱法、电泳法及分子印迹技术等[20-21]。超滤技术是膜分离法的一种,使用超滤膜操作简单,选择性高、能耗低,对性质相似组分有很好的分离效果,适合动物多肽的初级分离。色谱法能够高效分离纯化多肽,是目前动物多肽分离纯化的主要技术手段。多肽分离技术的发展带动了多肽序列结构研究,多肽结构的鉴定有助于了解活性多肽作用机制,有助于促进活性多肽的开发利用。多肽鉴定方法包括N 末端序列测定法、质谱法、核磁共振法。质谱法通过测定离子质荷比完成分析,通过质谱图确定被测物质量,具有快速、高灵敏度的优势[22]。近年来,基于高分辨质谱技术蛋白质/ 多肽组学的出现,为发现和鉴定生物体蛋白/ 多肽提供了更加高效的方法,达到对蛋白质/ 多肽的快速鉴定和高通量筛选,还能用于翻译后修饰(糖基化、甲基化)的分析。将蛋白/ 多肽组学应用于动物药物质基础研究,是从药用动物的整体蛋白分子水平研究其蛋白组成表达模式和功能模式,探究药用动物生长发育的规律和药效作用机制的有效方式。 创面修复是一个复杂的生理过程,包括止血期、炎症期、增殖期及重塑期。在炎症期,伤口中过多的巨噬细胞和中性粒细胞会导致活性氧(reactive oxygen species ,ROS )过度产生,ROS 的过度产生会造成细胞外基质(extracellular matrix ,ECM )受损及成纤维细胞的衰老。成纤维细胞是增殖期最活跃的细胞之一,通过迁移形成肉芽组织,填充伤口中缺损组织,提供新的ECM 并产生大量胶原蛋白以增强ECM 的拉伸强度。内皮细胞负责血管新生,是创面修复的关键环节之一,通过增殖和迁移形成新的血管和毛细血管对再生组织的营养输送及重建血流供应至关重要[23-24]。有研究发现美洲大蠊乙醇提取物可以显著提升HUVEC 细胞的迁移能力及形成更丰富的毛细血管样结构并能显著提高人成纤维细胞活力呈浓度依赖性[25]。因此,本实验采用L929 和HUVEC 作为细胞模型,验证筛选的肽段的创面修复活性。 本实验使用超滤膜初步分离出美洲大蠊中相对分子质量小于3000 的多肽组分,采用毛细管高效液相色谱法对多肽进一步纯化,使用Q-Exactive UHMR 混合四极轨道测量质谱仪鉴定出来自于美洲大蠊离子通道蛋白、卵黄蛋白原等前体蛋白的449 个多肽序列。通过分子对接技术,预测其中的4 条多肽(TLF 、PGPIN 、IGF 、DFIR )能与ERK/MAPK 、JAK/STAT 、PI3K/AKT/eNOS 等相关信号通路的ERK2 、MAPK 、JAK2 、eNOS 等8 个靶点蛋白有效对接。通过对这4 条多肽促进HUVEC 和L929 2 种细胞模型的增殖和迁移作用的考察,提示这几条多肽可能具有潜在促创面修复作用。本实验为美洲大蠊及其制剂中促修复多肽类活性成分分析提供了方法和思路。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 来 源:廖 倩,庞 兰,石金凤,李佳鑫,钟雪梅,傅超美,耿福能,章津铭.基于多肽组学的美洲大蠊肽类组分分析及促创面修复活性多肽筛选 [J]. 中草药, 2022, 53(7): 2085-2094 .返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |