Nat. Rev. Drug. Discov. |
您所在的位置:网站首页 › 索拉非尼会影响食欲吗 › Nat. Rev. Drug. Discov. |
Nat. Rev. Drug. Discov.
|
编译 | 曾全晨 审稿 | 王建民 今天为大家介绍的是来自Tracey Pirali的一篇综述论文。氘代替氢原子的替代反应将在分子中增加一个中子。尽管这是一个微小的变化,但这种结构修饰被称为氘化,可能会改善药物的药代动力学和/或毒性特性,从而与非氘化的对应物相比,在疗效和安全性方面可能带来改进。最初主要通过“氘开关”方法开发已上市药物的氘代物,如氘替贝嗪,该药物于2017年成为首个获得FDA批准的氘代药物。在过去几年中,研究重点已转向将氘化应用于新型药物发现,2022年FDA批准了创新的全新氘化药物德克拉伐替尼。在综述中,作者突出了药物发现和开发中氘化领域的关键里程碑,强调了最近和具有指导意义的药物化学计划,并讨论了药物开发者面临的机遇和障碍,以及尚待解决的问题。  药物化学家在药物发现和开发中使用多种方法来优化小分子化合物的疗效和安全性。其中之一是生物同功异构作用,通过用另一个结构取代一个亚结构的方式,改善原化合物的一个或多个性质,同时保留其生物活性。例如,用氘代替氢——可以说是最小的化学变化之一——可以对各种药物特性产生重大影响。最初认为氘化仅仅增加了化合物的代谢稳定性,但后来证明,这种修饰的效果远不止于简单的药代动力学改进,对药物的疗效和安全性具有重大影响。 氘和药物氘化的原因 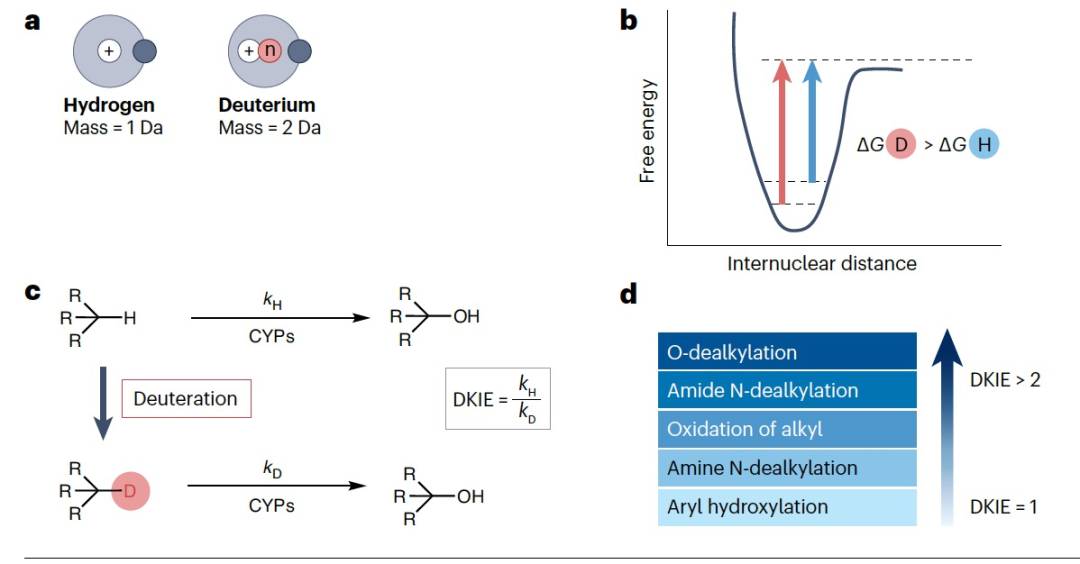 图 1 氢是宇宙中最丰富的元素,自然界存在三种同位素:氢(以下简称为H,具有一个质子和一个电子,丰度为99.9844%),氘(以下简称为D,额外携带一个中子,丰度为0.0156%)和氚(以下简称为T,额外携带两个中子,以微量存在)(图1)。由于D和T可以通过质谱和放射性测量分别进行容易检测,它们被广泛应用于生命科学中,用于识别、监测和理解生物和化学过程。虽然T是一种放射性同位素,但具有较长的半衰期(t½),D是稳定的同位素,可以在没有特殊要求的情况下处理。因此,随着超灵敏质谱技术的出现,D在许多生物医学领域中正在补充或甚至取代T的应用。多年来对人体中氘安全性的可靠数据的出现,以及氘作为代谢研究中的示踪剂的安全性,使其在药物发现和开发中的应用越来越受欢迎。通过给予标记氘的药物,可以追踪分子在体内和排泄物中的命运,从而在代谢研究中用作示踪剂。此外,氘还可以作为生物等同物被纳入药理活性化合物中。 氘纳入药物中可能带来的好处 据估计,超过一半的上市药物在细胞色素P450(CYP)家族酶中发生代谢。不幸的是,氧化代谢可能伴随着一些缺点:不稳定、活性高、非选择性和有毒的中间体和/或代谢物的形成;由于基因多态性引起的患者间变异性的发生;以及对同工酶的饱和、诱导或抑制,导致潜在的有害药物相互作用。因此,基于氘动力同位素效应,将氢替换为氘是药物开发者追求的策略,以减轻CYP介导的代谢及其固有的缺点(图1c)。代谢途径的变化并非总是可预测的,因此需要通过体外和/或体内代谢研究来进行测定。例如,咖啡因在每个甲基位点的氘化可以减弱在氘化位点的氧化反应,同时在非氘化易氧化位点引起显著的代谢切换。只有对所有三个甲基位点进行氘化(d9-咖啡因)(见表1)才能有效减少N-去烷基化反应并改善药代动力学特性。 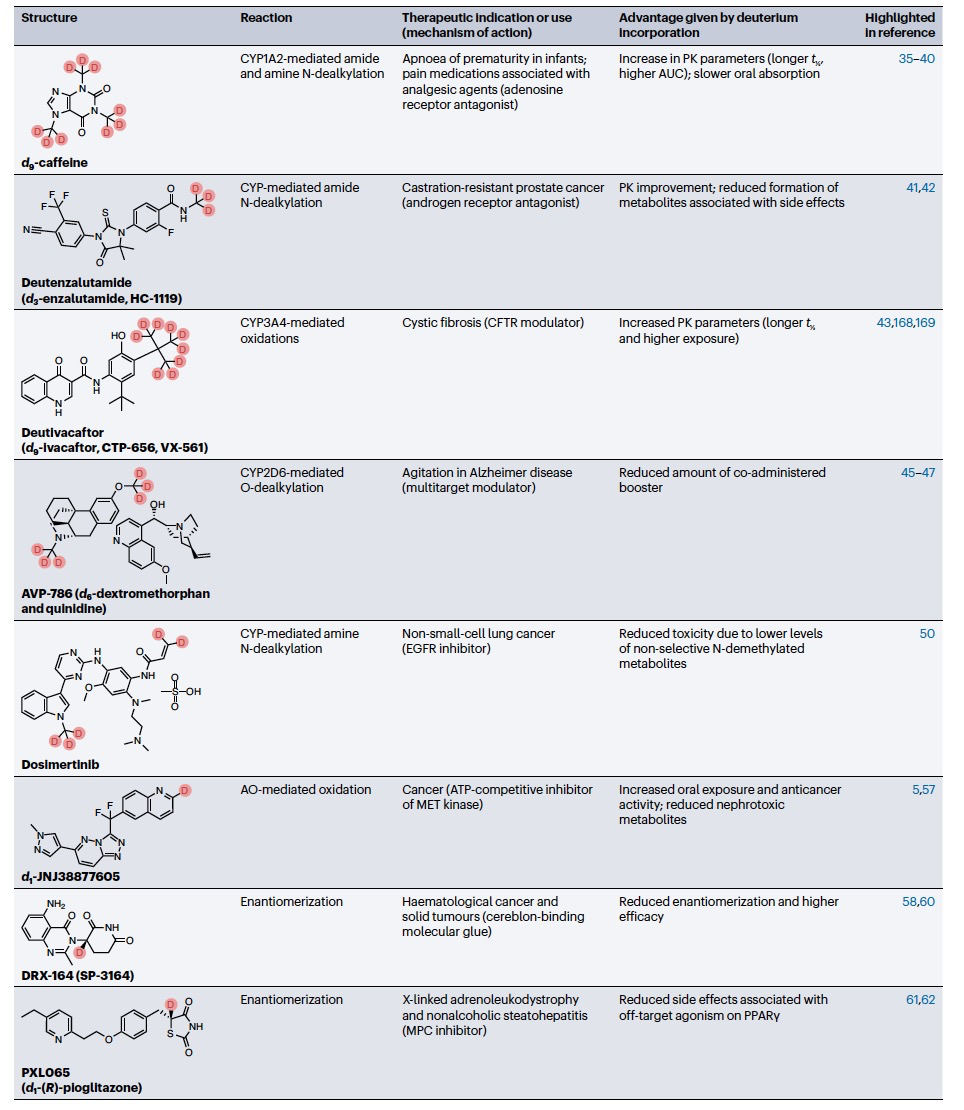 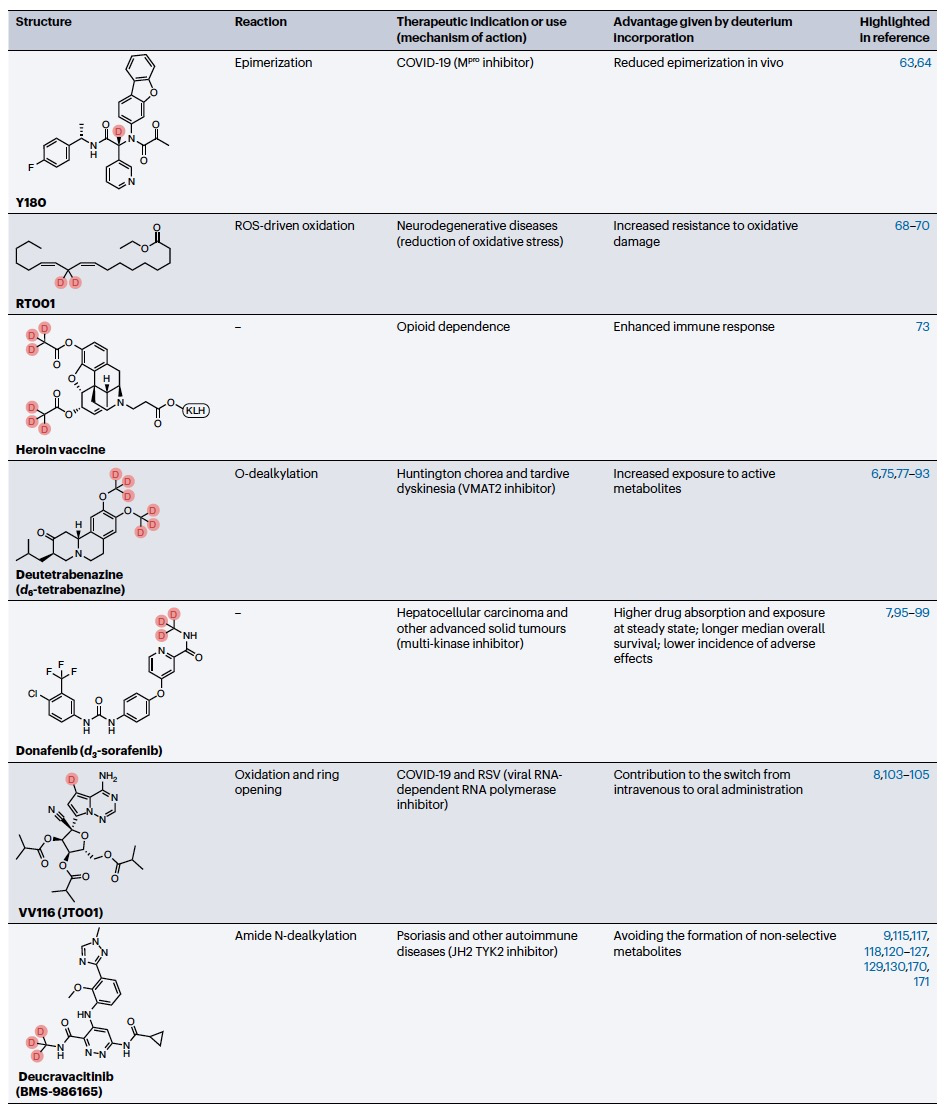 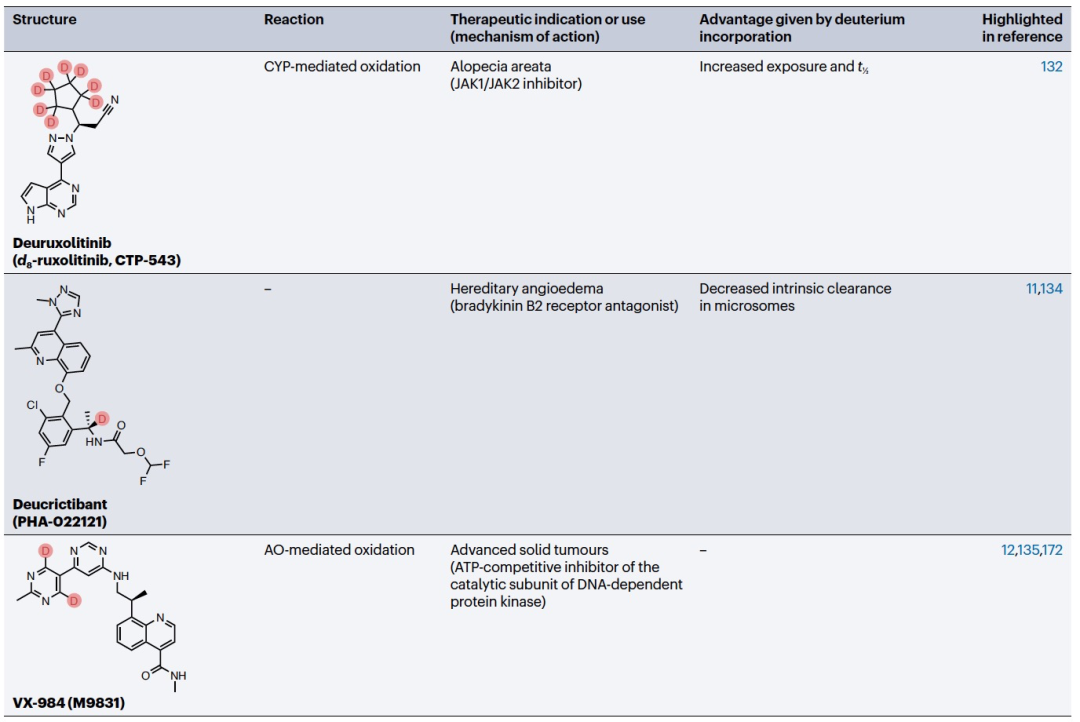 表 1 对于恩扎鲁胺(enzalutamide),一种用于治疗去势抵抗性前列腺癌的雄激素受体抑制剂,没有发生代谢切换,氘化修饰在酰胺N-甲基基团(deutenzalutamide,d3-enzalutamide)足以产生优越的类似物,至少从药代动力学的角度来看是如此。恩扎鲁胺经历两种不同的反应:水解产生非活性的羧酸代谢物M1,和由CYP2C8和CYP3A4/5介导的N-去甲基化反应产生活性代谢物M2,后者被认为增加了癫痫的风险。值得注意的是,M1主要是通过水解M2而不是恩扎鲁胺本身形成的,这导致得出结论:氘化减少了M1和M2的产生,没有出现有利于M1的代谢切换。这些在临床前研究中改善的药代动力学参数转化为异种移植模型中更强的抗肿瘤活性。 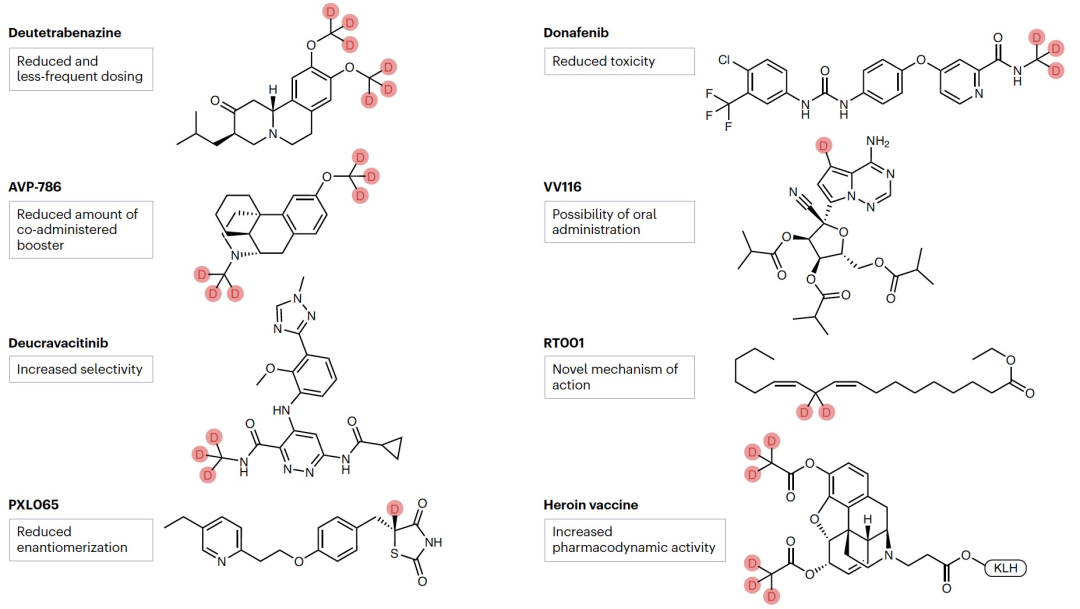 图 2 通过氘代可以改善药物的药代动力学特性,还可能减少达到有效暴露所需的共同给药增强剂(即,用于增加共同给药药物生物利用度的物质)的数量。右美沙芬是许多非处方止咳药中的有效成分,奎尼丁是一种抗疟疾和抗心律失常药物。在2010年,这两种化合物(AVP-923:右美沙芬20毫克和奎尼丁10毫克)的固定剂量联合制剂成为了首个获得FDA批准治疗假性脑神经病的药物。设计这种联合制剂的原因是,右美沙芬经历了广泛的第一过程O-去甲基化,由CYP2D6介导,而奎尼丁作为增强剂,通过可逆地抑制CYP2D6,从而增加了右美沙芬的半衰期和脑部渗透性。相反,奎尼丁的使用可能增加QT间期延长、尖端扭转和药物相互作用的风险。因此,在右美沙芬的甲氧基基团和三级胺上加入了D,形成了d6-右美沙芬。在一项I期试验中,这种氘代化合物与奎尼丁的固定剂量联合制剂,被称为AVP-786(图2和表1、表2),能够使用较低剂量的奎尼丁(4.5毫克)复制AVP-923的稳态血浆水平。两年后,FDA授予AVP-786在阿尔茨海默病患者的焦虑症治疗中的快速通道指定,目前还没有批准的治疗方案可用。从监管的角度来看,FDA允许使用AVP-923的可用数据,这些数据基于之前的II期疗效研究,来支持AVP-786的新药调查申请(IND)和监管申报。因此,从2015年开始,AVP-786仅通过III期试验进行评估,而无需进行II期研究。 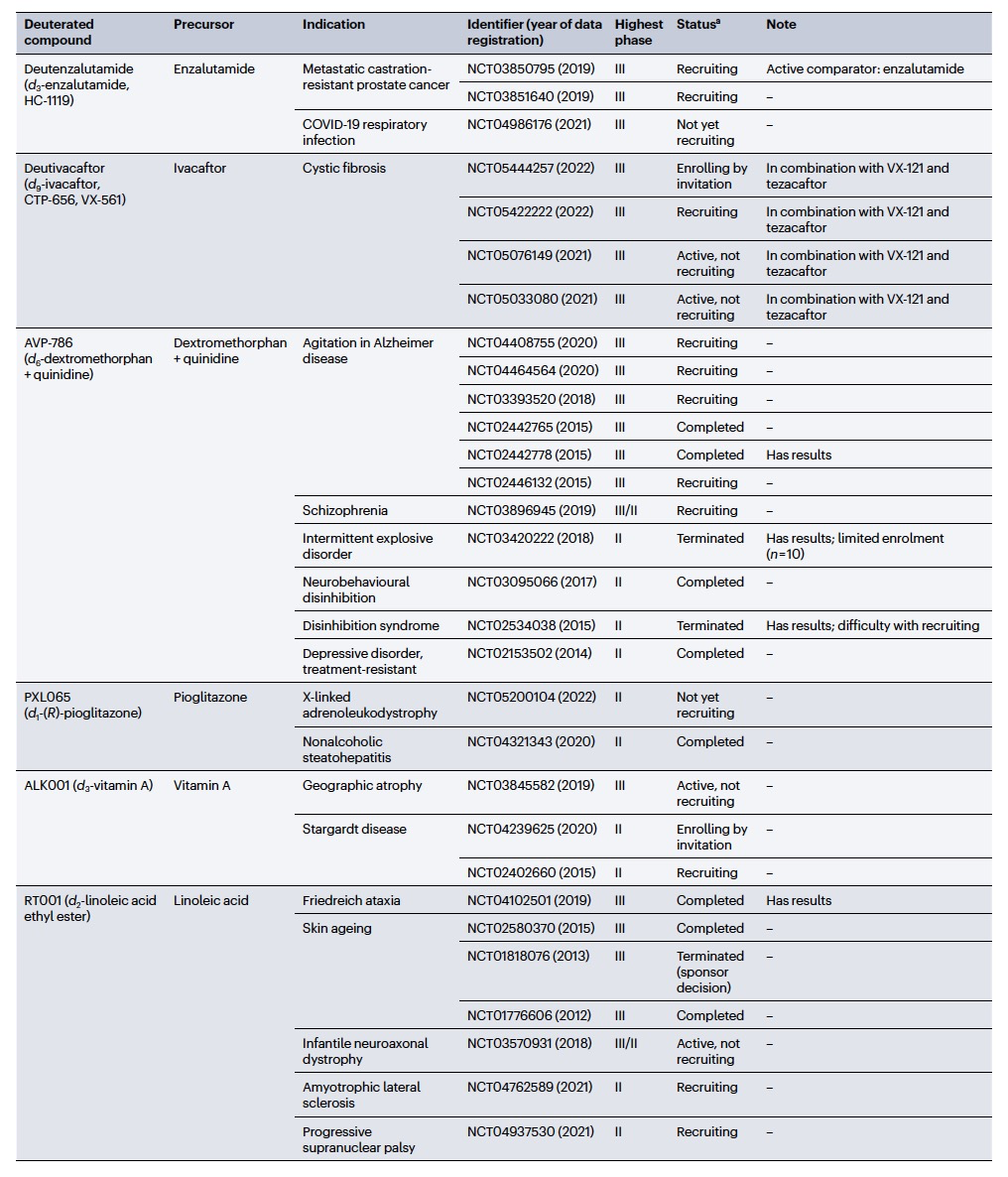 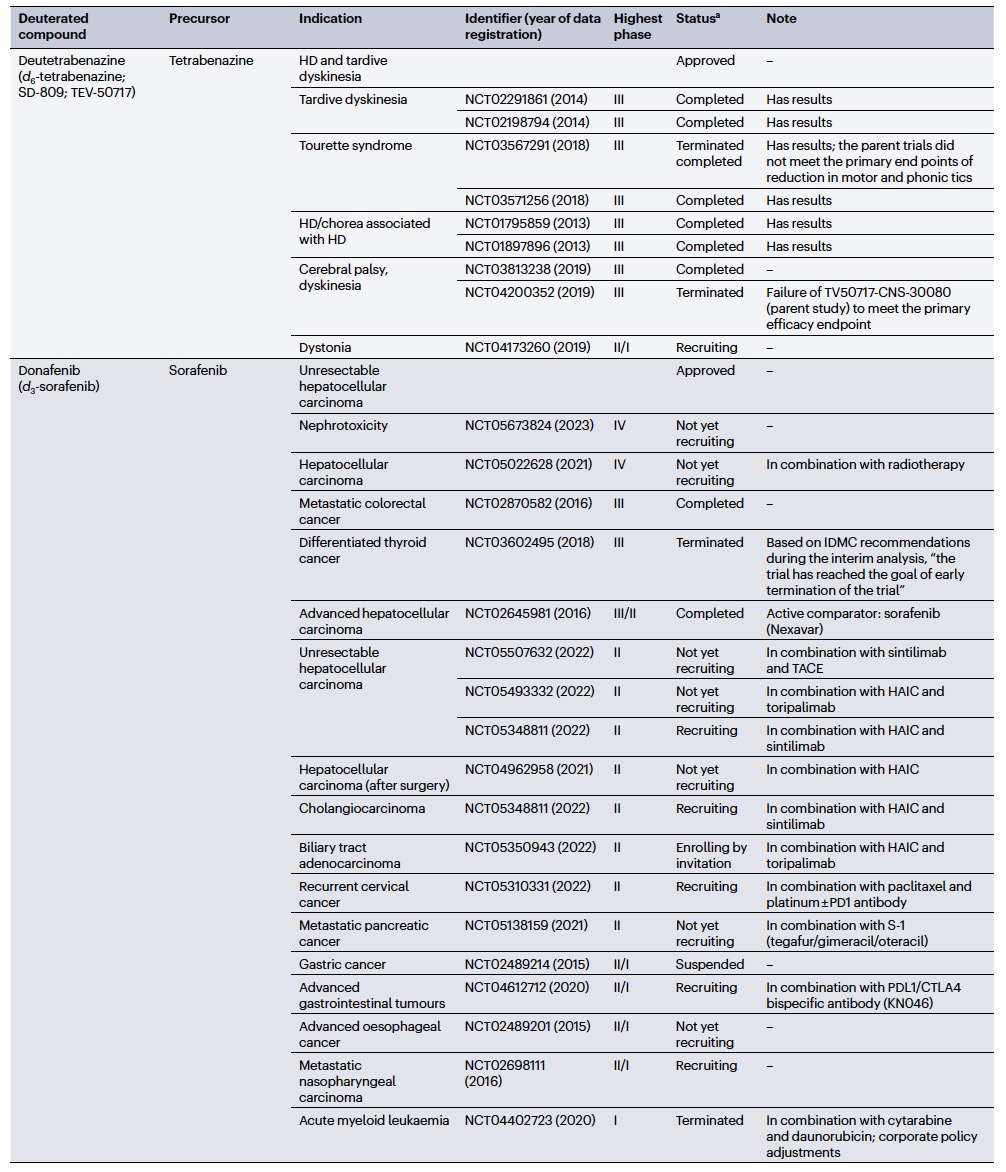 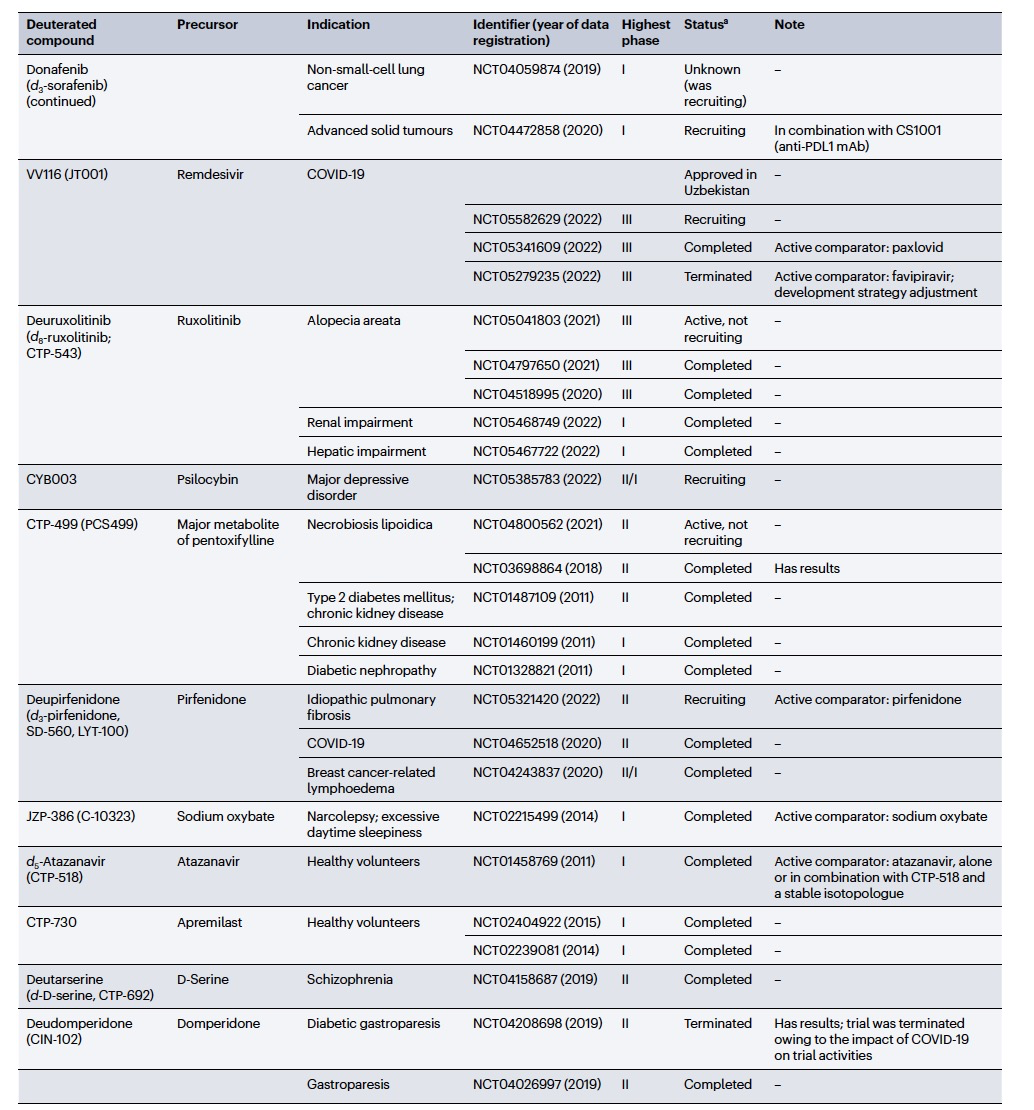 表 2 氘不仅能够影响代谢过程,还会影响涉及C-H(D)断裂步骤的纯化学事件,如对映异构化或外消旋化反应。在手性转换的背景下,这种现象非常重要。通过氘启用的手性转换(DECS)方法在立体中心处引入D,可以降低原子抽取速率并稳定互相转化的立体异构体。多年来,DECS已被用作稳定、分离、表征并给予首选立体异构体的手段,从而提高了构型不稳定药物的治疗效果。DECS首次在丙肝蛋白酶抑制剂替拉匹韦上得到验证,随后应用于免疫调节药物沙利度胺、来那度胺和沃度胺。DRX-164(表1)是沃度胺的D稳定的(S)对映体,证明在脂多糖刺激下的人体外周血单核细胞中,与(R)对映体相比,在抑制肿瘤坏死因子(TNF)产生方面具有20倍的效力。基于在骨髓瘤异种移植模型中相比沃度胺的更高疗效,DRX-164最近已被选为治疗血液系统肿瘤和实体瘤的临床候选药物。 DECS还可以用于对两个对映异构体进行全面的表征和解析其活性,就像对抗糖尿病药物吡格列酮的情况一样。吡格列酮作为混合物销售,用于非酒精性脂肪性肝炎(NASH)的非标签治疗。尽管其两个对映体都能够等效抑制线粒体丙酮酸携带体,这是其治疗效果的机制,但只有d1-(S)-吡格列酮对过氧化物酶体增殖物激活受体γ(PPARγ)显示出激动作用,这是与不良事件(如体重增加、水肿和骨质流失)相关的非靶效应。相反,d1-(R)-吡格列酮(PXL065;图2和表1、表2)在PPARγ上没有活性,因此在小鼠中不会导致体重增加。在随后的Ia期研究中,与更高剂量的混合吡格列酮相比,PXL065治疗导致(R)-吡格列酮的选择性暴露增加。由于耐受性良好,PXL065进入了NASH的II期试验。由于缺乏PPARγ的激动作用和副作用,PXL065还在X连锁肾上腺白质脱髓鞘病(一种罕见的神经代谢病)的临床前模型中进行了评估。计划于2023年开始评估其在X连锁肾上腺白质脱髓鞘病患者中的临床疗效。 到目前为止已获批的氘开关药物 在过去的二十年中,许多公司已经投资于氘化开关,吸引了重大商业兴趣,据估计,总交易额已超过70亿美元。这些努力导致了氘盐酸特特拉本(deutetrabenazine)的FDA批准,以及两个新的药物候选物donafenib和VV116的开发,它们分别在中国和乌兹别克斯坦获得了批准。在氘盐酸特特拉本获批后的热潮中,目前至少还有15个候选物正在进行临床试验评估(表2),其中六个处于III期试验阶段,有望在不久的将来获得批准。氘代取代在减少CYP同工酶介导的O-脱烷基化反应方面特别有效。利用这一特性,合成了氘代盐酸特特拉本(d6-四氢苯并噻吩;图2和表1、表2),这是第一个获得上市批准的氘化开关衍生药物。它的非氘代对应物四氢苯并噻吩是一种囊泡单胺转运体2(VMAT2)的抑制剂,于1960年代首次发现作为抗精神病药物。然而,后来它被证明对治疗不自主运动障碍更有价值,这导致了它在2008年获得FDA批准用于亨廷顿病相关的舞蹈症的治疗。不幸的是,很快就发现四氢苯并噻吩的使用会降低血清素水平,这可能会加重某些精神病患者的抑郁和自杀倾向。因此,FDA发布了黑盒警告,限制其在主动自杀或未经治疗的抑郁症患者中的使用。该药物的另一个缺点是它经过羰基还原酶的还原代谢成为活性代谢物,然后通过CYP2D6介导的O-脱烷基化反应代谢为无活性的O-去甲基代谢物,这往往导致亚治疗药物水平,需要增加用药频率。为了改善用药方案和治疗依从性,Auspex Pharmaceuticals开发了四氢苯并噻吩的氘代类似物d6-四氢苯并噻吩。通过在两个易受攻击位点引入氘,使活性代谢物对CYP2D6介导的O-脱烷基化反应更具耐受性。尽管氘代取代可以显著改善四氢苯并噻吩的给药方案,但目前尚不清楚其改善的药代动力学特性是否比非氘代化合物具有更好的疗效和/或安全性。多年来,一系列安慰剂对照研究评估了氘盐酸特特拉本在亨廷顿病患者和迟发性运动障碍患者中的疗效和安全性,随后的回顾性分析表明改进的给药方案在减轻舞蹈症和缓解一些不良副作用方面更为有效,主要是神经精神方面的不良反应。 索拉非尼(Sorafenib)是一种多激酶抑制剂,已获批用于治疗无法切除或转移性肝癌和晚期肾癌。尽管其名称可能会误导,但多那非(d3-索拉非尼;图2和表1、表2)是通过氘化开关得到的结果,其中三个氘原子被并入到索拉非尼的吡啶环上的次级酰胺中。有趣的是,文献中并没有找到对索拉非尼氘代化的明确理由,可能是因为索拉非尼的主要循环代谢物是同样具有强效的吡啶N-氧化物。在鼓舞人心的I期试验之后,多那非在一项II/III期试验中与索拉非尼进行了比较。尽管两次日间口服200毫克多那非治疗的肝细胞癌患者在第1天的药物吸收和曝光较两次日间口服400毫克索拉非尼治疗的患者要低,但在稳态下(第14天)多那非治疗组的药代动力学值稍高于索拉非尼治疗组。此外,作者报告称多那非组的中位总生存期比索拉非尼组更长,不良事件(AEs)的发生率较低。该研究是首次进行了头对头比较,从药代动力学、疗效和安全性的角度,显示了氘代化合物在这些方面的统计学显著优势。 瑞德西韦(Remdesivir)是一种广谱抗病毒药物,最初由吉利德科学公司开发作为埃博拉病毒感染的潜在药物,后来用于治疗COVID-19,并于2020年获得FDA的紧急使用批准。它是GS-441524的单磷酰胺前药,GS-441524是冠状病毒的RNA依赖性RNA聚合酶抑制剂,由于涉及与腺嘌呤相似的吡咯三嗪结构的广泛氧化和环开放反应,需要静脉给药。为了规避这些药代动力学限制,GS-441524的易受攻击位点进行了氘代化,以减少环的降解,核糖片段的羟基基团被酯化以制备前药并改善口服生物利用度,羟溴酸盐被制备以增加水溶性,得到VV116(图2和表1、表2)。在临床前研究中,VV116显示出良好的口服生物利用度,并在SARS-CoV-2靶向组织中广泛分布活性代谢物。 新药开发 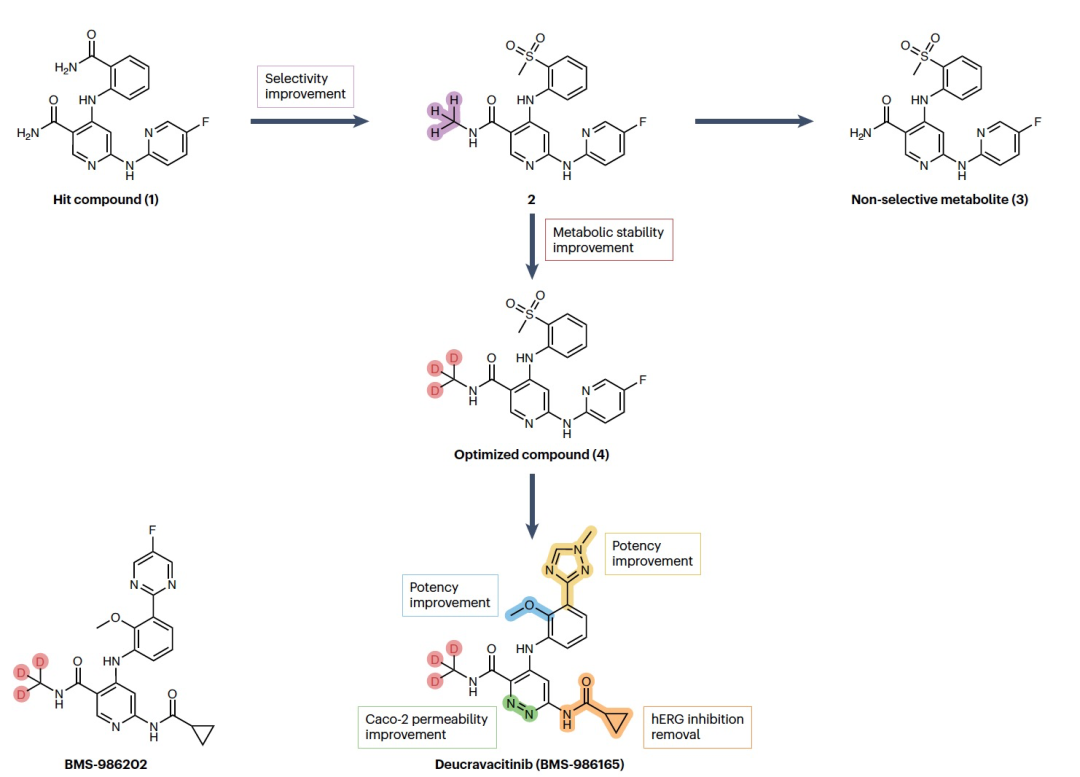 图 3 Deucravacitinib是第一款获得批准的药物,它在市场上没有非氘代对应物。其他已经进入临床试验的新型氘代候选药物包括两种用于deucravacitinib的后续化合物(BMS-986202(图3)和BMS-986322)、deucrictibant11和VX-984。除了这些先进的候选药物,文献中还可以找到其他例子,其中在研发过程的早期阶段使用D来克服药代动力学障碍,并有可能改善其他药物特性。这些包括用于癌症的MDM2-p53蛋白相互作用抑制剂、三阴性乳腺癌的MNK1/2蛋白降解剂、用于COVID-19的Mpro抑制剂、阿尔茨海默病的美金刚烷类似物、自身免疫性疾病的TYK2/JAK1双重抑制剂以及亨廷顿病的PET配体。JAK家族由四个非受体酪氨酸激酶(JAK1-3和TYK2)组成,它们参与许多免疫介导性疾病的发病机制。抑制它们被视为多种自身免疫和慢性炎症疾病的治疗选择。JAK激酶具有两个结构域,一个具有催化活性的JAK同源结构域1(JH1)和一个调节结构域JAK同源结构域2(JH2,也被称为伪激酶结构域),它们相互靠近。尽管前者在不同JAK之间显示出很高的序列同源性,但后者的结合口袋差异更大。在这个领域,deucravacitinib(图2和图3及表3)具有特殊而重要的地位,它是第一类伪激酶抑制剂,通过高度特异的变构机制结合到JH2调节结构域,从而对TYK2具有卓越的选择性。 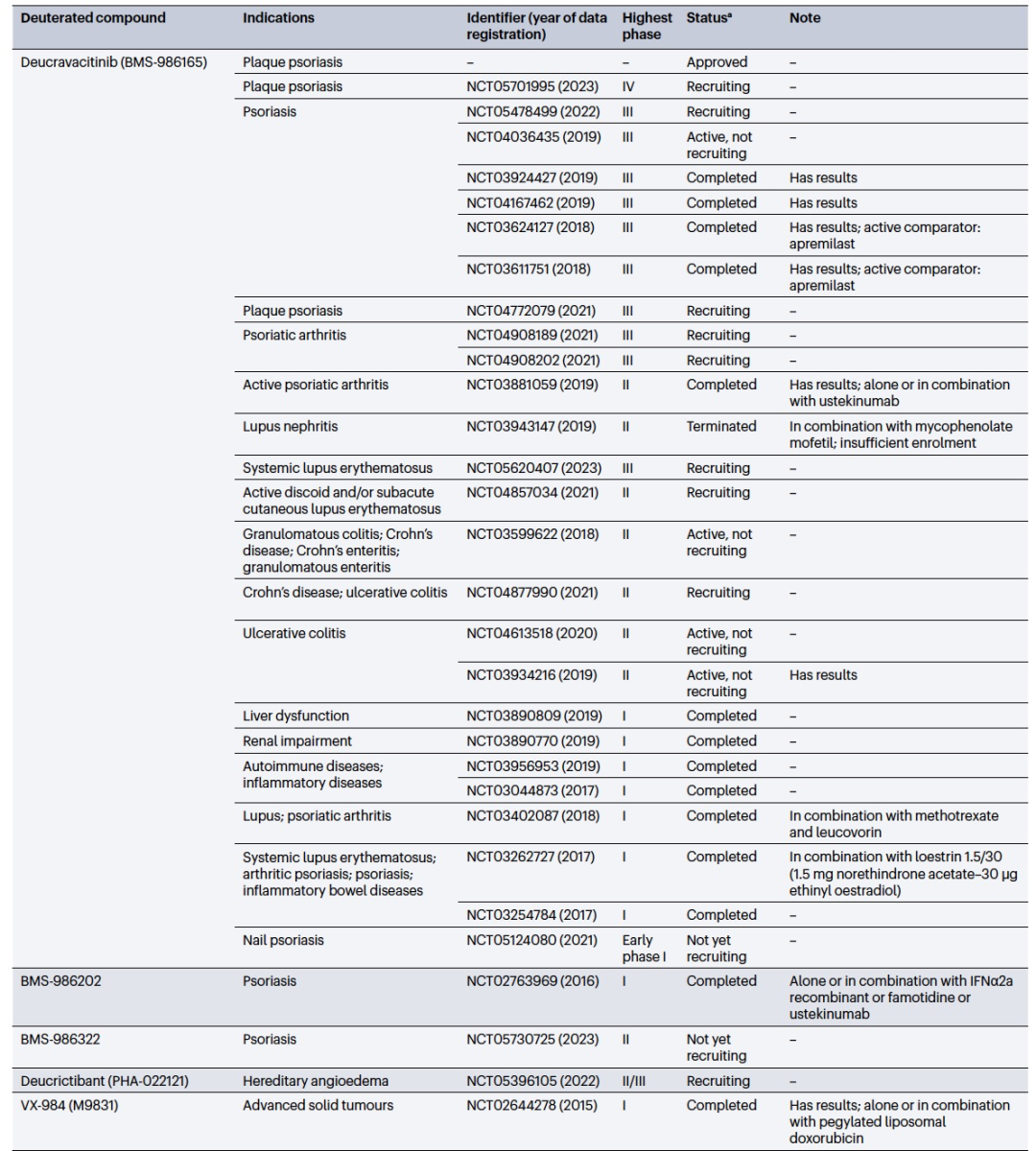 表 3 机遇和挑战  图 4 尽管药物研发中使用氘的方法具有许多优势,但也存在一些缺点。图4中显示的SWOT分析总结了氘化方法的主要优势和劣势,以及机会和威胁,并且下面进一步讨论了其前景。氘化能够增加分子对键断裂的抵抗能力,而不会显著改变其立体位阻或电子性质,这是氘化法的最大优势,明显使其与其他代谢阻滞剂(如卤化物)区别开来。此外,在某些情况下,氘可能是与氟相比更安全的生物同位素,最近的报告提醒人们注意氟化药物的不稳定性和代谢问题,可能产生对人类健康和环境都有危险的物质(例如氟化物或氟乙酸盐)。氘原子对吸收、分布、代谢、排泄和毒性(ADMET)参数的影响不仅限于代谢。虽然H和D之间的亲脂性差异微不足道,但当存在多个D原子时,其累加效应可能导致在血浆蛋白结合(例如,d9-咖啡因)、吸收的程度和/或速率以及P-糖蛋白外排方面出现显著差异,所有这些效应仍未得到充分研究,值得进行未来的调查研究。在这方面,最近的一份报告显示,与非标记对照组相比,小鼠静脉注射d9-美沙酮后的脑血浆比例较低,这表明由于引入了九个D原子而导致的亲脂性降低足以减少氘化分子通过血脑屏障的通透性。氘化的其他正在出现的好处,但仍未完全理解的包括D对药物靶点相互作用的潜在影响(如上所述)和CYP酶的时间依赖性抑制。在药物研发中,细胞色素的抑制是不可取的,因为它可能导致患者进行多种治疗时的药物相互作用。最近一些报告强调,氘化可能降低CYP酶的时间依赖性抑制,尽管目前尚不清楚这种效应背后的原因 目前,尚无来自FDA或其他监管机构的既定指南,详细说明如何解决氘代活性药物中的同位素杂质问题,涉及分析、毒理学和监管事务。这导致国际创新与药物开发质量联盟最近成立了一个工作组,以制定该问题并发展可行的做法。因此,人们越来越担心监管机构可能会采用ICHQ3a的方法,并将同位素异构体和同位素异构体视为常规杂质。如果真是如此,对于公司来说,要满足同位素杂质的规格要求可能会非常困难,因为这些要求取决于用于制备活性药物成分的D源或氘化池的同位素纯度。 值得注意的是,迄今为止,世界卫生组织(WHO)尚未就给氘代活性药物指定国际非专有名称(INN)建立正式规定。据我们所知,INN计划和医疗产品分类单位最近对此问题进行了讨论,根据公开可得的执行摘要,宣布“给氘代物质命名的方式包括在现有或新的INN上使用广泛使用的deu(t)-前缀、将-deu-作为中缀进行嵌入,或者使用第二个词,例如xxdeuter,其中'xx'可以表示D原子的数量”。然而,由于尚未作出最终决定,目前任何新的氘代药物通常都会在其非氘代对应物存在与否的情况下添加前缀'deu-'进行命名。然而,有一些例外情况不遵循这种惯例,没有前缀'deu-',例如poyendarone和dosimertinib,这些药物处于早期开发阶段或正在由拥有自己命名机构的国家进行开发。 结论 总之,氘化是一种不断发展和令人兴奋的方法,具有多种应用,包括药物行业之外的领域。例如,氘化可应用于聚合物的中子散射研究、电子材料和电视屏幕的改进(在重同位素的存在下提高亮度)、荧光显微镜(使用氘化可得到更稳定和更亮的荧光染料)。在综述中,作者总结了氘化在药物研发中的最新进展,并预计尽管面临挑战,将其系统地融入药物化学研究中将改善创新药物的药代动力学和安全性,并有助于降低药物开发的失败率。 参考资料 Di Martino, R.M.C., Maxwell, B.D. & Pirali, T. Deuterium in drug discovery: progress, opportunities and challenges. Nat Rev Drug Discov 22, 562–584 (2023). https://doi.org/10.1038/s41573-023-00703-8 |
【本文地址】
今日新闻 |
推荐新闻 |