【微学堂】米氏常数 Km 是酶学和代谢研究的有力工具 |
您所在的位置:网站首页 › 米氏常数多少正常 › 【微学堂】米氏常数 Km 是酶学和代谢研究的有力工具 |
【微学堂】米氏常数 Km 是酶学和代谢研究的有力工具
|
本文字数:2227字 阅读时间:7分钟 视频时长:5分40秒 01 米氏方程 米氏方程(Michaelis-Menten equation)是表示一个酶促反应的起始速度与底物浓度关系的速度方程。 [1]
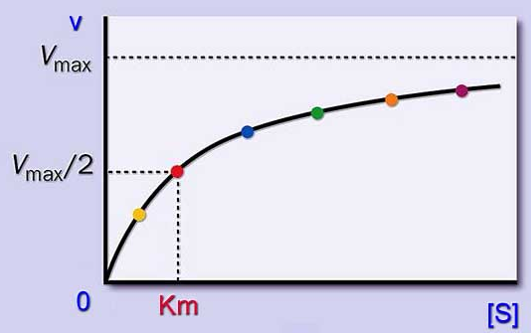
底物浓度 [S] 对酶反映速度的影响 在酶促反应中,当底物浓度非常大时,反应速度接近于一个恒定值。在曲线的这个区域,酶几乎被底物饱和,反应相对于底物 S 是个零级反应。就是说再增加底物对反应速度没有什么影响。在低浓度底物情况下,反应相对于底物是一级反应;而当底物浓度处于中间范围时,反应(相对于底物)是混合级反应。
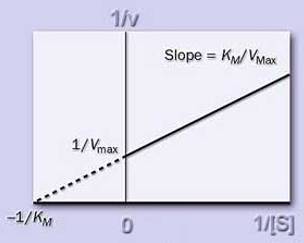
米氏方程是在假定存在一个稳态反应条件下推导出来的,其中 Km 值称为米氏常数, Vmax 是酶被底物饱和时的反应速度,[S] 为底物浓度。由此可见 Km 值的物理意义为反应速度 V 达到 ½Vmax 时的底物浓度(即 Km=[S]),单位一般为 mol/L。 02 米氏常数 米氏常数 Km 是酶的特征常数之一,每一种酶都有它的 Km 值,Km 值只与酶的结构和所催化的底物有关,与酶浓度和底物浓度无关。因此,我们可以通过 Km 值来鉴别酶的种类,但是它会随着反应条件(温度、PH 值)的改变而改变。米氏常数被广泛应用到生物化学、分子生物学、基因工程、生物制药、临床用药等领域的理论、实验和实践中。 03 米氏常数的意义 米氏常数在酶学和代谢研究中均为重要特征数据 : ● 同一种酶如果有几种底物,就有几个 Km,其中 Km 值最小的底物一般称为该酶的最适底物或天然底物。不同的底物有不同的 Km 值,这说明同一种酶对不同底物的亲和力不同。一般用 1/Km 近似地表示酶对底物亲和力的大小,1/Km 愈大,表示酶对该底物的亲和力愈大,酶促反应易于进行。 ● 已知某个酶的 Km,可计算出在某一底物浓度时,某反应速度相当于 Vmax 的百分率。 ● 在测定酶活性时,如果要使得测得的初速度基本上接近 Vmax 值,而过量的底物又不至于抑制酶活性时,一般 [S] 值需为 Km 值的 10 倍以上。 ● 催化可逆反应的酶,对正逆两向底物的 Km 往往是不同的。测定这些 Km 值的差别以及细胞内正逆两向底物的浓度,可以大致推测该酶催化正逆两向反应的效率,这对了解酶在细胞内的主要催化方向及生理功能有重要意义。 04 米氏常数常见作图方法 酶促反应中的 Km 和 Vmax 值有几种测量方法。固定反应中的酶浓度,然后分析几种不同底物浓度下的起始速度,就可获得 Km 和 Vmax 值。但直接从起始速度对底物浓度的图中确定 Km 或 Vmax 值是很困难的,因为曲线接近 Vmax 时是个渐进过程。所以通常都是利用米氏方程的转换形式求出 Km 和 Vmax 值。 01 Lineweaver-Burk 双倒数作图法 将米氏方程转变为: 1/v=(Km/Vmax)(1/S)+1/Vmax
Lineweaver-Burk Plot 以 1/ v 对 1/[S] 作图,可以获得一条直线。从直线与 x 轴的截距可以得到 1/ Km 的绝对值;而 1/Vmax 是直线与 y 轴的截距。双倒数作图直观、容易理解,为酶抑制研究提供了易于识别的图形。 缺点:底物浓度低时,坐标点集中于坐标左下方,使得误差增大,往往偏离直线,Vmax、Km 无法精确定出。 解决方法:底物浓度配成 1/[S] 的浓度级差,而不是 [S] 的浓度极差,使点距离平均,再以最小二乘法线性回归分析。 02 Eadie-Hofstee 作图法 将米氏方程转变为: v=-Km(v/S)+Vmax 以 v 对 v/[S] 作图,得到的斜率是 -Km,x 轴截距是 Vmax/Km,y 轴截距是 Vmax。直接给出了 Vmax,但是 Km 最好由 Vmax/Km 计算出来,因为斜率的计算比较麻烦。 Eadie-Hofstee 作图法的一个好处是不像双倒数作图那样需要很长的外推才能算出 Km 值。但它有与双倒数法一样的缺陷,只是误差没有后者严重。此外,此作图法还有一个问题,就是横/纵坐标都含有变量 v,因此,v 有任何误差都会影响到两个轴。 03 Hanes-Woolf 作图法 将米氏方程转变为: S/v=(S/Vmax)+(Km/Vmax) 以 v 对 [S] 作图,得到的斜率是 1/Vmax,x 轴截距是 -Km,y 轴截距是 Km/Vmax。直接给出了 Km,但是 Vmax 最好由 Km/Vmax 计算而来,因为斜率的计算比较麻烦。 以上三种作图法都有一样的缺点,即数据点分散,但是双倒数和 Eadie-Hofstee 作图法更严重。此外,此作图法避免了 v 误差对 x 轴的影响,所以,相比上面两种 Hanes-Woolf 作图法是最佳的确定酶动力学常数的方法。 05 如何使用 SoftMax Pro 软件中的米氏动力学模板 *视频时长:5’40” **流量预警:38.3MB 下面介绍一下如何使用米氏方程的模板。模板可以在Protocol Manager——Protocol Library——Binding and Enzymology 中的最后一个,单击打开。 打开一个模板首先需要查看 introduction 中对于模板的介绍。在这里,我们能看到米氏方程的公式,各个字符所代表的含义。以及米氏方程的变性公式,y=Ax/(x+B),这个方程是以底物浓度作为x变量,反应速率作为y变量,其中 A 表示最大反应速率,B 表示米氏常数 Km,并以矩形双曲线作图,得到底物浓度 x 和反应速率 y 之间关系的一元二次方程。
在进行酶活计算时,推荐底物浓度控制在 0.05-10Km 之间。文中有提到,一般进行米氏方程计算时会运用到 3 个线性拟合的变形公式,在这里也给出了 3 种方法作图的公式。这里我们就不再介绍了。 看完 introduction 介绍之后,可以到 plate 中进行读板参数的设置,如果参数与模板不同,可在 settings 里进行修改。
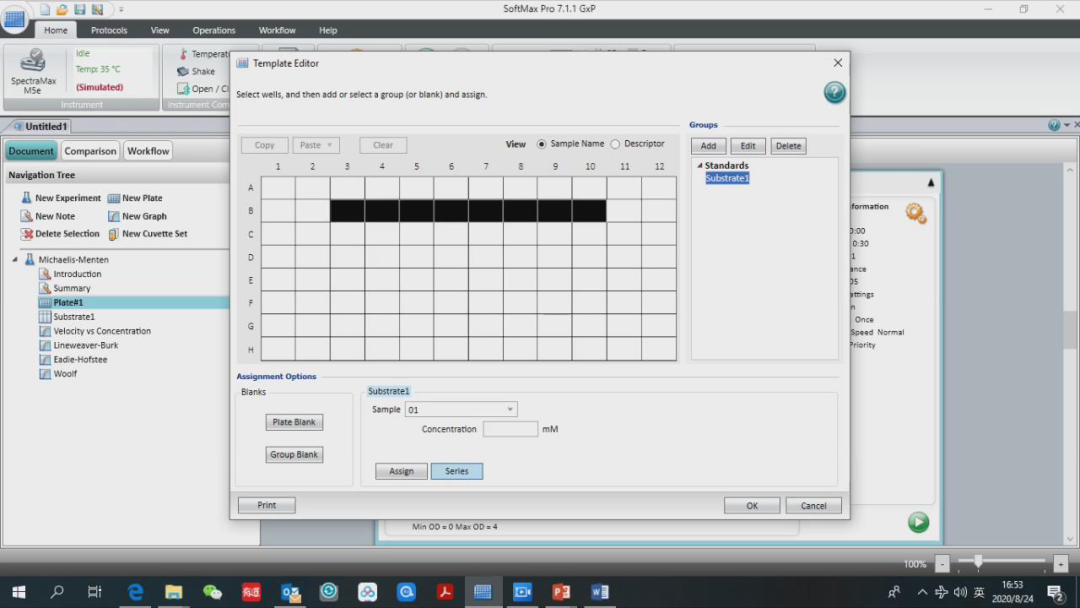
接下来我们在 template editor 中进行样品的定义,这里举个例子,B3-B10 是底物,底物的起始浓度是1nM,2 倍递增。
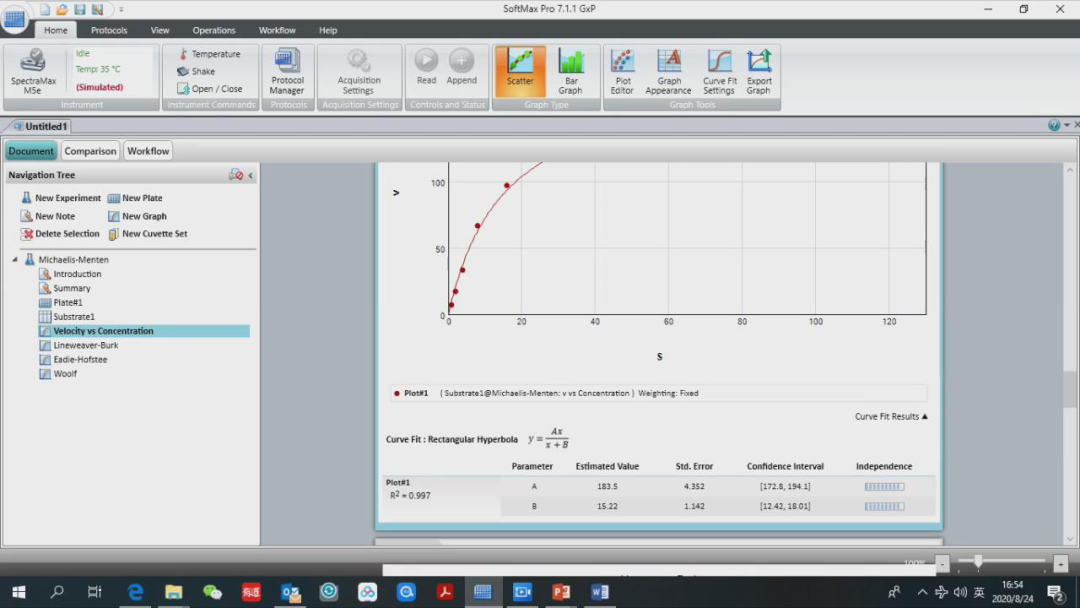
设置好后,可以 读板结束后,可以查看读板参数,在 substrate1 里面查看到刚才设置的底物浓度 Concentration,根据读板结果,我们可以知道反应速度 v 是多少,同时还可以计算得到 1/S,1/v,v/S 和 S/v。 下面是 4 种不同的作图方法得到的曲线。第一个是反应速率 vs 底物浓度关系图,以底物浓度为 x 轴,反应速率为 y 轴,矩形双曲线拟合。 在这个图的下方我们可以看到该图的 R2,A 值和 B 值分别是多少,A 值表示最大反应速率 Vmax,B 值表示米氏常数 Km,这里还有 A 值和 B 值的 error bar,置信区间。
第二个是 Lineweaver-Burk 作图法,以 1/S 作为 x 轴,1/v 作为 y 轴,线性拟合,图下同样会有 R2,A 和 B 值分别是多少。
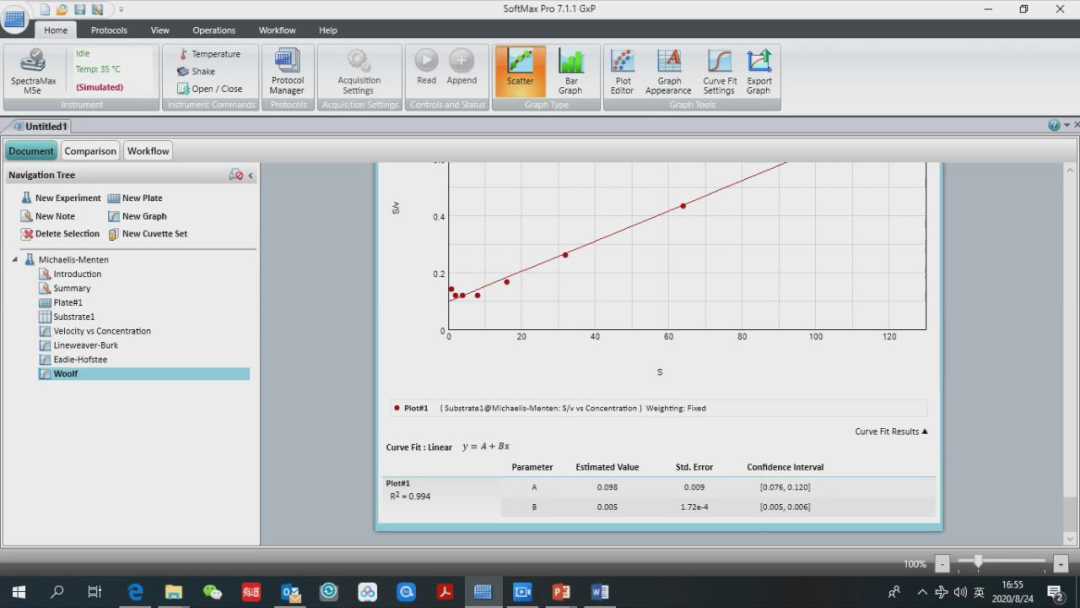
第三个是 Eadie-Hofstee 图,以 v/S 作为 x 轴,v 作为 y 轴,线性拟合,图下同样会有 R2,A 和 B 值分别是多少。 最后一个是 Woolf 图,以 S 作为 x 轴,S/v 作为 y 轴,线性拟合,同样自动计算得出 R2, A 和 B 值。
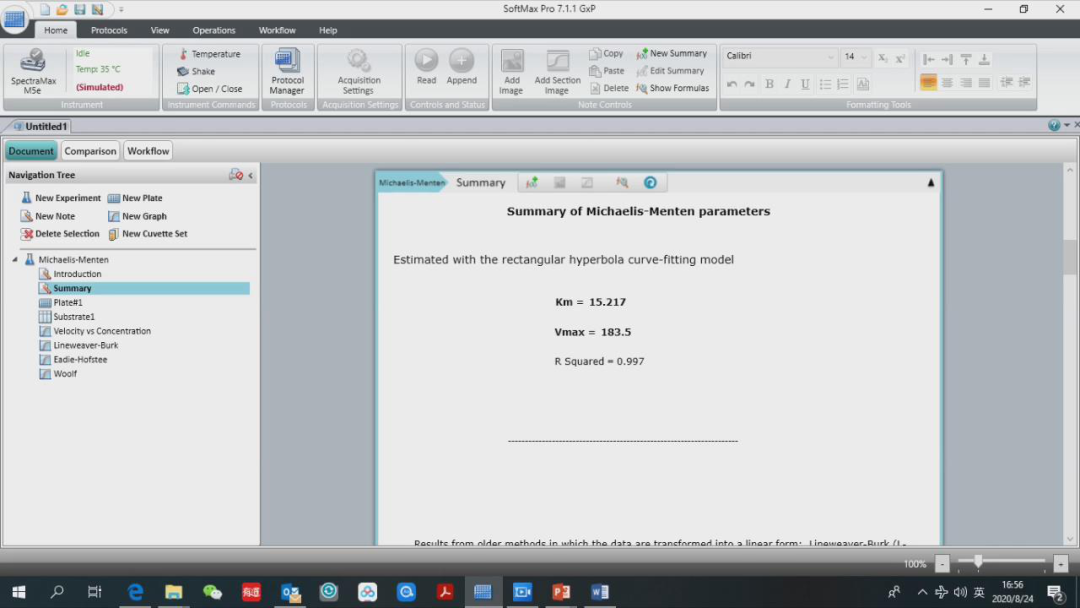
最后可以在模板的 summary 中,更直观的看到本次实验的结果。包括米氏方程计算出的米氏常数 Km,反应速度 Vmax 和 R2。
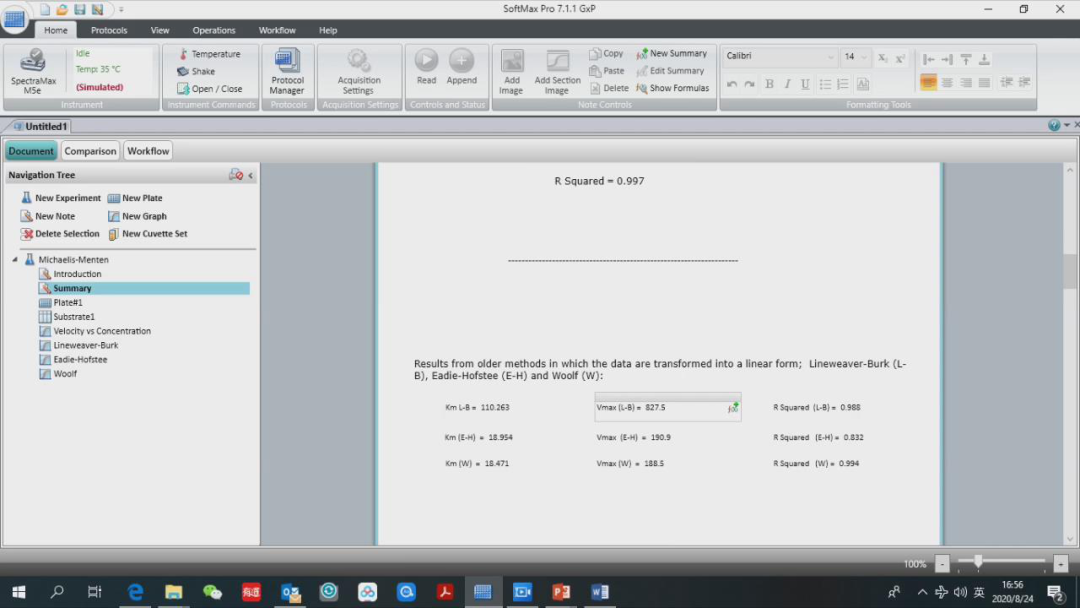
在下面分别是 3 种常用作图法得到的米氏常数 Km,反应速度 Vmax 和 R2。
以上是对米氏方程模板的介绍。 每周五下午 5 点与您相见 好玩的、划算的、有用的、前沿的 帮助您获取生命科学研究及药物研发全方位的解决方案 产品覆盖微孔板检测分析、高通量筛选、 高内涵成像、高效克隆筛选等。
我知道你在看哟 |
【本文地址】
今日新闻 |
推荐新闻 |