【法规】 |
您所在的位置:网站首页 › 简述1期临床试验目的及主要内容怎么写 › 【法规】 |
【法规】
|
背景:现行《药物临床试验质量管理规范》为2003年9月1日版。NMPA在2015年2月6日、 2016年12月2日等发布了征求意见稿,在2017年参照ICH-GCP的内容和格式重新进行修订。 目的:保证药物临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 适用范围:GCP是临床试验全过程的标准规定,适用于各期临床试验、人体生物利用度或生物等效性试验,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。 临床试验(Clinical Trial),指任何在人体(病人或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的安全性和/或有效性。 药品注册分类及临床试验研究内容  临床试验基本流程  临床试验方案基本原则: 必须符合《世界医学大会赫尔辛基宣言》(2013版),其构成了当今GCP的基础,即公正、尊重人格、力求使受试者最大程度受益和尽可能避免伤害,必须把受试者利益放在首位。必须遵循GCP等相关法律法规。必须符合科学和伦理要求。(伦理要求主要指试验方案经伦理委员会批准,受试者在参加临床试验前签署知情同意书)。1期临床试验 试验目的:评估药物的安全性和耐受性(主要)、确定最大剂量、表征PK参数及不良反应。受试者一般为健康受试者。2-4期临床试验 实验目的:评价药物对目标适应症患者的安全性和有效性。实验步骤:前期准备、方案设计、研究者会议、伦理委员会审核、试验启动;受试者入组和随访、监查访视、数据记录和文件管理、试验用药品和标本管理、不良事件管理;总结、资料保存。临床试验各方职责1.申办者1) 申办者负责发起、申请、组织、监查和稽查一项临床试验,并提供试验经费。 2) 试验开始前申办方提供材料:临床批件(有效期3年)、研究者手册、试验用药品。 3) 申办者在获得国家药品监督管理局批准并取得伦理委员会批准件后方可按方案组织临床试验。 4) 提供研究者手册,其内容包括试验药物的化学、药学、毒理学、药理学和临床的(包括以前的和正在进行的试验)资料和数据。 5) 提供临床试验用药品,试验用药品的制备应符合GMP,并经检测合格提供检测报告。进行临床试验前,申办者必须提供试验药物的临床前研究资料,包括处方组成、制造工艺和质量检验结果。 6) 申办者应保存临床试验资料至试验药物被批准上市后五年。 2.研究者1) 研究者应保证将数据真实、准确、完整、及时、合法地载入病历和病例报告表。 2) 研究者应了解并熟悉试验药物的性质、作用、疗效及安全性(包括该药物临床前研究的有关资料),同时也应掌握临床试验进行期间发现的所有与该药物有关的新信息。 3) 研究者须向参加临床试验的所有工作人员说明有关试验的资料、规定和职责,确保有足够数量并符合试验方案的受试者进入临床试验。 4) 研究者应向受试者说明经伦理委员会同意的有关试验的详细情况,并取得知情同意书。 5) 研究者负责作出与临床试验相关的医疗决定,保证受试者在试验期间出现不良事件时得到适当的治疗。 6) 临床试验完成后,研究者必须写出总结报告,签名并注明日期后送申办者。 7) 研究者中止一项临床试验必须通知受试者、申办者、伦理委员会和药品监督管理部门,并阐明理由。 8) 研究者应保存临床试验资料至临床试验终止后五年。 3.伦理委员会(Ethics Committee)由从事医药相关专业人员、非医药专业人员、法律专家及来自其他单位的人员,至少五人组成,并有不同性别的委员,其职责为核查临床试验方案及附件是否合乎道德,并为之提供公众保证,确保受试者的安全、健康和权益受到保护。该委员会的组成和一切活动不应受临床试验组织和实施者的干扰或影响。 伦理委员会审查要点: 研究具有社会价值(研究目的的重要性)和科学价值(研究目的的可实现性)。具有风险控制和管理措施。合理的风险受益比。充分的数据和安全监察计划。受试者招募公平公正。知情同意(完全告知、充分理解、自主选择)。受试者隐私得到保护。数据机密的保护。弱势群体的特殊保护(儿童、精神障碍)。4.监查员1) 保证临床试验中受试者的权益受到保障,试验记录与报告的数据准确、完整无误,保证试验遵循已批准的方案和有关法规。 2) 在试验前确认试验承担单位已具有适当的条件 3) 在试验过程中监查研究者对试验方案的执行情况,确认在试验前取得所有受试者的知情同意书,了解受试者的入选率及试验的进展状况,确认入选的受试者合格; 4) 应清楚如实记录研究者未能做到的随访、未进行的试验、未做的检查,以及是否对错误、遗漏作出纠正; 5) 每次访视后作一书面报告递送申办者,报告应述明监查日期、时间、监查员姓名、监查的发现等。 5.其他参与方CRO:在GCP条件下完成临床试验。 机构办:对医院临床试验项目进行监管和质控。 稽查员:现场试验过程稽查。 数据管理员:数据录入、清理和疑问管理。 统计分析师:统计分析计划、编程和分析报告。 名词解释: 知情同意书(Informed Consent Form,ICF):是每位受试者表示自愿参加某一试验的文件证明。研究者需向受试者说明试验性质、试验目的、可能的受益和风险、可供选用的其他治疗方法以及符合《赫尔辛基宣言》规定的受试者的权利和义务等,使受试者充分了解后表达其同意。 多中心试验:由多位研究者按同一试验方案在不同地点和单位同时进行的临床试验。各中心同期开始与结束试验。多中心试验由一位主要研究者总负责,并作为临床试验各中心间的协调研究者。 药品不良反应(Adverse Drug Reaction):在按规定剂量正常应用药品的过程中产生的有害而非所期望的、与药品应用有因果关系的反应。 不良事件(AdverseEvent),病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。 严重不良事件(SeriousAdverseEvent),临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。(获知后24h内向各方报告) 临床试验保存文件一、临床试验准备阶段  二、临床试验进行阶段 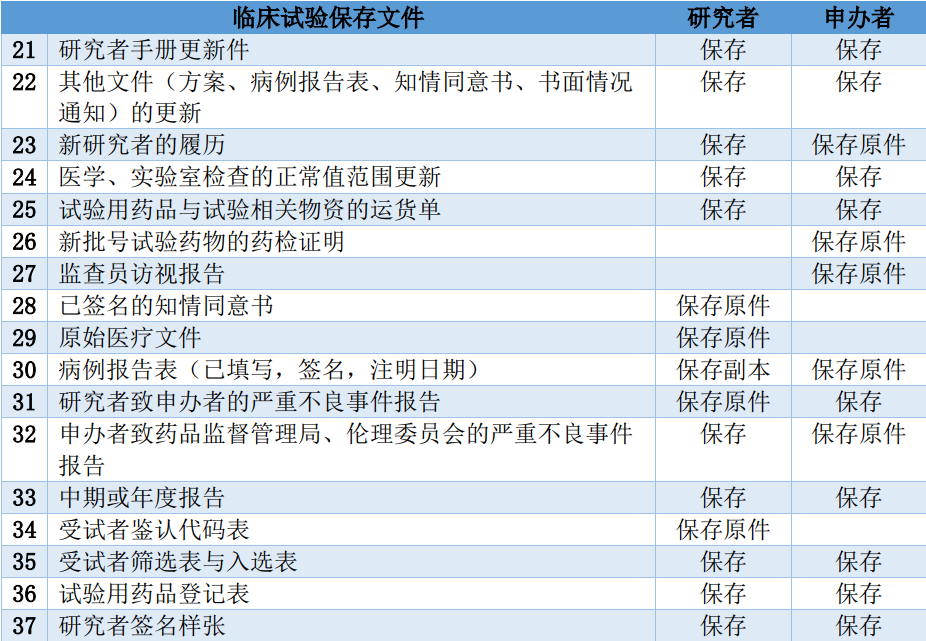 三、临床试验完成后  四、伦理委员会存档文件 
|
【本文地址】
今日新闻 |
推荐新闻 |