Nature 子刊综述 |
您所在的位置:网站首页 › 神经元会减少吗 › Nature 子刊综述 |
Nature 子刊综述
|
供稿 | 赵媛 加州理工博士后 排版 | AiBrain 编辑团队 深刻理解大脑如何调控进食行为,以及高热量食物如何引起过量摄入,是发展糖尿病治疗方案的关键。 来自美国国家糖尿病、消化和肾脏疾病研究院的Michael J. Krashes博士和来自美国国家药物滥用研究院的Yeka Aponte博士等人于2022年7月在《自然·代谢》上发表综述文章,总结了进食行为的3个位相当中的分子和神经环路机制,强调未来发展糖尿病治疗方案、控制体重的关键方向。  过去半个世纪中,高热量可口食物的过度摄入导致糖尿病发病率激增,同时引起与体脂增加相关的一系列并发症,给医疗卫生带来极大挑战。发展体重管理治疗方案需要掌握食欲的神经生物学基础。在本综述中,作者将讨论协调进食行为不同位相——食物获取、摄入和终止的脑区和神经环路。很多开拓性工作已经揭示了与进食行为相关的多个下丘脑核团,而大量近期研究探索了下丘脑之外的脑区,例如中脑边缘系统通路和后脑节点,如何相互连接,调控食欲。 作者还会介绍长期暴露于高热量饮食会如何重构进食环路,并改变动机系统对食物的响应。理解神经系统如何调节进食行为能促进医疗方案的发展,帮助人们维持健康体重。 糖尿病是一个不大合理的笼统性名词,涵盖了正向能量平衡引起的众多生理和心理上的后果。导致进食增加的原因极其复杂,包括基因、社会经济状态、食物供应、侵略性营销、可口食品加工、压力,焦虑、食欲信号、记忆、药品、对内在饱腹信号的抵抗、抑郁、关于健康和营养的错误信息等等。 由于在实验室条件下很难真实复刻社会性因素带来的影响,绝大部分工作主要着眼于研究进食行为的神经生物学机制,理解糖尿病发生的机理。在被误导的人们当中可能存在一个普通的迷思,即认为体重管理——能极大地被食物摄入驱动,会受严格的意志控制,人们能坚定地决定吃什么、什么时候吃以及怎么吃。 实际上,我们的神经生物学系统已经进化到确保我们摄入足够热量并产生盈余,相比能量储存不足,这个机制更有利于满足日常需求。为高效、持久地对抗这个进化出的过量进食的压力,糖尿病治疗方案必须针对与进食相关的中央机制的多个位点。 在本文中,作者将回顾介导进食行为的位相复杂性和序列性的神经环路,这一系列动作能被总结性地划分为3个清楚的作为(图1):1)食欲阶段,觅食并接近食物;2)摄入阶段,自反馈循环促进食物摄入;3)终止阶段,由机械性和化学性信号的共同作用来停止进食。 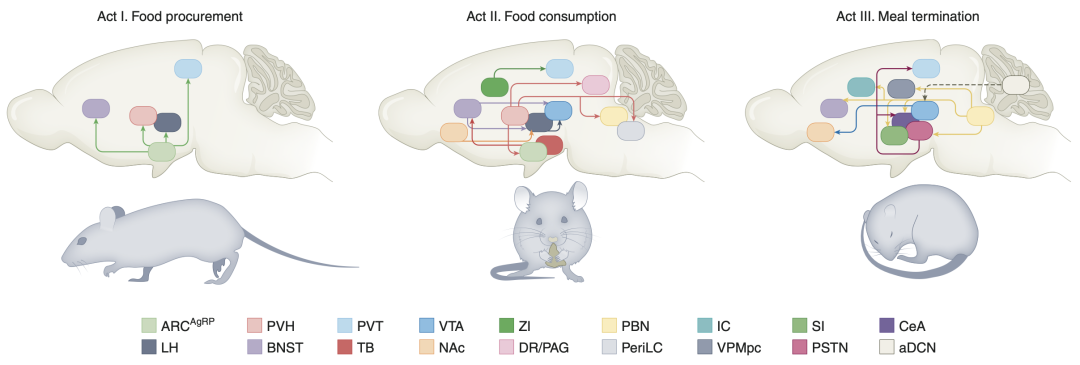 图1 介导食欲3个作为的神经环路。左,作为I:食物获取。抑制性ARCAgRP神经元投射到BNST、PVH、LH和PVT,促进觅食和之后的食物摄入。中间,作为II:食物摄入。激活LHVGAT或抑制LHVGLUT2神经元,通过到VTA的直接投射来增加食物摄入。GABA能TBSST神经元到BNST和PVH的投射,以及ZI神经元到PVT的投射,能有效驱动摄食行为。兴奋性PVH神经元通过到ARC、DR/PAG、PBN和periLC的投射来调节食物摄入。右,作为III:餐食终止。激活兴奋性PBNCGRP抑制摄食,产生学会的和防御性反应,并通过到CeA、BNST、SI、PSTN、VPMpc和IC的投射引起全身乏力。激活兴奋性aDCN神经元,通过提高纹状体多巴胺水平来降低餐食量,还能减弱食物摄入引起的位相性多巴胺响应。实线箭头标识直接连接,虚线箭头指示间接连接。ARC,下丘脑弓状核;AgRP,刺豚鼠相关肽;BNST,终纹床核;PVH,下丘脑室旁核;LH,外侧下丘脑;PVT,丘脑室旁核;VGAT,囊泡GABA转运体;VGLUT2,囊泡谷氨酸转运体2;VTA,腹侧顶盖区;D1R,多巴胺1受体;TB,结节核;SST,生长激素抑制素;ZI,未定带;DR,背侧缝际核;PAG,导水管周围灰质;PBN,旁臂核;periLC,蓝斑核周围区;CeA,中央杏仁核;SI,无名质;PSTN,旁丘脑底核;VPMpc,腹后内侧核小细胞区;IC,内脏岛叶皮层;aDCN,小脑深部核团前部。 上下滑动查看 大脑塑造动机性行为的理论早在一个世纪之前就被提出,当时人们发现患有肿瘤、脑损伤和其它病理表征的病人会有适应不良的进食行为。大量报道都共同指向下丘脑,包括外侧下丘脑(LH)、下丘脑旁室(PVH)、内侧下丘脑腹侧(DMH)、内侧下丘脑背侧(DMH)和弓状核(ARC),它们都不同程度地影响进食。而在下丘脑门控进食行为之上的是多巴胺能中脑边缘系统影响对食物的动机性,包括食物的奖赏特性,获得概率的习得,与食物获取相关的预测和关联记忆等。 虽然这些开创性发现揭示了在食欲或对进食的渴望中起作用的不同脑区,研究还是受到技术的限制,包括缺乏解剖学精确性、细胞类型特异性和作用的靶标位点。另外,很多方法不可逆,使得人们很难判断结果是由初始的操控直接还是间接导致的。这些约束给不同个体或实验室之间的可重复性带来很大挑战,使得对食欲的中央机制的理解广泛而脱节。 以上的障碍催生了基因技术驱动的细胞操控技术的发展,利用转基因小鼠全局敲除、特异删除或过表达关键肽和受体基因。通过这些策略,人们发现并验证了调控能量平衡的多种分子,包括源自脂肪细胞的激素——瘦素及其同源受体(LEPR)、黑皮质素系统和源自肠道的肠促胰素——胰高血糖素样肽1(GLP1)及其受体(GLP1R)。 虽然这极大增加了人们对精确细胞类型和信号通路的理解,但这些操控贯穿发育过程,因此基因干扰引起的补偿效应很难被检测到。为绕过这一不利条件,有些研究在成年阶段用白喉毒素即时抑制下丘脑神经元,能极大地影响进食。 虽然这解决了发育中的补偿效应,它也带来新的问题,比如短时的动力学特性和长久性影响的定义不明确,另外,仅测试了介导摄入行为的细胞类型必要性而非充分性。鉴于此,我们需要发展根据分子类型定义的神经环路分析技术。 近年来,神经科学领域对靶向技术的突破能帮助我们处理这些实证问题。过去二十年中,研究人员利用高时空精确性的工具来操控基于分子或行为定义的细胞类型,来研究它们在进食行为中的作用;光遗传学和化学遗传学技术可回答充分性和必要性的问题;在体光学成像和电极记录可在行为中的动物上评估内源的、实时的神经元活动。这些手段再与以下技术结合:细胞特异性逆向和顺向追踪、离体活脑片电生理和成像、单细胞RNA测序、精确测量且需更少实验者干预的自动化机器、创新性追踪方案和高效鉴定设计等等,能够为研究进食行为的中央机制提供难以想象的细节。 序言 对热量的食欲 食欲,是指无论身体处于何种能量状态时对某种特定食物的进食欲望。饥饿,是身体在食物剥夺和/或过量能量消耗之后急需补充热量的感觉,这个感知来源于多种外周信号分子,例如饥饿素,一种由胃释放的促进食欲的激素,在断食时升高,在热量摄入时快速降低。饥饿素由外周转运到中央神经系统,作用于多个脑区,引起觅食和进食行为。外源施予饥饿素能剂量依赖地、充分地增加食物摄取、提高体重和促进肥胖症。 为维持合适的能量平衡,防止过度饮食,厌食激素比如瘦素能促进满足感(餐食之间满足或胞了的感觉),以及饱足感(餐食期间逐渐胞了的感觉,并最终导致餐食终止)。 瘦素主要由脂肪组织产生,其在血液循环的水平与脂肪组织含量和能量储存量正相关。与饥饿素类似,瘦素编码了身体的当前热量状态,但方式正相反:断食时瘦素水平降低,而在进食时升高。缺乏瘦素的小鼠表现出进食和体重极剧增加;相反地,施用瘦素能抑制食欲,在部分人群和啮齿类动物模型中逆转糖尿病。 饥饿状态,可被视为促进食欲和抑制食欲的外周信号为恢复能量稳态在中央神经系统整合后的结果。虽然在整个大脑中都发现了表达饥饿和满足信号的受体的神经元,但它们更多地集中在ARC。 ARC作为体液信号分子的切入点,完美地坐落于第三脑室和中央隆起的边缘,具有有孔毛细血管和不完整的血脑屏障。食物剥夺能增加这些有孔毛细血管的穿透性,使得循环中的营养性分子能轻易到达并影响ARC(Arcuate nucleus,弓状核)神经元。 阶段I 食物获取 ARCAgRP神经元编码饥饿状态 表达刺豚鼠相关肽(AgRP)的ARC神经元(ARCAgRP)能被饥饿素激活,被瘦素抑制。与这些激素效应一致的是,电生理和光纤光度计监测表明ARCAgRP神经元在动物断食或食物剥夺时被最大程度激活,部分原因是兴奋性基调被调高。在自由喂食的啮齿动物中,ARCAgRP神经元活动与日间节律相关。动物在暗周期摄入绝大部分的日常热量,在进入在光周期后开始降低能量消耗,相对应地,绝大部分ARCAgRP神经元在光周期初始时静默,但随着时间增加其活动缓慢升高,从而促进动物觅食和摄食。 ARCAgRP神经元能释放AgRP、神经肽Y(NPY)和γ-氨基丁酸(GABA),这些分子都会参与进食和代谢。化学遗传学抑制ARCAgRP神经元能在饥饿小鼠中抑制进食,而损毁ARCAgRP神经元会终止进食。另外,扰乱ARCAgRP神经元还能调控营养分配,包括摄食后偏向脂肪囤积,通过抑制肩胛区棕色脂肪组织(iBAT)的生热作用(能被降低的交感神经活动和iBAT基因表达模式的快速重编程触发)来降低能量损耗和消散,以及通过中脑边缘系统增加食物的奖赏特性。 然而,光遗传学或化学遗传学激活ARCAgRP神经元能充分驱动贪吃性的觅食和摄食。最近研究表明它们还会抑制其它动机性系统来保证进食,例如渴觉、先天恐惧、伤害感知、攻击、交配、育儿、睡眠和自我保护等。 ARCAgRP神经元在觅食中的作用 一开始人们认为ARCAgRP神经元特异生驱动食物摄入过程,但近期研究表明它们主要参与觅食,即食欲位相,而非摄入位相(Box1)。在没有食物的情况下,人为激活ARCAgRP神经元会极强地增加与觅食相关的运动位移;有三个范式转换实验研究表明这些神经元具有前瞻性和预防性。 特异神经元记录实验表明在食物呈现的几秒内、咬入食物之前,ARCAgRP神经元呈现出一致的抑制反应(图2a)。这个抑制是特异响应对食物的感知,包括条件性预测食物呈送的信号,从而确定这些神经元具有一定程度的学习功能。ARCAgRP神经元的抑制反应起码部分源自上游的谷氨酸能LH-GABA能DMH环路,来停止进食。 ARCAgRP神经元活动的持续性抑制依赖于之后的热量消耗,并与肠道检测到的热量成比例。在饥饿动物中,ARCAgRP神经元被抑制的程度相比饱足动物更高;而可口食物能引起更强的抑制,即使在饱足动物中也能抑制ARCAgRP神经元。 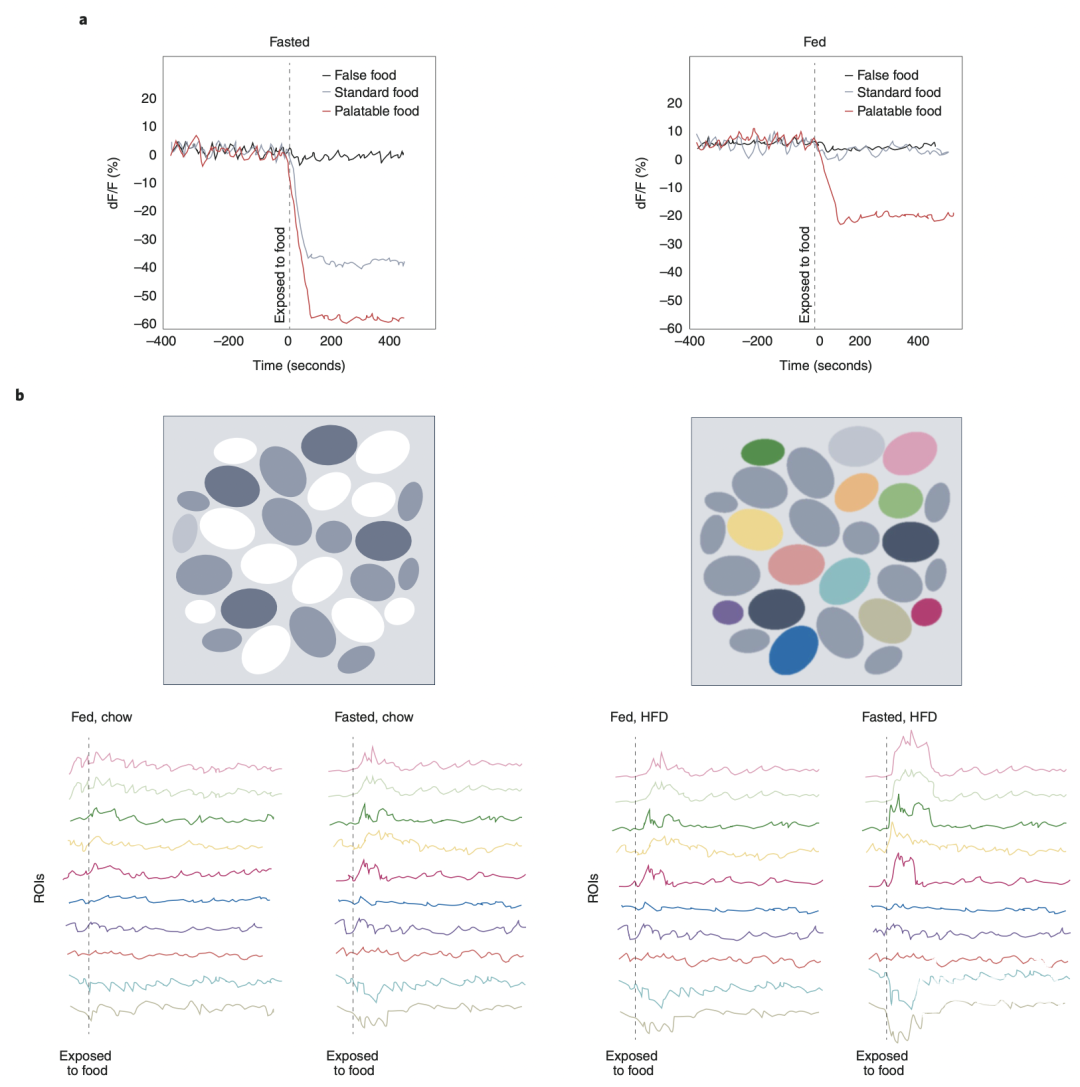 图2 进食神经元活动与能量状态和食物可口性相对应。对调控食欲的神经元做实时记录,包括在体电极记录和/或用基因编码的钙指示剂(GECIs)监测钙动力学来间接记录神经元活动,都显示它们在热量剥夺状态和面对能量富集的食物时响应更大。这些兴奋性或抑制性响应发生于摄食之前、起始或之后。a. 在表达GECI——GCaMP(一种融合了绿色荧光蛋白、钙调蛋白和M13的合成性分子,M13是肌球蛋白轻链激酶的一段肽序列)的断食(左)或饱足(右)小鼠上做光纤光度计记录获得的曲线实例,对齐到食物暴露时刻(虚竖线)。神经元的群体动力学对假食物不敏感(黑线),但会被标准鼠食快速且稳健地抑制,这个抑制仅在有能量缺陷的小鼠中发生(银线),而可口食物能增加这个抑制反应的幅度,甚至在热量充足的小鼠中也能观察到(红线)。dF/F表示静息状态和食物呈现后的荧光强度差异。此图修改自原文中文献84。b. 在表达GCaMP的断食或饱足小鼠上,用单光子微内窥显微技术或双光子技术记录单个细胞活动(ROIs,感兴趣区域)的曲线实例,对齐到食物呈现时刻。左上,GCaMP的在体微表面荧光成像。右上,表达GCaMP的神经元在动物进行自由进食任务时细胞反应的示意图例,可在不同时段追踪记录相同神经元的活动(彩色细胞)。在饱足和断食动物上,记录到单个神经元对标准鼠食(左)或高脂食物(右)的钙信号反应曲线。单个细胞呈现出对食物的多样化反应,在摄入之前、当中和之后要么被激活(向上信号),要么被抑制(向下信号)。这些反应通常在饥饿动物中或是面对能量丰富的食物如HFD时更大,也有些神经元对食物没有反应。 上下滑动查看 在食物呈现之前而不是期间进行光遗传学激活ARCAgRP神经元,能重现上述预期性生理反应。在这种实验模式下,小鼠依然呈现出进食的极剧增加,即使只给予1分钟的预先刺激,或者是在刺激后延迟几分钟给予食物。刺激ARCAgRP神经元之后的食物摄入很可能是来自于ARCAgRP神经元下游靶标的持续性活动。NPY就是对持续性饥饿信号通路有独特的必要作用的分子,从而将ARCAgRP神经元的动力学与进食行为相关联。 综上,这些结果更新了我们对ARCAgRP神经元功能的认识:其主要功能是指引有热量需求的动物找到食物来源。与此相应地是,ARCAgRP神经元对位移运动和探索行为有必要性作用,从而有助于在预定的进食行为起始时发现食物。 Box 1 ARCAgRP神经元的 动机性效价 ARCAgRP神经元活动如何促进动物寻找食物?一个简单的方法是确定与这些细胞活动相关联的效价。实验显示,小鼠不会通过操作性响应来关闭ARCAgRP神经元活动,这首先说明这些神经元不是通过负向强化来驱动行为。然而刺激ARCAgRP神经元后,即使它们恢复静默,其对进食的影响持续存在,从而使得小鼠可能难以将某个动作与这群神经元的急性抑制相关联。事实上,训练后的饱足小鼠在没有食物的情况下,会回避ARCAgRP神经元的活化,而断食小鼠呈现出与ARCAgRP神经元抑制相关联的位置偏好。因此,ARCAgRP神经元编码了负向效价信号,从而驱动小鼠觅食来消除或抵抗这个信号。然而,在有食物的情况下,小鼠会通过按压手柄来光激活ARCAgRP神经元,这说明刺激ARCAgRP神经元也可能是有正向强化作用。 虽然不像中脑多巴胺能神经元那样本质上具有奖赏性,小鼠会在食物摆在面前的条件下,或是通过正向学习后,自刺激它们的ARCAgRP神经元来增加食物的激励性价值。这个结果支持这样一个模型——激活ARCAgRP神经元能持续性增加食物的奖赏性,这很可能是通过增强中脑边缘系统的多巴胺能活动及其随后在纹状体的多巴胺释放来实现的。因此,ARCAgRP神经元活动的准确效价是情境依赖的——在没有食物时编码厌恶性信号,驱使小鼠觅食来平息这个信号,而当找到食物后,这些神经元的活动又变得更具有奖赏性。ARCAgRP神经元活动在摄入起始前就已经大幅度降低,因此摄入过程中食物的持续性正向效价很可能不是其本身驱动的,而是通过下游靶标来促进摄入位相的进行。 ARCAgRP神经元的下游靶标 为进一步理解ARCAgRP神经元如何编排调控进食行为,如何感知食物、评估食物的价值,实验探究了ARCAgRP神经元在下丘脑内外的投射。在ARCAgRP神经元轴突表达视紫红质通道蛋白2(ChR2)后,刺激其到PVH、终纹床核前部(aBNST)或LH的投射,能充分引起进食,效果与直接刺激胞体相当(图1);刺激其到丘脑旁室核(PVT)的投射能增加对食物气味的吸引;而刺激其到中央杏仁核(CeA)、导水管周围灰质(PAG)和臂旁核(PBN)的投射没有反应。 进一步研究还发现,刺激ARCAgRP神经元到内侧杏仁核(MeA)和内侧视前区(MPOA)能充分引起进食。逆向示踪技术表明,ARCAgRP神经元的投射是一对一结构,与各下游区域对应的神经元之间相互独立,没有侧向交流。与之相应地,转录分析识别了多个ARCAgRP神经元亚型,其基因表达具有状态依赖性。因此,虽然ARCAgRP神经元对食物相关的信号和饥饿素的响应呈现同质性,其信号通路存在功能、分子水平和结构的异质性。 高脂饮食对ARCAgRP神经元的影响 在小鼠中,饮食诱导的糖尿病(DIO)会导致断食后重进食的减少,无论是使用标准鼠食还是高脂食物(HFD)。这个进食的减少能被光刺激ARCAgRP神经元逆转,说明在DIO小鼠上断食没有完全激活这些神经元。长期在体记录实验表明,长期暴露于高脂饮食会降低ARCAgRP神经元的基础活动,而脑片记录显示,暴露于HFD后ARCAgRP神经元的固有兴奋性提高,这说明在体和离体研究存在一定矛盾。 HFD小鼠在断食后,ARCAgRP神经元对标准鼠食的抑制性响应减弱,说明欠可口食物不能完全降低觅食的动力(Box 2),而HFD能进一步抑制ARCAgRP神经元活动。延长HFD暴露时长还能扰乱中脑边缘奖赏系统对食物的响应。HFD小鼠中,腹侧被盖区(VTA)的多巴胺能神经元对标准鼠食的响应减弱,而保持对HFD的响应。 以上这些结果证明,暴露于高脂饮食重构了维持稳态和享乐性的进食行为系统,促使动物倾向于寻找更高热量的食物,从而导致过度饮食和糖尿病。 Box 2 进食神经元活动与能量状态 和食物可口性对应 对食物刺激有反应的神经元有个共同特征是,能同时被动物的内在能量状态和食物的享乐可口性调控,且通常分别与热量剥夺时长和食物含有的热量值呈比例(图2)。当动物处于热量缺陷状态时,神经元对食物的反应更强烈,且能被含有高能量成分,通常是高脂肪含量的食物,进一步提高。例如,当动物饱足时,ARCAgRP神经元对正常食物不会或少量地表现出抑制反应,但在饥饿动物中,食物具有激励性价值,这些神经元活动会被快速、稳健地抑制。对这个状态依赖的增强性反应的另一个解释是,在不同能量状态下,神经元的基线活动可能正好相反。ARCAgRP神经元在热量剥夺时被激活,在饱足后相对静默;因此在断食状态下其基线活动更高,对食物的抑制反应会更明显。类似这样的神经元活动与能量状态相关的现象在很多与进食相关的节点都被观察到。 可口性与食物引起的愉悦感相关,能增强从感知到摄入后的肠脑轴反馈的一系列反应,从而增加每次摄食的时长。可口食物通常是能量富集的,能增强感知和吸引力,从进化角度来讲,带有高度偏向性。如同在人类中饥饿能增加主观上的可口性,给断食动物呈现能量富集的食物比正常食物能引起更强的神经元反应;得益于对可口食物的强偏好,即使在能量富足的动物中,它们也能引起明显的神经元活动。虽然神经元的急性抑制反应主要是由可口食物更强的可感知特性驱动的,长久性的抑制反应通常与摄入或向胃肠直接灌流的热量值成比例。而且,近期研究还确定了更倾向于被可口食物激活的神经元。因此,可口性是调控食欲的一个关键因素。 因此,ARCAgRP神经元在饥饿引起的进食行为的第一位相——觅食中发挥作用,其投射呈现出异质性,以驱动对觅食的渴望。依据投射区域和转录模式,ARCAgRP神经元可被分为多个亚群。之前的研究仅通过总体食物摄入来研究进食相关的细胞类型和投射,之后的工作需要详细分析不同ARCAgRP神经元亚群如何调控进食行为的方方面面,不一定是总体食物摄入,也可能是进餐次数,一次餐食量,或者获取食物的动力。 ARCAgRP神经元的功能异质性可能由其共表达的其它肽分子、神经递质或受体介导。进一步的实验可利用新型基因工具来操控共表达其它基因的ARCAgRP神经元,以研究其在进食行为中的作用。 有意思的是,ARC中还发现了其它抑制性神经元,能驱动摄食和增重,可被酪氨酸羟化酶、孤菲肽前体或生长激素抑制素(SST)标记。尽管这些神经元亚型的促食欲环路和动力学还不清楚,它们具有与ARCAgRP神经元类似的下游靶标。 虽然ARCAgRP神经元具有一定的功能性和转录水平的异质性,它们在饥饿动物找到食物时表现出同质性的快速活动下降,说明它们本质上对觅食而非摄入具有必要性。ARCAgRP神经元在餐食一开始残留的低速发放及其下游持续性活动,可能编码了持续性的驱动力,从而在进食行为的下一个位相——食物的摄入中发挥作用。 阶段II 进食 LH对进食的控制 摄食节律主要受后脑运动环路调制,而对食物摄入的指挥,包括餐食量、时长、频率和速度,发生在多个大脑节点(图1)。这些解剖结构中的各细胞类型对摄食呈现出不一样的反应,能双向调控进食行为(图2b)。 LH和PVH是ARCAgRP神经元的直接下游,因此很完美地处于从觅食到摄食的转换位置。特别地,LH是一个高度异质性结构,表现在基因表达、功能和组织性方面。断食大鼠中,LH的胞外谷氨酸浓度升高,而在进餐终止时回归到基线水平。光遗传学激活小鼠LH中表达囊泡谷氨酸转运体2(SLC17A6或VGLUT2)的神经元能降低摄食,引起厌恶反应。另外,在操作型行为范式中训练小鼠辨识断食期和饱足期,发现激活LHVGLUT2能降低断食小鼠对饥饿的感知。而且,LHVGLUT2接受来自BNST的抑制性输入,激活这个通路能在饱足小鼠中触发摄食,而抑制这个通路能在食物剥夺的小鼠中抑制食物摄入。 光遗传学或化学遗传学激活表达囊泡GABA转运体(SLC32A1或VGAT)的LH神经元能在饱足小鼠中促进食物摄入,引起正向效价,而急性和/或慢性抑制这些神经元能降低食物摄入,减少体重。在体钙成像实验表明,不同的、非重叠的LHVGAT神经元亚群虽然其反应具有异质性,但在食欲和摄入位相都被激活,这点与ARCAgRP神经元不同。有趣的是,训练小鼠区分断食和饱足状态后,激活LHVGAT神经元不会引起饥饿的感知,说明这些神经元的作用是帮助维持而不是诱导饥饿状态。进一步划分LHVGAT神经元发现,有一部分被称为瘦素受体神经元的细胞投射到VTA,激活这个通路能促进获取食物的动力,介导食欲学习。 LH中非GABA能神经元表达促黑色素浓缩激素(PMCH)和下丘脑分泌素(HCRT),长期以来被认为参与食欲调节。脑室内灌注PMCH或HCRT能增加食物摄入。损毁LHPMCH神经元会引起消瘦和糖尿病抵抗;损毁LHHCRT神经元会降低食物摄入,但矛盾的是,会引起体重增加和糖尿病发生,这或许是通过调节能量损耗实现的。 化学遗传学激活LHHCRT神经元会增加食物摄入,而抑制它会导致过量进食和糖尿病。然而,光遗传学或化学遗传学激活LHPMCH神经元并不能增加食物摄入,除非将刺激临时与摄食配对。而且,单激活LHPMCH神经元是奖赏性的。一个最新研究表明,LHPMCH神经元导致的过量摄食与冲动行为的增强有关,而不是提高了对食物的动力,而且它们与腹侧海马(vHP)的连接可能在驱使冲动反应中发挥作用。 虽然一些研究发现电刺激LH能诱导选择性进食,但另一些研究表明电刺激LH引起的反应取决于与不同外部因素的相互作用,包括喝水、狩猎攻击、啃咬和性行为。人为操控LHVGAT神经元不仅调控热量型食物的摄入,而且也调控对非营养性食物和不能食用物体的“食用”行为。另外,特异性光刺激LHVGAT神经元到VTA的投射能引起与热量无关的、不规则的舔舐和啃咬行为。虽然LH诱导的目标导向行为似乎不具有食物特异性,更新的技术支持了之前的发现,即这些与摄食相关的神经元的激活是正向奖赏性的。 LH-VTA-NAc回路 LH有向VTA的抑制性和兴奋性投射,而LHVGAT神经元通过抑制VTA神经元来驱动进食(图1)。光激活LHVGAT-VTA通路在饱足小鼠中增加食物摄入,并在厌恶条件下促进觅食。在一个条件性进食任务中,电记录LH发现一群神经元在小鼠条件性进入食物传送区时发放,而在食物摄入时没有响应;而另一群神经元通过VTA对食物预期信号有反应,说明LH不仅在摄食过程中发挥作用,还对摄食准备有贡献。LHVGAT神经元活动升高会抑制VTA的GABA能神经元,促进伏核(NAc)内的多巴胺(DA)释放;而LHVGLUT2神经元活动抑制NAc的DA释放。NAc主要包含两大类神经元:表达多巴胺D1和D2受体的中型多棘神经元(MSN)。其中,NAcD1投射是LH的GABA能神经元的重要抑制性输入来源,其活动在进食期间降低。激活NAcD1可抑制LH的GABA能神经元,从而终止进食,而抑制这个通路可促进食物摄入。 饮食诱导的糖尿病对LH可塑性的影响 在体功能成像证明LHVGLUT2编码满足感状态,其奖赏性编码的性质会在糖尿病中发生改变(图2b)。特别地,DIO小鼠中LHVGLUT2神经元会逐渐失去对葡萄糖摄入的响应,在静息状态时更静默,说明在HFD小鼠中这些神经元会丧失限制进食的能力。在一个过量进食的模型中,暴露于高可口食物仅3天后,NAc到LHVGLUT2和LHVGAT2神经元的抑制性输入就呈现出长时程增强,而在标准鼠食喂养的小鼠中没有这个增强。因此,高可口食物触发的对LHVGLUT2神经元的抑制增强会诱导过量进食。 PVH对进食的控制 研究利用损毁、药物学和基因敲除技术,证明PVH在食欲控制中发挥关键作用。PVH的绝大部分神经元可被转录因子单意1(SIM1,对发育起必要作用)标识,急性损毁这些细胞,或其中表达黑皮质素4受体(MC4R)的亚群可导致糖尿病。更多的实验证明不同PVH神经元亚型可决定摄食行为,实时抑制能增强食物摄入,而激活则抑制。激活表达SIM1、MC4R或催产素的PVH神经元可抑制ARCAgRP-PVH通路诱导的进食行为。有趣的是,记录表达GLP1R或促皮质素释放激素(CRH)的亚群发现,它们对食物分别表现出急促、持续的活动增加或降低,而MC4R亚群只会呈现一个瞬时的反应,说明这群神经元的异质性。对PVHMC4R的单细胞内窥显微成像证实了其多样性,它们对食物呈现、后续摄入和能量状态表现出多样的反应。对PVH的无偏见双光子成像表明,共表达Crh、Vglut2和Npy1r的神经元会对热量摄入有反应。 periLC对进食的控制 促进满足感的PVH神经元向脑干有高密度的投射,特别是在脑桥,谷氨酸能通信传递了饱足信号。抑制PVHSIM1轴突到中脑中靠近PAG和背侧缝际核的腹外侧位置的突触联系,可在饱足动物中明显且稳健地促进进食。通过功能获得和功能缺失实验,另有研究确认了PVH到臂旁复合体(包括蓝斑核周围区periLC和中央外侧臂旁核PBN)的关键投射,可调控食欲。虽然这些下游神经元的分子标记还不清楚,一个开创性工作对自由移动的小鼠后脑做钙成像发现,periLCVGLUT2神经元可选择性对摄入行为进行调谐,并被食物可口性和内在状态成比例地抑制。periLCVGLUT2神经元的活动降低是奖赏性的,会通过增强食物可口性和延长摄入时间来促进摄食。PVH和periLC跟LH相比的一个基本差异是,前两者的神经元活动不会诱导伪摄入行为或改变舔舐频率,而后者通常会。这说明虽然LH环路能通过黑质-上丘-髓质网形成-运动核团的通路来控制摄食的动作执行,PVH和periLC神经元可在食入时发挥更多地调控作用,抑制它们能延长摄食。 其它脑区对进食的控制 大量研究确认了在很多分散的脑区还有其它神经元亚型能调控摄食,包括结节核的抑制性SST神经元,能被可口食物优先激活,并通过到PVH和BNST的信号通路驱动食物摄入;未定带的GABA能神经元,能通过到PVT的投射稳健促进摄食;另外,损伤基底前脑的胆碱能信号通路能通过到下丘脑的通信来促进摄食;温度敏感的MPOA神经元通过到ARCAgRP或PVH的突触连接调节摄食。 总之,研究表明ARCAgRP下游结节作为神经枢纽调控从觅食到摄食的转变。在这些靶标中,激活LH的GABA能神经元促进食物摄入,部分是通过与中脑多巴胺能系统的通信实现的,而谷氨酸能神经元的作用恰好相反,起到对进食的刹车作用。尽管这个系统能可靠地调制进食,但它又是可塑性的,容易被多种适应不良影响,包括暴露于能导致糖尿病的欠营养性而高热量的饮食。另一个能调节摄食的ARCAgRP下游靶标是PVH,它具有异质性,特别是PVHMC4R神经元,它们对食物呈现和摄入表现出多样的反应。PVH和LH相互缠连,组成过剩的大脑核团,协同介导摄食(图2)。编码饥饿和饱足的神经活动再从下丘脑传递到后脑,最终介导餐食的结束。 阶段III 终止进食 饱足感的多模式信号通路 外周和对环境的外感受综合产生内感受信号导致一次进食的结束。餐食终止是指摄食动作相互作用的停止,包括向食物伸手、拿、咬、咀嚼和吞咽。一顿餐食的结束受很多不同但有重叠性的过程影响。首先,当热量需求得到满足后,来自胃肠和血液的信号与下丘脑下行信号在后脑和延髓会合。 饱足感与一系列来自外周的激素信号有关,例如胆囊收缩素(CCK)、GLP1、胰淀素、瘦素、神经紧张素、血清素、胰岛素和肽YY,它们与神经元通信后逐渐引起进食的结束。 其次,消化道的机械受体在进餐时膨胀以容纳食物,当胃容量增加时,食物摄入开始减少,与机械拉伸和营养成分相关的信息会通过迷走神经传递到位于脑干尾部的孤束核(NTS)。 在NTS中,外周感觉信息被整合、处理,传递到迷走神经的背侧运动核,为胃肠道提供副交感运动输入,调制胃和肠的运动、步调、分泌和清空,从而调节餐食终止和营养吸收。 第三,与其它竞争性动机性行为相抗争可能会使动物从进食转向一个新目标,比如交配或领地防守。最后,厌恶性和伤害性感觉信号,例如焦虑、不适、乏力、疼痛、痒和炎症等,都是有效的满足感刺激,能够不管热量需求如何而抑制进食。 PBN在中止食物摄入中的作用 研究表明,PBN作为中央味觉系统和内脏感觉系统的一部分,是抑制进食和味道记忆的神经枢纽(图1)。绝大部分工作集中在位于外侧PBN外层的一群兴奋性神经元亚群上,它们表达降钙素基因相关蛋白(CALCA或CGRP),能广泛地对内脏刺激作出响应,包括恶心、痒和疼痛,且能被增强的厌恶刺激强度所调制(图3和Box 3)。 激活PBNCGRP神经元,包括其中投射到CeA的亚群,无论内在热量需求如何,都能强烈地抑制进食,而抑制它们能消除疼痛、疾病和外源施用厌食激素引起的对进食的抑制。这些效应可能部分是通过源自ARCAgRP、极后区和NTS神经元的输入和到CeA和旁丘脑底核(PSTN)的输出介导的。 一群能被蛋白激酶C-δ(PCKδ)标记的GABA能神经元,会响应厌食类药剂,并必要性地影响进食。刺激CeAPCKδ神经元能中止进食,且独立于抗焦虑效应。应该注意的是,表达降钙素受体(CALCR)的NTS神经元到PBN的投射可促进餐食终止,而不会产生厌恶感,这是独立于PBNCGRP信号通路的另一途径。进一步剖析NTSCALCR神经元发现,其中一群表达催乳素释放激素的亚群能抑制进食、降低体重,而不会引起条件性的味觉厌恶。  图3 饱足感环路的精细调谐对回避厌恶性结果起必要作用。抗糖尿病药物最常见的副作用是内脏不适,包括恶心、呕吐和胃肠问题,这很可能来自于某些细胞类型如PBNCGRP神经元的重叠功能。适度的激活可传递餐食终止或饱足信号,最终引起胃饱了的感觉;但进一步激活会引起很多生理变化,如心跳过速、血管收缩和过度换气,进而引发不适,包括焦虑样行为、疼痛和乏力;更强的刺激可能最终导致更严重的不适、运动障碍和挨饿。因此,理解信息如何在不同大脑节点进行编码会帮助我们在不引起负面效果的条件下,规划治疗过度进食的方案。 上下滑动查看 相比饱足状态,食物剥夺会降低PBNCGRP活动,很可能是通过增加抑制性ARCAgRP神经元活动和BNST输入,以及降低源自NTS中厌食性神经元的兴奋性输入实现的,然而PBNCGRP神经元会随着食物摄入而逐渐变得活跃。相应地,抑制PBNCGRP神经元能增加餐食时长,而不影响总的食物摄入量。另外,一部分PBNCCK神经元会响应瘦素,向PBN注射瘦素可剂量依赖地降低累计的食物摄入和日常的一餐食量,但不会影响进餐数量。有趣的是,绕过胃部会激活PBNCGRP神经元,说明它们可能在手术引起的食欲缺失和体重下降中发挥作用。然而需要注意的是,PBNCGRP神经元是厌恶性的,能模拟条件性味觉厌恶,导致动物回避之前学习到的与神经元活动增加配对的提示信号。该条件性味觉厌恶的强度能被刺激PBNCGRP神经元的频率和时长调控,而且PBNCGRP神经元对于厌恶性味觉记忆的获取和表达是必要性的。 Box 3 感觉饱了但不会太饱 人们普通认识到发烧或感染带来的不适会抑制食欲,这可能是由于编码不适感觉的中央系统区域与控制食欲的区域重叠(图3)。像PBNCGRP这样的节点可被认为是满足感系统的门把手,一个微小的调整就能引起满足感,但拧得太过就会引起内脏不适。这些细胞能对重喂食和饱足感作出响应,也能稳健地被不同来源的威胁激活。而且,激活PBNCGRP神经元能通过终止餐食稳定地抑制摄食,但根据刺激频率或者把手拧得多大,也能引起冻结反应和焦虑样行为,同时伴有心跳加速或副交感响应。通过实时位置偏好试验发现,小鼠会避开与PBNCGRP神经元配对的空间,从而确认了这些神经元所传递的厌恶性状态。因此,饱足和不适之间的光谱能被刺激PBNCGRP神经元的时长和强度调制,急性刺激会减少餐食量,而慢性刺激会导致严重的厌食和挨饿。PBNCGRP神经元可能是大脑中能同时影响食欲和疾病的众多系统之一,因为这两个状态存在固有的错综复杂性。实际上,有效的抗糖尿病药物最共同的副作用就是恶心和其它与胃肠不适相关的症状,包括腹泻、呕吐和便秘。平衡感觉饱了但不会太饱和不适之间的钢丝是发展现代治疗技术来减弱食欲的主要障碍。 小脑对餐食终止的控制 除PBN之外,一个近期的研究发现小脑活动可作为“刹车”减少餐食量和时长,而不影响频率和速率(图1)。小脑深部核团前部(aDCN)的神经元参与进食或肠道营养物灌流。选择性激活aDCN神经元能极大地抑制进食,且与热量需求无关。aDCN诱导的餐食终止的机制是增加纹状体的多巴胺水平,减少随后食物摄入时的位相性多巴胺反应。这些变化可能通过降低进一步摄食的奖赏性来减少餐食量,这与后脑饱足感网络基于内感受状态通过多巴胺信号通路调控对食物的动机类似。这些发现具有可转化性,因为患有基因疾病普拉德-威利综合征(PWS)的病人,具有糖尿病和缺乏饱足感的特征,与健康人群相比,他们在断食中或进食后对食物提示信号的神经元响应失常。而缺失小脑对食物提示信号的响应可能会在PWS病人中导致极端的摄食过量。 因此,不同机制相互作用来排控餐食的终止。饱足感激素与胃肠机械受体一起将热量需求的满足传递到脑干,从而抑制食物摄入。而且,厌恶性和伤害性感觉刺激是进食的有效抑制剂,能在即使热量缺乏的情况下抑制进食。PBN在介导饱足、厌恶、不适和疼痛引起的摄食抑制中发挥主导作用。 越来越多的证据正帮助人们理解下丘脑外的大脑位点如何调控进食行为,这些脑区的失调会导致饮食障碍;然而,食谱和饮食习惯影响脑区功能的机制,以及表型可识别的神经元亚群的作用还远不清楚。人们亟需转化性研究,期望能弄清进食神经回路如何调控食物摄入,如何变得易受适应不良变化的影响。饮食的营养组分和特异营养物质对神经元活动的影响也需要考虑。虽然过去的研究已经描绘了ARCAgRP神经元如何感知不同的大营养分子,但这种程度的详细工作还需要应用到其它细胞类型或大脑节点。 后记 未来如何管理糖尿病 认识到糖尿病是一个慢性疾病,能够帮助去污名化一个相关假设,即认为糖尿病是不够自律的产物。不论生活方式如何,进行何种行为干预,减重是一个被设计成现在这样的一个艰巨的任务。 对过量脂肪堆积相关的生物学机制和病理学的认识,能帮助我们理解为什么针对一个长期的减重目标,我们往往用尽全力而难以长久。改进人类总体健康水平困难重重,使得人们寻求包括药物在内的其它糖尿病治疗方案;而对高效抗糖尿病药物的需求面临来自技术和社会方面的挑战。 上面介绍的工作已经勾勒出监管食欲调节的分子机制和神经环路,能够指引药物开发和治疗干预的方向,从而治疗过度饮食。将我们对食欲稳态的最新理解与新药开发结合,有望能发展出合理的治疗方法,以达到减重超过25%的目标。为实现这一目标,抗糖尿病药物必须能 够综合性影响本综述所讨论的食欲不同位相的作为。如果有手段能同时抑制渴求、饥饿和觅食行为,以及摄食的速率和时长,将会极大地帮助我们对抗糖尿病。我们的身体系统被设计成要维持当前体重,而针对不同过程多管齐下,可以对抗这个系统巨大的冗余量和调节量。虽然单治疗方案可能有益于简化,但药理试剂的组合更有可能满足针对每个位相的需求,从而最终消减热量摄入。基于已有和未来研究进行方案优化,来增强并延长持续性减重,将是科学家和临床医师的共同目标,而且正随着时间和每一个发现而变得越来越实际。  ✦往期精彩回顾✦

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
|
【本文地址】
今日新闻 |
推荐新闻 |