化学杂谈:碳的同素异形体 |
您所在的位置:网站首页 › 碳的同素异形体有哪些 › 化学杂谈:碳的同素异形体 |
化学杂谈:碳的同素异形体
|
前言
碳元素是所有已知元素中化合物种类最多的,目前已知的纯有机化合物就有近 $1000$ 万种,但这还只是理论上存在化合物世界的冰山一角而已。 碳的同素异形体数量也是已知元素中最多的。从家喻户晓的石墨、金刚石到被营销号吹上天的石墨烯,都是这个庞大家族的成员。然而我们所熟知的,同样也不过是这个家族的冰山一角而已。 今天这次杂谈,就让我们去细细探访一下碳的同素异形体。我们会分把碳单质为晶型和无定形两大类,包括那些熟悉的和闻所未闻的,或许就能刷新你对这个元素的认知。 注:如果本文中有任何疏漏或是错误,请务必告知作者(或者打在下面的评论区里),不胜感谢! 晶型碳顾名思义,晶型碳就是那些以晶体形式存在的碳单质。石墨、金刚石、富勒烯等都属于这个大类群。 1.石墨
(图:天然石墨) 石墨是碳已知的 在热力学上最稳定的同素异形体。它实际上是一种 混合型晶体,其结构中同层碳原子间以 $sp2$ 杂化形成共价键,每个碳原子与另外三个碳原子相联,六个碳原子在同一平面上形成正六边形的环,伸展形成片层结构。其层间没有化学键作用,而只有 范德华力 连接:
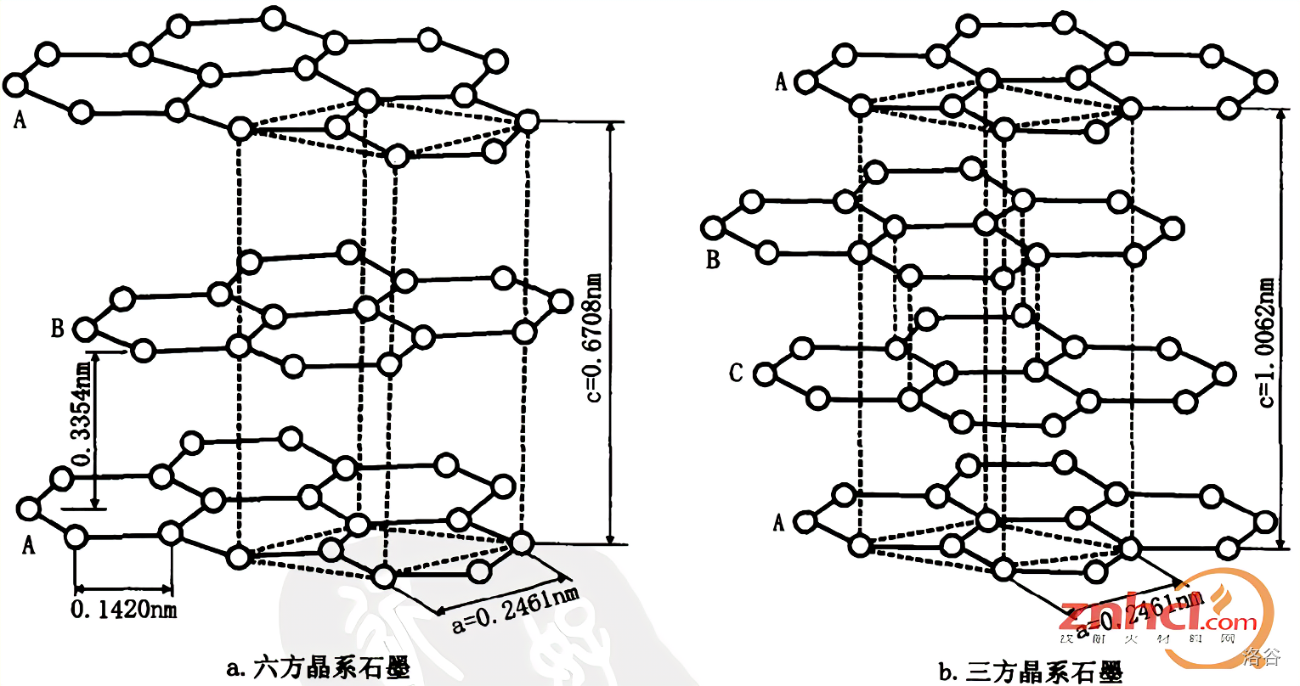
在这种结构中,同一平面的碳原子还各剩下一个 $p$ 轨道,它们互相重叠,形成无限的离域 $π$ 键电子在晶格中能自由移动($\prod_{\infty}^{\infty}$)。这些电子可以自由运动,从而赋予了石墨 层向的导电性。这种结构同样使得石墨有一个特殊的性质,即它可以在层向轻易地被剥离,但在其他方向则牢固无比。 石墨实际上有两种晶体结构,即所谓 三方石墨(即 $3R$ 型,或称为 $\alpha-$ 石墨)与 六方石墨(即 $2H$ 型,或称为 $\beta-$ 石墨):
可以看到,六方石墨的层间以 $ABABABAB\cdots$ 方式堆叠,而三方石墨则是以 $ABCABCABC\cdots$ 方式堆叠。 石墨的化学性质很稳定。在空气中加热石墨实际氧化速度极慢,几乎无法使其燃烧,而只有在纯氧中才行。得益于这种稳定性,石墨在工业上被用作坩埚等耐高温耐腐蚀器皿。在一些环境下,石墨也可以被氧化出其他花样。用氯酸钾和浓硝酸混合溶液处理石墨,可以得到一种 氧化石墨,其仍保留石墨的结构:
石墨甚至还有一定的抵抗氟气的能力,即使在较高的温度下被氟化也会保留碳碳单键。在 $450^{\circ}C$ 下,石墨与 $F_2$ 反应,得到 聚一氟化碳 $(CF)_{x}$,它是一种可以抗大气氧化的润滑剂,结构如下:
目前,工业上使用的大部分石墨都是人工制造的。用石油、焦炭、煤焦油或沥青成形烘干后放在真空电炉里面加热到大约 $3000^{\circ}C$ 左右即可制得。 2.金刚石直到 $1796$ 年英国化学家特南特将金刚石在高温下燃烧得到了二氧化碳后,人们才意识到这个至尊贵物居然与石墨、煤炭是同一个元素的不同形态(当时同素异形体的概念应该还没有成熟)。这个事实已经被现在的我们所熟知,但在当时却是一个令人们难以接受的结论。
金刚石的结构如上图,每个碳原子都与附近的 $4$ 个碳原子成 $\sigma$ 键,组成无限的三维骨架,是典型的原子晶体。这种结构赋予了金刚石硬度大,熔点极高,而且不导电的物理性质。 金刚石 并不是碳稳定的热力学变体。金刚石可以自发转变为石墨,而且反应放热($\Delta_{f}H_{m}^{\ominus}=-1.9~kj/mol$)。但事实上,这种转变极慢,因为 化学动力学 不会允许金刚石秒变石墨的事情发生。 虽然自然界存在金刚石,但储量少且被几个珠宝公司垄断。目前大多数工业钻石都是人工合成的,方法主要有两种:高温高压法($HPHT$) 与 化学气相沉积法($CVD$)。前者已经相当成熟,即在高温高压和 $Co$、$Ni$、$Ni-Cr-Fe$ 等催化剂的作用下将石墨转变成金刚石;后者利用碳氢化合物(如甲烷 $CH_{4}$) 的热分解在催化剂表面上沉积出金刚石,目前正在被越来越多的工厂采用。
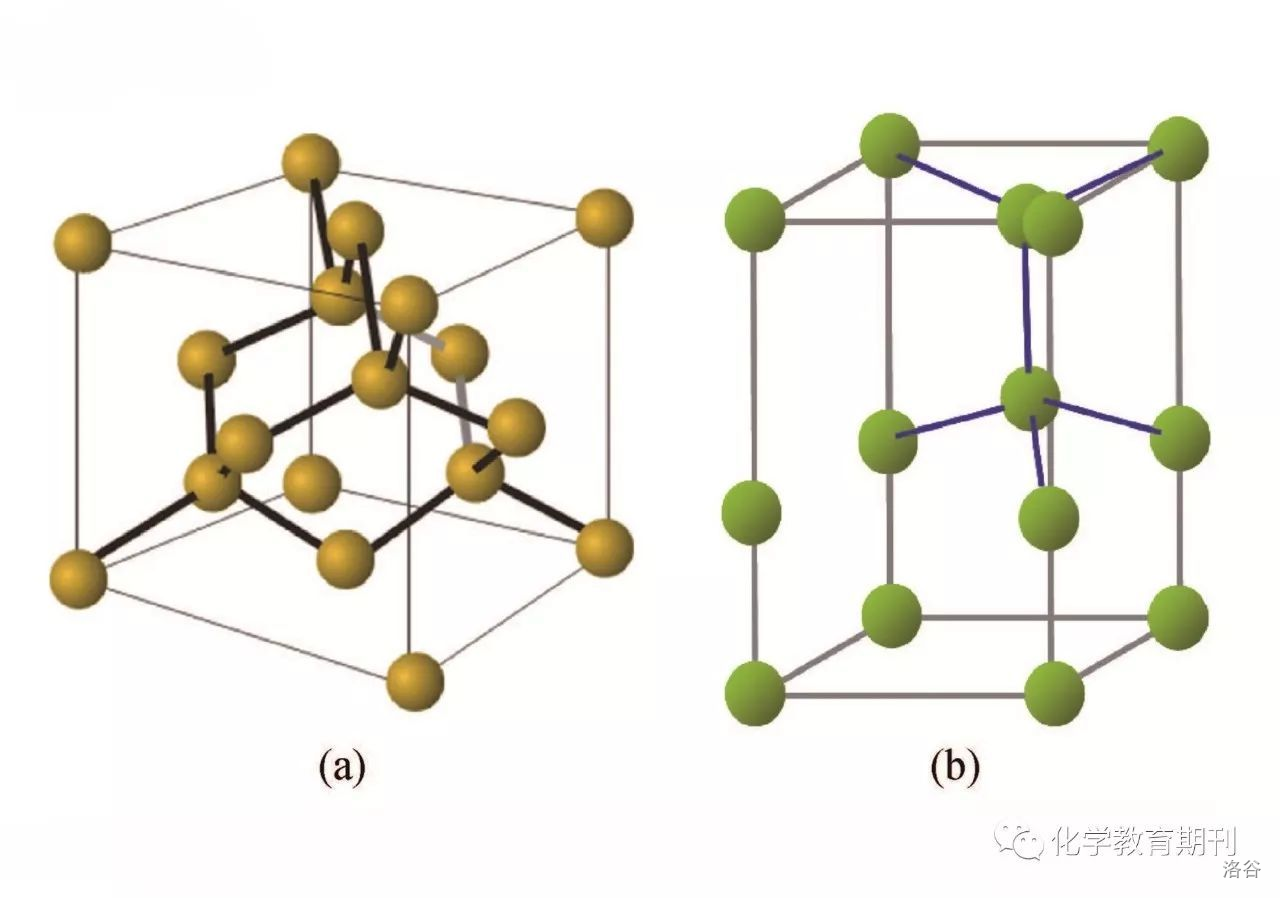
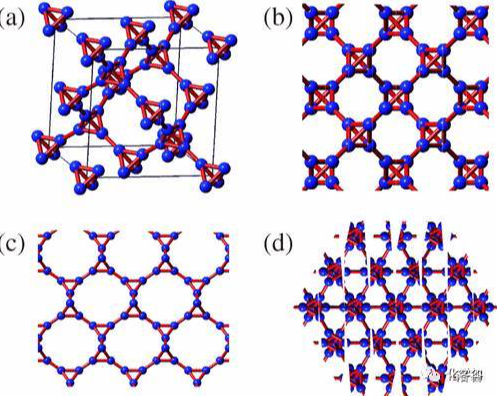
(上图:$CVD$ 法得到的金刚石) 金刚石常温下难以与包括 $F_{2}$ 在内的几乎任何试剂反应,在纯氧中加热到 $1000^{\circ}C$ 左右开始氧化,红热状态下与氧气反应。 3.六方金刚石(朗斯代尔石)传统定义的金刚石都是 立方金刚石,属于 闪锌矿型 晶体结构。但事实上,自然界还存在一种极其罕见的 六方金刚石,即所谓 朗斯代尔石(或名曰蓝丝黛尔石,翻译问题而已)。它同样也是每个 $C$ 原子与周围四个 $C$ 原子形成 $\sigma$ 键,但晶体结构却是 纤锌矿型 晶体结构:
(上图:$a:$ 立方金刚石,$b:$ 六方金刚石) 在立方金刚石中一半的碳原子按照 立方最密堆积 $(ABCA\cdots)$的形式排列,而在六方金刚石中一半的碳原子按照 六方最密堆积 $(ABA\cdots)$ 的形式排列,其余碳原子填入一半的 四面体空隙 中。算上这些填隙原子的话,立方金刚石结构可表示为 $AbBcCaA\cdots$ ,六方金刚石可表示为 $AbBaA\cdots$。 在立体化学上,两者还有一个显著的区别。在立方金刚石中所有的碳碳单键都是 交叉型,而在六方金刚石中碳碳单键既有 交叉型 又有 重叠型。这两种构象的区别如下:
下图中,六方金刚石晶胞内所有用红色勾描的键都是重叠型构象:
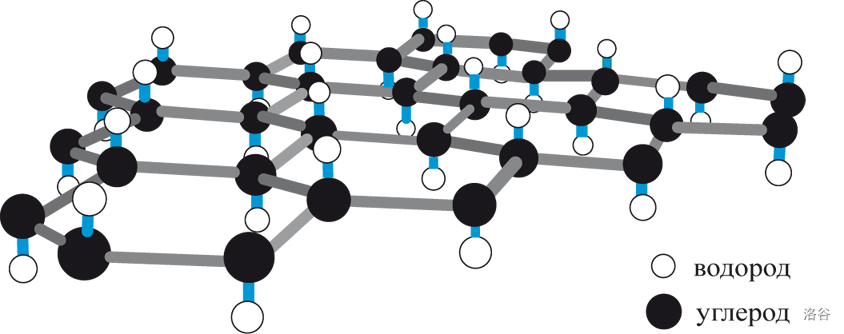
由于重叠型构象中处于同侧的两个 $C-C$ 键会有排斥力,所以它相对于交叉型构象来说是不稳定的。自然地,六方金刚石不如立方金刚石稳定。因此,自然界的六方金刚石大多是天外来客——陨石金刚石(常规地质活动基本够不到其形成条件)。但是人类可以通过化学手段得到六方金刚石,比较常用的一种方法是通过爆炸或静压沿石墨 $C$ 轴加 $13GPa$ 以上的压力及 $1000°C$ 以上温度,可以使其转变成六方金刚石。 物理性质上它基本接近立方金刚石,但脆性更大。 4.石墨烯石墨烯事实上就是单层的石墨,换句话说,石墨烯一层层叠起来就是石墨。厚 $1$ 毫米的石墨大约包含 $300$ 万层石墨烯。正因为此,一些观点认为把它看做碳的新同素异形体并不严谨。
(图:石墨烯的结构) 我们在此不想讨论它那无比出色的物理性质,而把关注点放在更少有人知道的它的化学性质和制备方法上。 最早用于石墨烯制备的方法是 机械剥离法。对,就是你想的那样,简单粗暴地用特殊胶带把将石墨剥离成石墨烯,然后将其粘贴到硅片等基质上用有机溶剂除去胶带。这种方法可以制备微米大小的石墨烯,且操作简单(基本上不手残的人都行),但是其可控性较低,实现大规模合成有一定的困难。不过,最近中国科学家发明了一种简单高效的绿色剥离技术,通过“球-微球”间柔和的滚动转移工艺实现了少层石墨烯的规模化制备。
(图:机械剥离法制备石墨烯) 氧化还原法 是通过将上面提到过的 氧化石墨 粉体进行超声、高温膨胀等操作剥离(具体的比如 Hummer水相超声),制得 氧化石墨烯 后再用还原剂还原得到石墨烯的方法。之所以要绕一圈主要是因为氧化可以增加石墨层间距,破坏其结构,从而大大降低剥离难度。这种方法操作简单,产量高,工业上喜欢用,但是产品质量较低(经常带有缺陷或者因为还原不彻底而带有官能团)。 化学气相沉积法 $(CVD)$ 是使用含碳有机气体(如 $CH_{4}$)为原料在催化剂(如 $Ni$)表面进行气相沉积制得石墨烯薄膜的方法。这是生产石墨烯薄膜最有效的方法之一,制备的石墨烯具有面积大和质量高的特点,但现阶段成本较高,工艺条件还需进一步完善。 其他的方法都比较冷门(也比较邪道),比如 取向外延法 通过将 $C$ 原子渗入金属 $Ru$ 中再使 $C$ 原子在约 $850°C$ 下上浮到 $Ru$ 表面制得石墨烯,碳化硅外延法 则通过超高真空的高温环境使 $SiC$ 中的硅原子升华脱离材料,得到基于 $SiC$ 衬底的石墨烯。 石墨烯的化学性质与石墨大差不差。用发烟的硫酸/硝酸处理之得到 氧化石墨烯(即氧化还原法制备石墨烯的前体),其典型结构如下:
普遍接受的结构模型是在氧化石墨烯单片上随机分布着羟基和环氧基,而在单片的边缘则引入了羧基和羰基,但最近的理论分析表明氧化石墨烯的表面官能团并不是随机分布,而是具有高度的相关性。 石墨烯可以向不饱和烯烃那样被加氢。当加氢完全时得到的饱和碳氢化合物是 石墨烷,其结构如下:
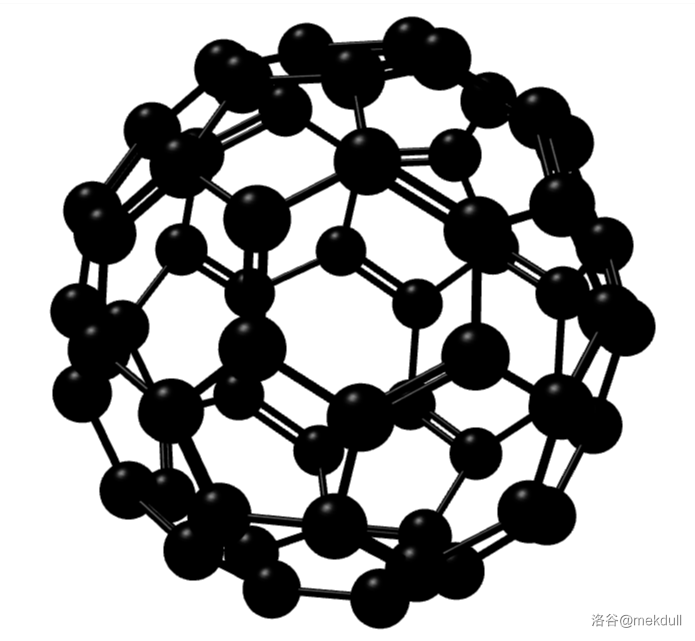
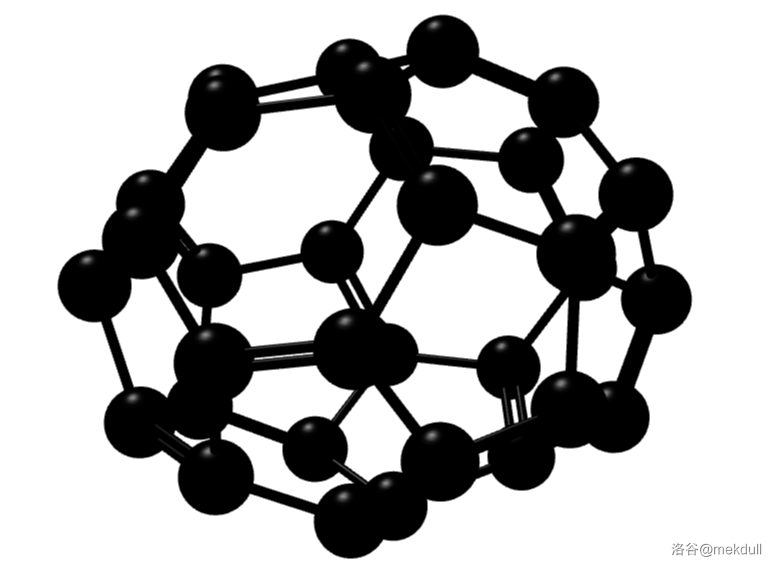
它的结构相当于在不破坏石墨烯独特的六边形晶格结构和单原子厚度的情况下,给每个碳原子上都增加了一个氢原子。若这种加氢不完全,得到的则是 氢化石墨烯。 5.富勒烯富勒烯(有人建议可以用一个汉字“砆”来命名它和它的衍生物,并已经得到了一些权威机构的认可)是一类碳的同素异形体。石墨中碳原子之间形成六元环构成的平面,而若其中的一些六元环被五元环或者是七元环代替,那么这个平面就会出现翻卷和包裹。如果包裹成了封闭的立体结构,那就是所谓的富勒烯($Fullerene$)。 5.1 球碳富勒烯家族中最知名的当属 $C_{60}$,以至于许多人甚至认为富勒烯其实就是指 $C_{60}$。其立体结构如下:
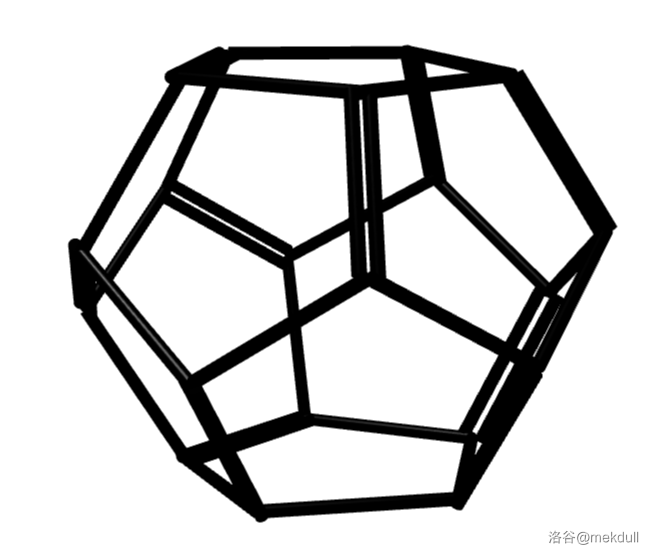
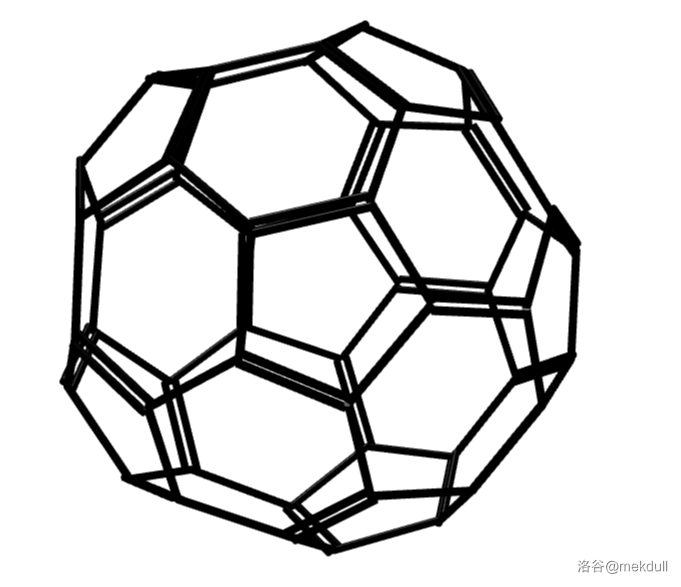
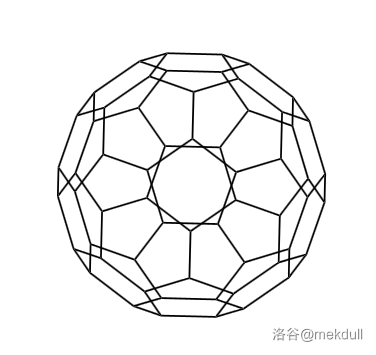
事实上,它只是这个大家族中的一个小家族——球碳(或称为巴克球)家族的一员。目前发现的球碳最小可以到 $C_{20}$,是由五边形构成的正十二面体结构;最大则可以到 $C_{540}$。其中比较有名的有诸如 $C_{20},C_{28},C_{32},C_{44},C_{50},C_{60},C_{70},C_{84},C_{120},C_{180}$ 等等。通过 $3D$ 渲染得到它们中一部分的立体结构如下:
(上图:$C_{20}$ 全棍模型)
(上图:$C_{32}$ 球棍模型)
(上图:$C_{50}$ 全棍模型)
(上图:$C_{70}$ 全棍模型)
(上图:$C_{540}$ 球棍模型,来自百度百科) 制得一提的是,近年来发现形成笼状簇合物好像并不是碳的专利,硅等元素似乎也可以。更有人称成功把 $C_{60}$ 套进了 $Si_{60}$ 里面,得到了组成为 $Si_{60}C_{60}$ 的化合物:
事实上,这个中空的笼子可不止能套自己的同类,诸如金属离子、小分子(如 $CH_{4},H_{2}O_{2}$)都可以收入囊中,这类物质被统称为 内嵌富勒烯。有些内嵌富勒烯具有超导性等优异的属性,令人为之振奋。由于球碳有大量游离电子,所以若把可发生 $β$ 衰变的放射性元素困在其内部,其半衰期甚至可能会因此受到影响。下面是内嵌富勒烯 $Sc_{2}S@C_{86}$ 的结构:
(图例:黄色:硫;银白色:钪;灰色:碳;红色:共用电子对。可以看到 $Sc,S$ 原子都与碳笼有化学键作用) 球碳化合物的制备方法主要是 电弧法 与 燃烧法。电弧法指通过在惰性气体保护下电弧放电气化石墨棒得到球碳的方法,成本高且耗电,一般限于实验室中;燃烧法则是工业方法,通过不完全燃烧某些碳氢化合物可以得到含有球碳的炭黑,随后进行化学分离。 以 $C_{60}$ 为例简单谈一谈球碳的性质。它在室温下是一种灰黑色的粉末(一些文献称紫红色,但个人认为几乎看不出来),有微弱荧光。它可以少量溶于苯等非极性溶剂中形成紫色溶液,这一性质这在碳的同素异形体中绝对算是异类。但事实上,有些富勒烯是不可溶的,比如 $C_{28},C_{36},C_{50},C_{72}$ 等。 球碳的化学性质也已经被人们研究的很多了。和石墨不同,$C_{60}$ 容易发生 周环反应、加氢反应、开孔反应(即打开富勒烯的笼子,然后可以把各种东西塞进去在将笼子还原)、氧化还原反应、加成反应甚至是配位反应。比如在 $NaOH$ 与有机强碱 $TBAH$ 的催化下,$H_{2}O_{2}$ 可以对其加成,得到富勒烯的重要衍生物 富勒醇:
再者,富勒烯加氢可以得到 氢化富勒烯,完全加氢得到的产物被称为 绒毛球烷 $(C_{60}H_{60})$。主流观点认为,这种物质的氢原子有些是在球内。
(上图:$C_{60}H_{60}$ 键线画出来的样子,实际结果应该会发生许多畸变) 在光照的条件下将 $C_{60}$ 与氧气反应生成环氧化物 $C_{60}O_{2}$,其典型的两种结构结构如下。但这种环氧化物不稳定,用矾土分离时能还原成 $C_{60}$。
(图:环氧化物 $C_{60}O_{2}$ 的两种典型结构) 在光照条件下,$C_{60}$ 与亚氨基二乙酸二乙酯等含有活泼 $\alpha-$ 氢的物质反应也可以得到一系列衍生物:
碱金属 $K/Rb/Cs$ 可以与 $C_{60}$ 反应得到离子化合物,比较典型的有 $K_{3}C_{60}$,这种物质由 $K^{+}$ 离子与 $C_{60}^{3-}$ 离子构成。如下图,在晶体结构中,$C_{60}^{3-}$ 离子以 立方密堆积 的方式排列成 面心立方结构,而 $K^{+}$ 离子填入所有八面体和四面体空隙:
这些化学反应极大地丰富了球碳的化学内容,也再次让我们领略到了化学的神奇与巧妙。 5.2 碳纳米洋葱(CNOS)碳纳米洋葱由多层准球形或多面体形状的外壳组成,也就是大球碳套小球碳,小球碳套更小的球碳,就像俄罗斯套娃。理想碳纳米洋葱的结构式为$C_{60}@C_{240}@C_{540}@C_{960}….C_{60n^{2}}$。具体的立体结构类似于这样:
(上图:(应该是扫描隧道显微镜下的)碳纳米洋葱) 它虽然有独特的理化特性,但碳纳米洋葱在发现后一段时间没有受到广泛的关注。这是因为当时连 $C_{60}$ 等球碳都还还尚未发现,使得碳纳米洋葱的发现有些超前。好在,$1992$ 年,乌加特在电子束照射下重新发现了碳纳米洋葱,它这才进入到研究人员的视线当中。 尽管在过去的那么多年里,多种合成方法被用于制备碳纳米洋葱,但目前($2024$ 年初)还未实现大规模的宏量生产。至今已经发现的的合成碳纳米洋葱的方法仍处于初级阶段,并受到产量、品质和纯度等问题的困扰。总之,未来这种物质能否大规模生产并成为一种新材料还是未知数。 5.3 管碳管碳,顾名思义即管状的碳,也是一类富勒烯结构的碳同素异形体。这个家族里为人熟知的是 碳纳米管。在空间结构上,它相当于石墨烯的结构发生卷曲之后形成的管状结构,管的两端则会有五元环或七元环参与封闭。
(上图:碳纳米管管壁,图片来源:百度百科)
(上图:碳纳米管一端,可以看到五元环参与封闭) 根据翻卷的片层数不同,碳纳米管可以分为 单壁碳纳米管($SWNTs$)和 多壁碳纳米管($MWNTs$)两种。上面两幅图中的都是单壁碳纳米管,而多壁碳纳米管大管套小管的理想结构如下:
外观上看,两者都是深黑色的粉末,黑到呈现出黑洞一般深不可测的视觉效果。著名的“世界最黑”颜料——梵塔黑(事实上已经有比这玩意更黑的颜料了)就是用碳纳米管在铝箔片上培育出来的。
(图:科学家展示的梵塔黑颜料,图片来源:百度百科) 由于管内与管间都存在很大的距离,所以这种物质密度极小(应该比石墨烯还要小)。碳纳米管的制备工艺目前还不完善,但已经可以大规模生产。电弧法 是最早用于生产碳纳米管的方法,但目前已经逐渐被我们之前提到过多次的 化学气相沉积法($CVD$)取代。$CVD$ 法制备碳纳米管的原理比较复杂,涉及到 VLS模型 之类的高级理论,所以在此不作深入讨论。 单壁碳纳米管与多壁碳纳米管在化学性质上有较大差异,前者具有相当的惰性,但后者由于性质特殊与工艺限制导致管壁上经常携带大量基团,从而比较活泼。
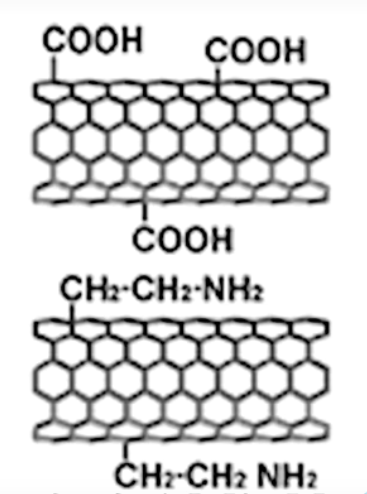
(图:多壁碳纳米管管壁上可能携带的基团) 与上述的各种 纳米碳材料 一样,碳纳米管的各种物理性质都相当不错,但我们在此也不做详细讨论。 除了碳纳米管外,人们还合成了 巨碳管 等管碳家族成员。巨碳管比纳米管孔径更大,且管壁可制备成不同厚度,在运送大小不同的分子方面有潜在价值。 6.乙炔型碳单质乙炔型碳单质,或简称炔碳,是一类碳的同素异形体。这类物质的特征是具有碳碳单键、碳碳三键交替($\cdots C-C\equiv C-C\equiv C-C\cdots$)的结构,也是近些年来碳单质研究的热门领域之一。 6.1 直链乙炔碳(线性碳)直链乙炔碳($LAC$),又名线性碳,是一种结构为 $-(C\equiv C)_{n}-$ 的碳单质。但事实上它不能严格地看成碳单质,因为在这条长链等端基“封口”的不是 $C$ 原子,而是 $H$ 原子或者是其他一价基团,可以看作一个极端不饱和的烃或其衍生物。这条链可以很长,故其实际含碳量高到几乎可以看成单质碳。
(图:直链乙炔碳的结构) 直链乙炔碳中,碳碳键键长并没有完全平均化,因此碳原子间距离并非相等。正是因此,我们认为它是单叁键交替结构,而不是累积双烯结构。 直链乙炔碳具有一个出色的性质,即它的杨氏模量是已知天然最硬材料——钻石的 $40$ 倍,同时也是碳纳米管的两倍,因此可能会成为很好的纳米材料。但无奈的是我们还无法实现它工业级的量产,目前采用的小规模合成可以使用金属卡宾(如 $(^{i}Pr_{2}N)(OLi)C=W(CO){5}$,可以通过六羰基钨与 $LDA$ 反应得到)与草酰溴($C{2}Br_{2}O_{2}$)反应等方法,但都似乎无法大用。有一些报道称,在宇宙空间中有天然的这种物质存在。 端基为 $H$ 的直链乙炔碳比较活泼,但是将端基换成惰性基团比如 $CF_{3}-$ 之类就会大大降低直链乙炔碳的反应活性。 6.2 环乙炔碳将刚才说到的直链乙炔碳首尾相连成环,就是所谓 环乙炔碳 了。相比起前者,环乙炔碳是货真价实的碳单质。最著名的环乙炔碳就是 $2019$ 年合成的18-碳环,其结构如下:
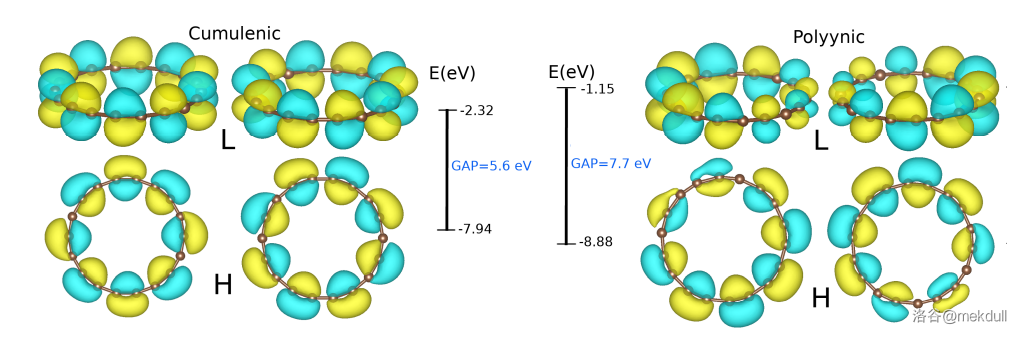
这种物质中,虽然存在电子的高度离域化,但碳碳键并不等长。要解释这个问题需要用到双芳香性、二阶Jahn-Teller效应、前线轨道理论等复杂的理论,在这里至简要地提一嘴:键长交替的结构相比于平均化的结构,其 $HOMO$ 和 $LUMO$ 能量差更大,因此更稳定。详细的可以参见这篇文章。
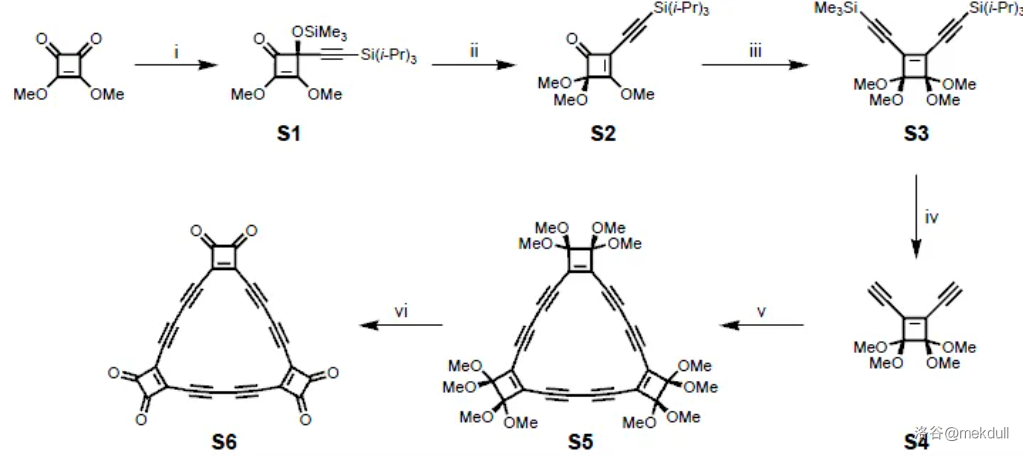
(上图:$C_{18}$ 键长平均化和不平均化两种情况中,$HOMO$ 与 $LUMO$ 的能量差) $C_{18}$ 的制备方法如下,第一步先制得一种碳的氧化物 $C_{24}O_{6}$,然后再让这个氧化物逐步脱去 $CO$,得到 $C_{18}$。
这个合成过程非常有意思,以后我可能会写一篇文章全面分析这个合成的每一个步骤及涉及到的有机反应。 6.3 石墨炔石墨炔 是继富勒烯、碳纳米管、石墨烯之后,一种新的全碳纳米结构材料。它是一种由 $1,3-$ 二炔键将苯环共轭连接形成二维平面网络结构的全碳分子。
(上图:石墨炔的结构,图片来源:百度百科) 这种材料由中科院化学所有机固体院重点实验室李玉良院士团队于 $2010$ 年首次合成,合成方法是将六炔基苯在铜催化下发生的 Glaser偶联反应:
这个反应可以在铜片上沉积一层石墨炔薄膜,也可以适用于大规模制备。
(上图:石墨炔薄膜实物,图片来源:百度百科) 石墨炔在外观上也是深黑色的物质,具有半导体性质。(有人期待这东西的半导体性能可以替代传统的硅半导体,可是我认为希望不大)用他修饰的钙钛矿太阳能电池,能显著提高空穴传输性能,基于这种复合空穴传输层的钙钛矿电池光电转换效率提高了 $20\%$;用它做负极的锂离子电池具有大功率、大电流、长效循环稳定性等特点,超过几乎所有负极材料(这实际上得益于它出色的储锂性能)。它已然成为新材料领域耀眼的明星。 除此之外,人们还制备出了氮杂石墨炔等类似物质,以及石墨炔衍生物,他们中的一些具有更加出色的物理性质,还有一些是非常优异的催化剂,甚至有望替代传统的铂系催化剂成为新的催化之王。
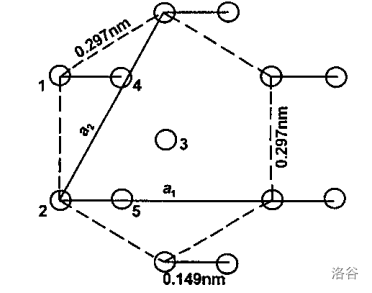
(图:一种石墨炔类似物的合成) 6.4 白碳(紊碳)白碳,顾名思义,一种白色的碳同素异形体,也是炔碳家族的一员。这东西实际上应该是银白色到银灰色带有光泽的,在碳的同素异形体中这个配色也算与众不同了。 $1968$ 年,人们在陨石坑里的石墨片麻岩中观察到了这种物质。它的基本组成结构是单三键交替形成的长链,即 $\cdots -C\equiv C-C\equiv C-C\equiv C-\cdots$,但这些链彼此在空间上交织构成了非常复杂的立体结构,让早期研究它的化学家怀疑人生,于是取了个别名叫做“紊碳”$(chaoite)$,以此抱怨它紊乱的晶体结构。事实上的确如此,它的晶体有多达 $144$ 个原子,还具有双折射、多晶散射等特性。下图是白碳晶胞沿 $(0001)$ 面的六边形结构投影:
碳链 $1$ 和碳链 $2$ 位与六边形的两个角,碳链 $3$ 处于六边形的中心。而碳链 $4$ 与 $5$ 则相对于 $1$ 和 $2$ 有一个向右的偏移,而 $4$ 又大致处于 $2$ 号位与上方顶角碳链的连接线上。证据表明,白碳晶体是双层结构,$4,5$ 和 $1,2$ 所代表的碳链不在同一平面内。 自然界本身有白碳存在,通常在石墨片麻岩中与石墨共生,呈极细的白色条带,与石墨条带平行交织在一起。白碳一般比较常见于陨石撞击区,这可以为它的自然生成提供一些线索:
(图:陨石坑里含白碳的片麻岩,图中黑色条纹为石墨,白色为白碳。图片来源:百度百科) 人工制备白碳的方法主要是电解法。以聚四氟乙烯$(PTFE)$为电解液,活泼金属作为阴极,可以实现 $PTFE$ 脱氟得到白碳。反应表达式如下:
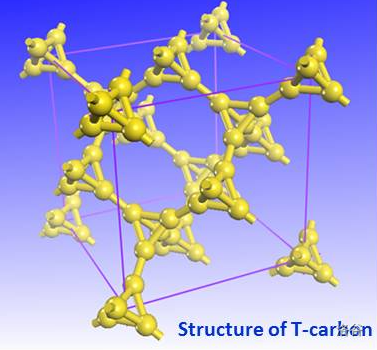
除此之外,化学气相沉积法($CVD$)、电弧法、离子溅射法等都有发展,但总体并不成熟。虽然白碳具有相当优秀的光学性质(因为它复杂的晶体结构)、良好的化学稳定性(空气中 $500^{\circ}C$ 下也难以氧化)、良好的晶体稳定性(晶体能经受 $75eV$ 高能电子束的轰击),但总体来说由于对这一块的研究还比较少,所以也没法确定它在未来会向哪个领域发展,或者是依旧被人冷落。 除此之外,炔碳家族里还有金刚石炔,是一种 $sp-sp^{3}$ 杂化的碳材料,可以理解为在金刚石的结构中插入了一堆 $-C\equiv C-$ 得到。由于资料较少,在这里不做详述。 7.T-碳T-碳同样是最近发展起来的新型碳材料,其结构相当于将立方金刚石结构中每个原子用一个碳的正四面体来替代。这种结构最早由中科大的苏钢教授提出,他们基于密度泛函的第一性原理研究,发现这种结构在几何、能量以及动力学上都是稳定的。目前,这种物质已经得到证实。
(图:$T-$碳的晶体结构)
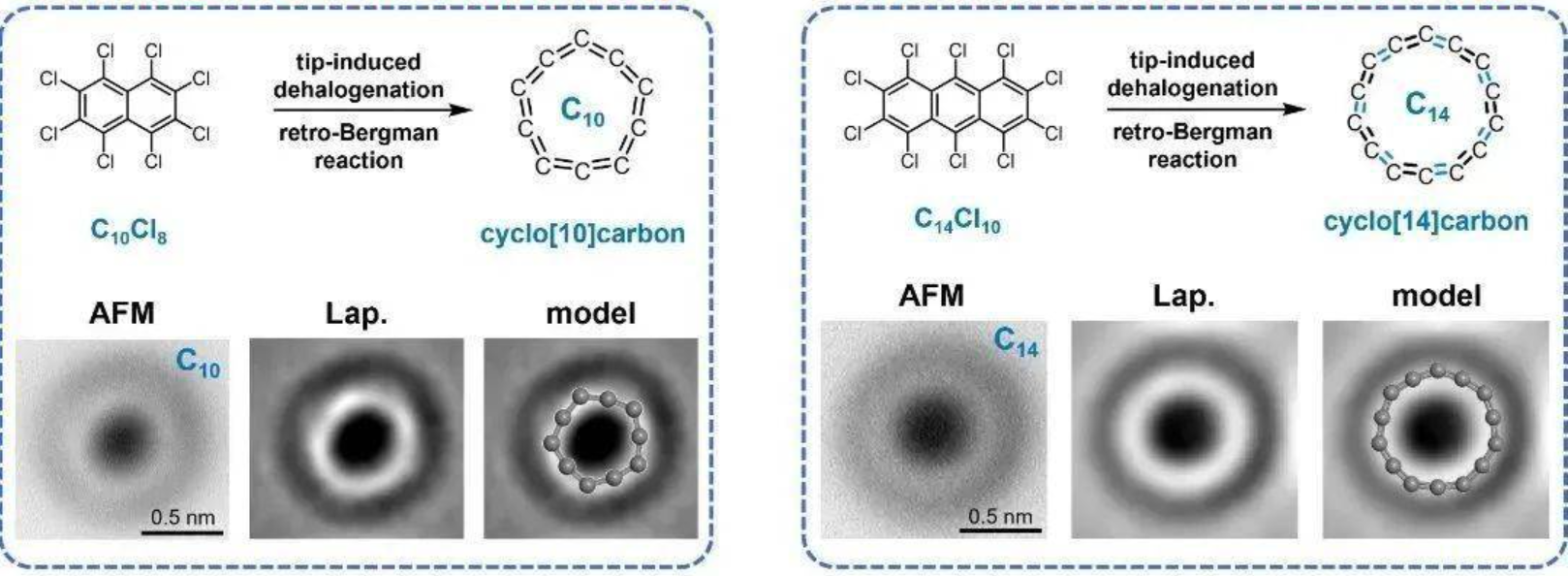
(图:$T-$碳的晶胞) 在 $T-$碳被理论预言六年后,$2017$ 年,西安交大和新加坡南洋理工大学联合研究团队在实验室里完成了这种物质的合成。通过皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管,在极端偏离热力学平衡态的条件下,他们成功实现了从 $sp2$ 到 $sp3$ 原子杂化方式的转变,并得到了 $T-$碳,与理论预测完全一致。但是,这种方法仍然只适用于实验室中的小规模制备研究。 $T-$碳是一个具有直接带隙的半导体,带隙在 $3eV$ 左右,并可通过掺杂来调控带隙大小。$T-$碳同样是一种硬度很大的物质,硬度与立方氮化硼相当而比金刚石略低,但是其密度很低,原子间间隙很大,在光催化、吸附、储能、航空航天材料等领域拥有广泛的潜在应用。但仅从目前来看,由于 $T-$碳的工业级大规模制备还没有实现,若没有突破,那么 $T-$碳的优异性质或许还是只能在实验室中呈现。 8.累积双烯型碳累计双烯型碳单质的存在在过去一直是理论预测,直到最近同济大学的许维教授团队得到了环状的 $C_{10}$ 和 $C_{14}$,并证明了它们是累积双烯结构才得以证明。 $C_{10}$ 与 $C_{14}$ 分子都符合休克尔规则,因此具有芳香性。分子中所有碳碳键都等长,形状也为正十边形与正十四边形:
(图:正十边形的 $C_{10}$ 分子)
(图:正十四边形的 $C_{14}$ 分子) 为了得到这两种物质,科学家采用了分子操纵术。使用全氯化萘 $(C_{10}Cl_{8})$ 与全氯化蒽 $(C_{14}Cl_{10})$ 作为前体,在低温氯化钠薄膜上使用 $STM$ 针尖进行原子操纵,诱导其脱去所以卤原子并发生反伯格曼环化得到产物:
此前有理论预测,$C_{10}$ 是环型碳结构和线型碳结构的分界点,同时也是最大的芳香性累积烯烃型环型碳。$C_{14}$ 则被预测是介于累积烯烃型 $C_{10}$ 到聚炔型 $C_{18}$ 中间的佩尔斯相变过渡态。理论计算确实说明 $C_{14}$ 应存在一个非常小的键长交替,但在实验上无法分辨出来。 显然,这项研究工作极大推动了环型碳领域的发展,提出的合成策略也有望成为一种合成系列环型碳的普适性方法。虽然 $C_{10}$ 和 $C_{14}$ 有可能在未来用于新型半导体材料与分子电子器件,但目前受制于合成方法,我们无法大量得到这两种物质作为新材料。$C_{10}$ 和 $C_{14}$ 的发展道路前景广阔,但也扑朔迷离。 无定形碳无定形碳,或称为非晶型碳,是一个分类混乱的大类群。这个大类的碳单质不是晶体,自然没有规整的晶体结构。他们中的大部分可以简单但并不精确地理解为石墨那种 $sp2$ 杂化的平面结构和金刚石那种 $sp3$ 杂化的四面体结构的组合体,所以大多数无定形碳的物理性质也介于石墨和金刚石之间。 9. 煤
(上图:煤实物,图片来源:百度百科) 煤,作为地壳中最著名最常见的无定形碳矿物,是远古植物保存在一定条件下(缺氧、温度不太高、具有一定湿度等)的地层中经过漫长复杂的化学反应形成的。煤主要由碳、氢、氧、氮、硫和磷等元素组成,其中主要的成分是碳单质,但也包含有大量的有机化合物(比如挥发性碳氢化合物等)。 煤自古以来就被当做燃料使用,是重要的化石能源。煤根据品质可以分为褐煤、烟煤、无烟煤、泥煤等,在这里不展开讨论。但值得我们注意的是,其中的烟煤还可以分为炼焦煤和非炼焦煤,前者可以通过干馏得到焦炉煤气(主要成分有 $H_{2}$ 约 $55\%-60\%,CH_{4}$ 约 $23\%-27\%,CO$ 和一些 $C_{2}$ 以上的不饱和烃)和煤焦油(各种高芳香度的碳氢化合物的复杂混合物),这个过程在工业上一般称为“炼焦”。
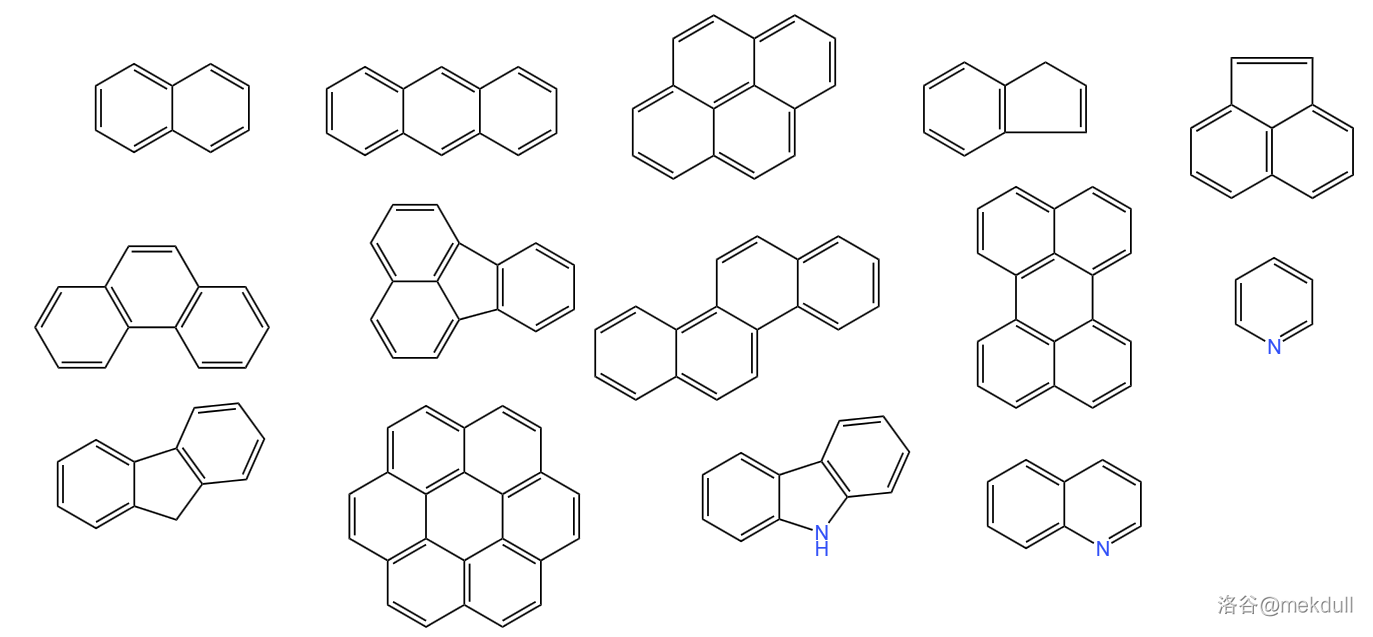
(上图:煤焦油实物,图片来源:百度百科) 高温煤焦油含有一万多种化合物,包括各种烃、酚、吡啶、喹啉、咔唑类物质,还有各种稠环芳烃比如萘、蒽、芘、䓛、蒄、苝、菲、荧蒽、苊、芴、茚、等,分离十分困难。
(图:煤焦油中含有的部分稠环芳烃和稠杂环化合物) 这些物质都是有机化工重要的原料,至于具体的分离工艺可以查阅相关文献,在此就不讨论了。近年来,如何更好地综合利用煤炭资源成为了化工界热门的课题。由于我国是世界上煤炭产量最大的国家,这项研究对我们来说可谓相当重要,也希望我国化工界可以最终解决这一难题。 10.焦炭焦炭是炼焦反应留下的固体产物,也是一种在工业上相当重要的无定形碳。焦炭中的碳含量很高($\geq85\%$),其余成分还包括所谓灰分(来自于煤中含有的矿物质,主要成分是一些无机盐和氧化物,含量约 $13\%$)、很少的挥发性化合物和硫等。
(上图:焦炭实物) 焦炭中,碳原子主要取 $sp3$ 杂化,通过 $C-C$ 单键结合为三维网状结构,但和金刚石不同的是其排列方式基本无序。这决定了焦炭多孔且坚硬的性质,同时具有良好的透气性和一定的机械强度。这些属性的叠加使得它非常适合钢铁的冶炼,其中的具体原理比较复杂,主要是焦炭的强韧结构可以组织反应物粘合,并进行更好的渗碳作用以形成铁碳合金。 除此之外,焦炭也被用于水煤气(水蒸气通过炽热的焦炭而生成的气体,主要成分为 $CO,H_2$)和电石($CaC_2$)的生产,在此不作详述。 11.木炭与活性炭木炭是木材或木质原料经过不完全燃烧,或者在隔绝空气的条件下热解,所残留的深褐色或黑色多孔固体燃料。
(上图:$Minecraft$(一款游戏)中木炭的生产,是在熔炉里烧炼树木原木)
(上图:现实中的木炭(工业级),图片来源:百度百科) 木炭是一种保持木材原来构造和孔内残留焦油的不纯的无定形碳,主要杂质为植物中存在的一些矿物质。在干馏过程中,木炭形成多孔结构,具有很高的比表面积。木炭的还原能力大于焦炭,作为传统的金属冶炼还原剂,它在冶金工业上仍然具有较高的地位。 除此之外,木炭还被用于二硫化碳($CS_2$)等化学物质的生产。另一个同样重要的应用是制备活性炭,一种工业和日常生活中都十分重要的吸附剂。
(上图:活性炭实物,图片来源:百度百科) 由木炭制得活性炭的过程称为活化,但这个概念与化学反应原理中提到的分子活化没有任何关系。工业上,这一过程大多是在高温下用水蒸气等气体处理木炭,带走其中杂质的同时使其表面被侵蚀,产生发达的微孔结构,进一步增强其比表面积。在防毒面具中,就时常填充有活性炭;在糖的工业生产中,活性炭被用于蔗糖的脱色处理;等等。 12.骨炭骨炭是由粉碎的骨头经过高温碳化得到的。虽然也被归入无定形碳的类群,但事实上其中的碳含量很低,只有 $7\%-11\%$ 左右。骨炭中的大部分物质其实是以磷酸钙 $(Ca_{3}(PO_{4})_{2})$ 为代表的无机盐,占到 $80\%$ 左右,这也赋予了骨炭白色的外观,与其他无定形碳格格不入。
(上图:骨炭实物) 骨炭的主要应用也和其他无定形碳不在一个领域。它主要被用作土壤改良剂、土壤重金属污染修复剂和污水处理剂等,可以通过多种非常复杂的机制去除重金属并修复土壤。具体原理就不展开谈论了,但其中最简明的一条是由于骨炭是富含磷的物质,可以和某些重金属元素形成极难溶于水的沉淀,从而降低土壤重金属的移动性和生物有效性。 除此之外,骨炭还被用于陶瓷工业生产高档骨制瓷器,也可以用作颜料稳定剂、磨光剂、糖浆澄清剂等,甚至可以用作肥料(应该是一种磷肥)和动物饲料。 13.炭黑炭黑主要是由烃类物质不完全燃烧得到的。在空气中点燃苯、乙炔之类含碳量很高的有机化合物,产生的黑烟的主要成分就是炭黑。
(上图:炭黑实物) 炭黑的结构是层形的石墨分子,但其特殊性在于分子直径很小,只有 $2nm-30nm$。这使得它的颗粒细小且颜色很深,容易分散在溶剂中形成稳定的分散液,而这一特性是许多其他碳单质不具备的。
(上图:炭黑的形成和生长过程) 炭黑的特殊性质使得它被广泛用于墨水中,由于碳的化学稳定性,这样的墨水书写或打印出的字迹可以长久保存而不褪色,从古至今都是墨水中的绝对主流。 14.多孔碳木炭、活性炭、焦炭等都拥有发达的孔隙结构,这种结构也给了人们启发。近年来,随着纳米化学的发展,一类可以人为控制孔隙大小的新型多孔碳材料得以兴起,也就是我们所说的多孔碳。
(上图:一种多孔碳的实物)
(上图:一种多孔碳的 $3D$ 微观结构,可以看到其发达的孔隙结构) 多孔碳根据孔隙尺寸大小可以分为三类:微孔碳(孔径小于 $2nm$)、介孔碳(孔径在 $2nm-50nm$ 之间)、大孔碳(孔径大于 $50nm$)。制备多孔碳一般采用的是模板法,以多孔碳材料的代表,有序介孔碳 $CMK-3$(孔径 $3.9nm$)为例,用蔗糖作为反应前驱体,与少量 $H_{2}SO_{4}$ 混合后注入模板——介孔二氧化硅 $SBA-15$ 中,在 $N_{2}$ 保护下高温碳化,最后再用 $HF$ 或浓热 $NaOH$ 除去二氧化硅模板,得到 $CMK-3$。
(上图:有序介孔碳 $CMK-3$ 的微观图像,可以看到整齐排列的孔道)
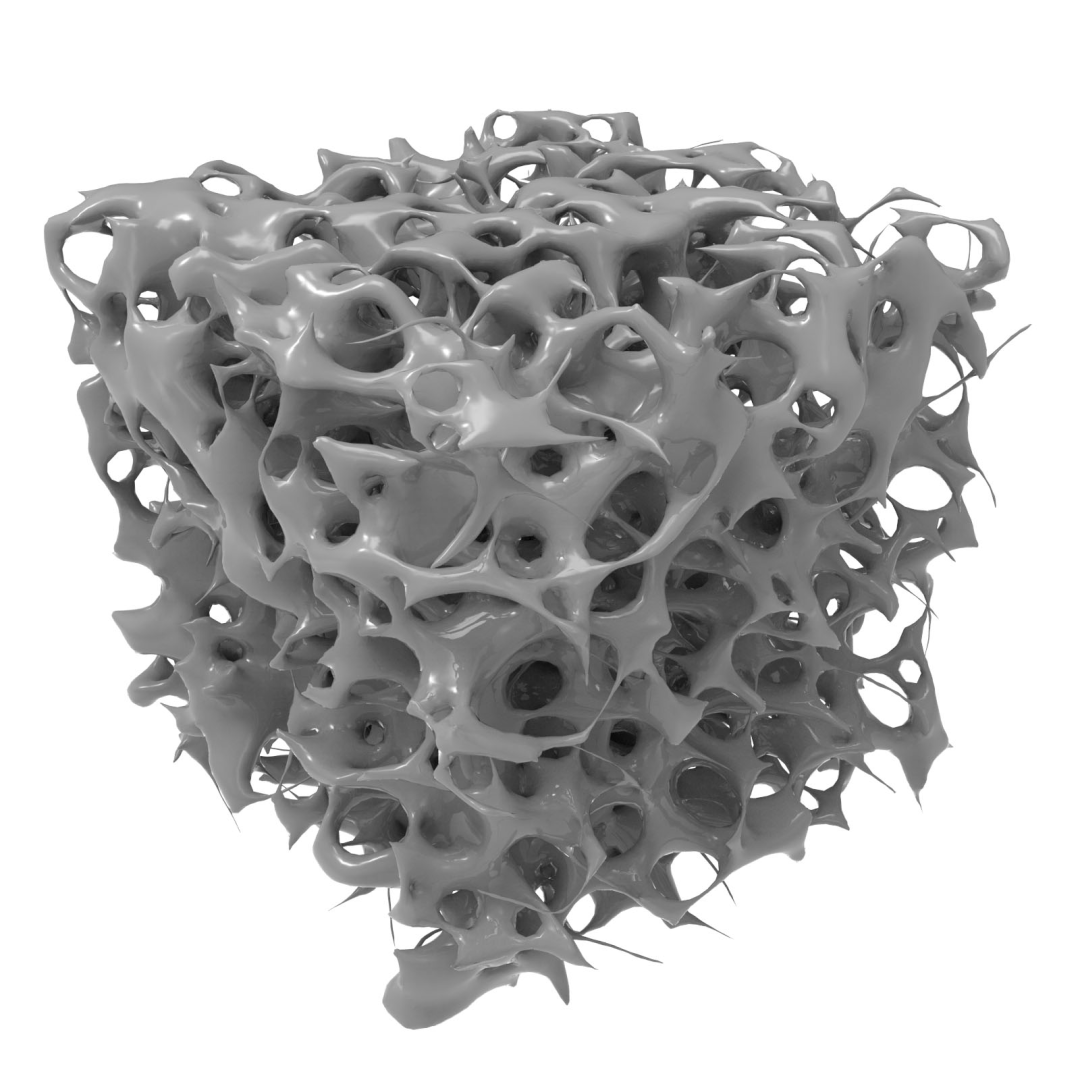
(上图:分子筛材料,$CMK-13$ 的制备模板,介孔二氧化硅 $SBA-15$ 的微观图像) 有一个小问题:无序的多孔碳材料是无定形碳没有问题,但像 $CMK-3$ 这样的有序的多孔碳是不是可以算做是晶型碳?在本文中姑且不作区分,把所有多孔碳都放在无定形碳里。 多孔碳材料具有高的比表面积、优异的导电性、物理和化学稳定性、气液渗透性,且廉价易得,在能源存储和转换、催化、吸附分离等领域展现出了巨大的应用前景,大有和以沸石为代表的多孔硅酸盐类材料一较高下的势头。目前多孔碳已经在大规模工业化生产,并得到了许多实际应用。 15.全碳气凝胶(碳海绵)如果你是一名中学生,或许会做到这样一道题,题目背景是在 $2013$ 年 $3$ 月,浙江大学的科学家们研制出了一种超轻材料,被称为“全碳气凝胶”,或名曰“碳海绵”。题目中还放了这样一张图,是这种材料被放置在花蕊上,但柔弱的花蕊却没有发生肉眼可见的形变,给人以强烈的视觉冲击。
(上图:全碳气凝胶被放置在花蕊上) 这种材料在当时打破了世界最轻物质的记录(不知道现在有没有又被什么东西打破),密度仅有 $0.16mg/cm^3$,或者说 $0.16g/m^3$,用到的密度单位都和普通物质不一样。它的密度低于氦气($He$)的密度,只有空气密度的 $1/6$,但却是一种固体!这让当时仍然处于化学入门阶段的我产生了强烈的震撼。 事实上,这种东西也没有那么神秘。它是一种无定形碳,也是气凝胶家族的一员。气凝胶,外号“凝固的烟”,最初是在 $1931$ 年,美国化学家 $Kistler$ 为了和他的朋友打赌而发明的,目前已经得到广泛应用。碳海绵是这个家族里面的佼佼者,是一种具有极轻、高弹(被压缩 $80\%$ 后仍可恢复原状)、超强吸附性(可吸收最多为自身重量 $900$ 倍的油,且速度极快)的物质,也是当年材料学最振奋人心的发展之一。 全碳气凝胶的制备比较昂贵,但它不需要模板,很容易大规模制备。方法是将含有石墨烯和碳纳米管的水溶液在低温环境下冻干,而后去除水分、保留骨架得到,被称为“冻干法”。
(图:实验室用冻干法制备的碳海绵成品) 作为一种新型的纳米材料,全碳气凝胶的应用前景十分广阔。不仅可以用来处理海上原油泄漏事件、做催化剂载体,还可能成为储能保温材料等,有着无限的可能性。 16.碳纤维碳纤维,一种人造的纤维状无定形碳单质,相信很多人都在营销号、科普视频中或是在商家的宣传中听到过这个材料的大名。
(上图:编制成形的碳纤维实物) 碳纤维大多是对有机高聚物进行高温碳化得到的。例如,一种比较常用的工艺是现将丙烯腈($CH2=CHCN$)聚合,得到聚丙烯腈($-(CH_{2}-CHCN)-_{n}$);随后在空气中 $200-300^{\circ}C$ 前处理,促使其支链化;最后再 $1300^{\circ}C$ 的氮气保护下碳化,脱去其他元素得到碳纤维。如果将碳纤维再在 $2600-3000^{\circ}C$ 氩气气氛下处理,可以得到所谓石墨纤维。目前,用沥青得到碳纤维的工艺也已成熟。
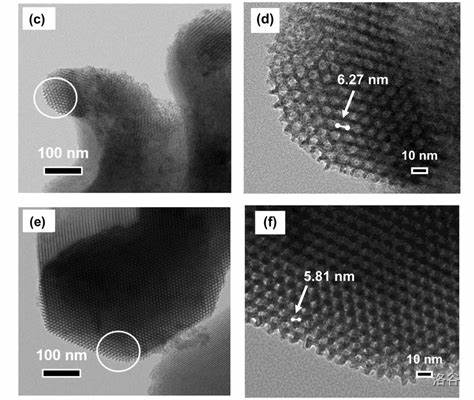
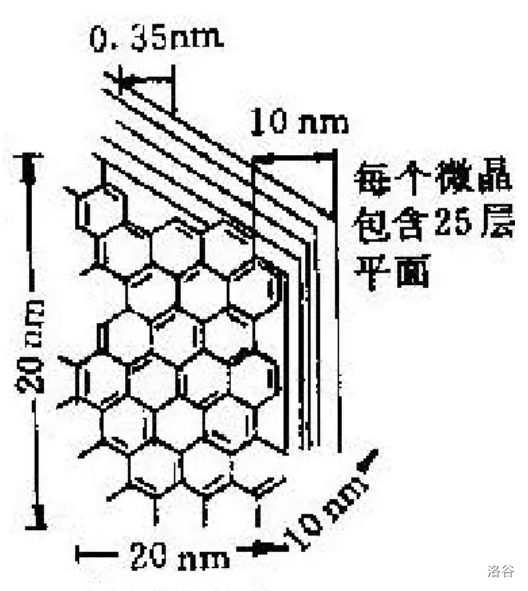
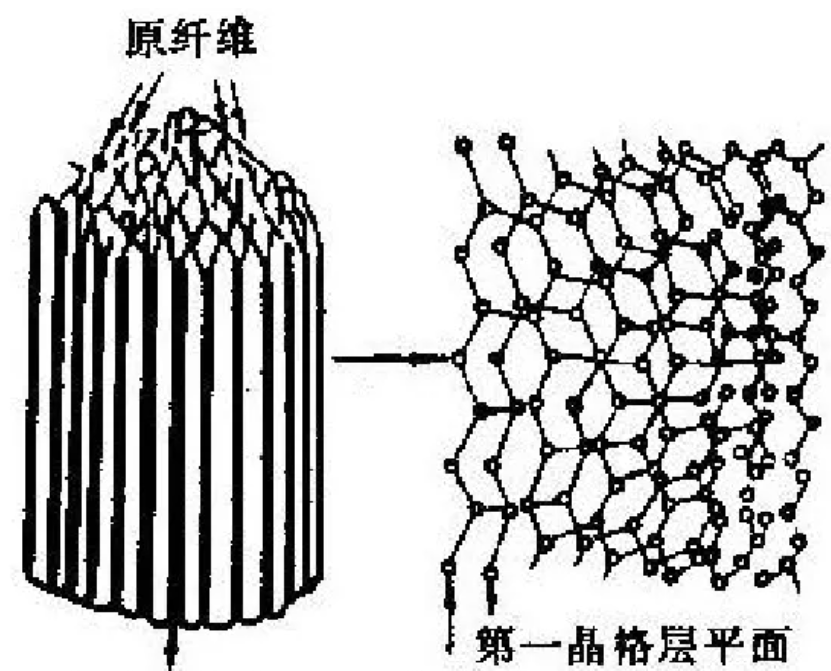
(上图:沥青,碳氢化合物及其非金属衍生物组成的黑褐色复杂混合物,可作为碳纤维原料) 碳纤维中碳含量可以高达 $90\%$ 以上,其耐高温居所有化纤之首。除此之外,它还有抗摩擦、导热及耐腐蚀等特性。单根碳纤维直径只有 $5\mu m$,因此需要编织成碳纤维布后才能使用。 碳纤维的结构目前一般认为是由沿纤维轴高度取向的二维乱层石墨。具体来说,其一级结构是有缺陷的石墨,二级结构是这些有缺陷的石墨片层堆叠起来得到的微晶,三级结构则是这些微晶构成的细小纤维堆叠、弯曲形成的复杂三维立体结构。
(上图:碳纤维的二级结构,片层堆叠形成微晶)
(上图:碳纤维的三级结构,纤维簇拥或交联形成立体结构) 在航空航天等领域,碳纤维由于其性能优异,已经得到广泛的应用;但在生活中,其高昂的价格制约了其应用,目前只能用于高档鱼竿、高档汽车外壳、高档自行车,以及医疗上的植入部件(用来代替韧带、肌腱等)等。但随着其生产工艺的不断改进,它的价格被打下来应该只是时间问题。 17.玻璃碳相比于碳纤维,玻璃碳($glass\text{-}like~carbon$)或许并没有那么知名,但它同样是一种应用广泛的新型碳材料。外观上,它是一种表面具有玻璃光泽的坚硬固体,因此经常被误认为是某种金属,但事实上它也是一种无定形碳。
(上图:玻璃碳片实物,可能是用来做电极的) 玻璃碳中的碳原子基本全部采用 $sp2$ 杂化,其一级结构是层状的石墨烯;这些石墨烯错位或重叠排列,堆叠 $5-14$ 层形成二级结构;在此基础上,堆叠的多层石墨烯通过连接、扭曲、分层、折叠甚至是断裂形成复杂的三维立体结构,也是玻璃碳的三级结构。结构示意如下图:
(上图:玻璃碳的结构,图中每一层像纸带一样的都是单层石墨烯) 这样的结构赋予了玻璃碳与陶瓷类似的硬度、与玻璃类似的光泽、良好的导电性、很小的热膨胀系数、高强度、高的孔隙率,但却不透水也不透气。这同样也决定了它极端的化学惰性(主要体现在它比石墨更耐氧化、更耐氧化性强酸(如浓热 $H_{2}SO_{4},HNO_{3}$)的腐蚀)且几乎不会吸附、污染,是制造电极、坩埚、打字机的写字轮、唱片等的最理想材料之一。
(上图:用玻璃碳材料制成的坩埚) 唯一的问题是,玻璃碳目前的价格依然比较昂贵。目前大规模制备玻璃碳的工艺一般是将一些富碳的有机高聚物受热降解,比如在 $1000^{\circ}C$ 以上处理酚醛树脂或糠醇树脂,即可得到玻璃碳。
(上图:直链酚醛树脂和直链糠醇树脂的结构,这两种高聚物是生产玻璃碳的原料) 目前,玻璃碳已经凭借其优异的性能得到广泛应用。相信未来,随着工艺改进,玻璃碳的成本将会变得更低,最终走进千家万户。 结语非常感谢你可以看到这里!这篇文章非常的长,总字符数超过了 $2$ 万,但也只是对文中的每一种碳单质进行了简单介绍。毕竟碳元素以一己之力建立了有机化学这门学科,$2$ 万字的篇幅恐怕连浮光掠影地扫过碳宏大世界的冰山一角也算不上。 但这也正告诉我们,化学的世界是多么无穷无尽,多么精彩纷呈。 回首历史,碳元素总是能在人类需要时给予惊喜,或是在前路迷惘时带领我们前进。千万年前,木炭便成为了人类最早的燃料之一,它燃起的火焰伴随着我们走过了文明的漫漫长夜;几千年前,碳在高温的炉中夺去与金属连接的氧,使其化作铁水流出;同样在千年以前,炭黑被制成了墨水,从此流淌在纸上,流淌在文人墨客的心中,记录着人类的历史;一百多年前,焦炭代替了木炭,被扔进了冶炼炉中,为现代高炉的大型化和炼钢技术的真正成熟奠定基础;而在现代,各种新型碳材料层出不穷,在各种领域为人类的发展添上点睛之笔。 这,就是碳。外观上毫不起眼,内里却又有太多的故事。 |
【本文地址】
今日新闻 |
推荐新闻 |