病毒包装实验(二) |
您所在的位置:网站首页 › 病毒颗粒浓度单位 › 病毒包装实验(二) |
病毒包装实验(二)
|
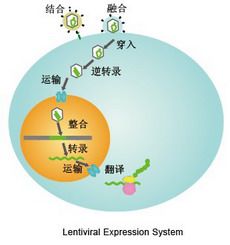
在上述程序中提及的“第四天”收集病毒。在第五天再用该病毒感染靶细胞,病毒进入细胞后,其遗传物质RNA反转录出DNA,该基因再整合到靶细胞的基因组中,完成转染过程,因为质粒DNA只能转录出病毒RNA和表达目的基因却不能表达出病毒的外壳和膜蛋白成分,因此其不能像普通的病毒一样在宿主细胞能反复增殖,故对宿主细胞是无害的并且高效的将目的基因转染到靶细胞基因组中。 慢病毒感染细胞
荧光显微镜的操作流程 打开荧光器(30min内不能关闭,否则影响显微镜寿命),细胞培养板置于载物台,调节物镜和光圈,先用自然光观察视野内细胞,再关闭光,开启荧光通道,观察荧光强度,判定感染率。图片取样前可以调节曝光时间,增益值和彩色度使荧光照片最完美。 注意事项内容 : 1)病毒浓度要适宜,太少的话细胞被感染的也少,但是病毒浓度太大,对细胞有伤害。 2)感染病毒时培养基量少,以保证病毒的浓度,在培养10h左右可根据培养基颜色加培养基。 3)在不明确细胞感染复数情况下,可进行浓度梯度感染,计算细胞感染复数。 4)在加病毒后一般24h左右可换液,48小时即可看荧光,具体时间根据细胞状态来看。 感染后细胞检测方法 荧光初步检测 若有荧光,则表示病毒感染成功,但并不能确定目的基因是否整合到细胞中,待进一步检测,荧光有强弱之分,与病毒加入的量有关。 RNA的提取及RT-PCR检测 原理:因为真核细胞DNA含有很多非编码区,真核生物的DNA转录成为RNA之后,经过剪切和拼接,去掉这些非编码区,才能形成真正的mRNA,,是否表达真核生物的基因并表达相应的蛋白,只能通过提取其mRNA并RT-PCR这条途径来测定。 RNA提取步骤 1)加1mlTrizol,吹打后移至1.5ml无菌的离心管中。 2)加100ul氯仿剧烈振荡30s混匀,12000转15min,可看到明显分层。 3)取上层透明液体至新的1.5ml离心管中,加等体积的异丙醇,混匀静置10min,12000转离心10min,弃上清。 4)加1ml70%乙醇,12000转,离心10min,弃上清,风干剩余液体,最后加DEPC-水溶解RNA,电泳,初步判定RNA纯度。 RT-PCR步骤 RT是一个逆转录的过程,用前一天提取好的总RNA,在加入引物,模版和酶,并在PCR仪的温度设置下,RNA可逆转录为cDNA。PCR是cDNA在模版,引物,酶的作用下进行复制成双链DNA。 蛋白提取及Western检测 western-Bloting:蛋白免疫印迹(Western blotting 或 Immunoblotting)一般由凝胶电泳、样品的印迹和免疫学检测三个部分组成。第一步是做SDS聚丙烯酰胺凝胶电泳,使待测样品中的蛋白质按分子量大小在凝胶中分成带。 第二步把凝胶中已分成条带的蛋白质转移到一种固相支持物上, 用得最多的材料是硝酸纤维素膜(NC 膜)和 PVDF 膜, 蛋白转移的方法多用电泳转移 (转移电泳) ,它又有半干法和湿法之分,现在大多用湿法。第三步是用特异性的抗体检测出已经印迹在膜上的所要研究的相应抗原。免疫检测的方法可以是直接的和间接的。现在多用间接免疫酶标的方法,在用特异性的第一抗体杂交结合后,再用酶标的第二抗体(碱性磷酸酶(AP)或辣根过氧化物酶(HRP)标记的抗第一抗体的抗体)杂交结合,再加酶的底物显色或者通过膜上的颜色或 X 光底片上暴光的条带来显示抗原的存在。该技术被广泛应用于蛋白表达水平的检测中。 病毒滴度的测定 稀释计数法: 滴度单位:TU/ml,指每毫升中含有的具有生物活性的病毒颗粒数。”TU”为”transducing units”的缩写,中文为“转导单位”,表示可以感染并进入到靶细胞中的病毒基因组数。 第一天 细胞准备 将生长状态良好的293T细胞消化计数后稀释至1×105/ml,加入96孔板,100µl/孔,为每个病毒准备10个孔。放入37℃,5%CO2培养箱中培养。 第二天 加病毒 在EP管中做10倍梯度稀释,连续10个稀释度。稀释方法如下:每种病毒准备10个1.5ml EP管,每管加入90µl培养液,往第一个管中加入10µl病毒原液,混匀后,吸取10µl加入第二个管混匀。依此类推,做十个稀释度(10~10-8)。吸取96孔板中原有的培养基,加入含稀释好的病毒液。并做好标记。 第三天 追加培养液 在每个孔再加入100µl完全培养液,利于细胞的生长。 第五天 观察结果并计算滴度 在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。假设为X和Y,则滴度(TU/ml)=(X+Y×10)×1000/2/X孔的病毒液的含量(µl )。 定量PCR法: 病毒感染1天前,取6孔板接种HOS细胞。每孔细胞为5×104个。接种细胞24小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N。 弃去其他培养板中的培养基,更换为含有5μg/ml polybrene的新鲜培养基。将浓缩病毒用培养基稀释200倍,也就是取1μl病毒加入到199μl的培养基中。在3个培养孔中分别加入0.5μl,5μl和50μl的稀释病毒。感染开始后20小时,除去培养上清,换为500μl含DNaseI 的新鲜培养基。在37℃消化15分钟,这一步是要除去残余的质粒DNA。然后换为2ml正常的培养基,继续培养48小时。 用0.5ml 0.25%胰酶-EDTA溶液消化细胞,在37℃放置1分钟。用培养基吹洗下,离心收集细胞。按照DNeasy试剂盒的说明抽提基因组DNA。每个样品管中加入200μl洗脱液洗下DNA。用DNA定量试剂盒定量(Bio-Rad)。基因组DNA可以稳定保存在-20℃至少2个月。 数据分析:测得的DNA样品中整合的慢病毒载体拷贝数用基因组数加以标定,得到每基因组整合的病毒拷贝数。 滴度(integration units per ml,IU ml-1)的计算公式如下: IU ml-1= (C ×N× D×1000)/V 其中:C = 平均每基因组整合的病毒拷贝数;N = 感染时细胞的数目(约为1×105)D = 病毒载体的稀释倍数 ;V = 加入的稀释病毒的体积数。 空斑形成单位: 空斑检测的是具有感染力的病毒粒子数量,是病毒滴度检测的金标准。空斑形成单位测定是一种测定病毒感染性比较准确的方法,将适当浓度的病毒悬液接种到生长单层细胞的培养板、玻璃平皿或扁瓶中,当病毒吸附于细胞上后,再在其上复盖一层溶化的半固体营养琼脂层,待凝固后,孵育培养。当病毒在细胞内复制增殖后,每一个感染性病毒颗粒在单层细胞中产生一个局限性的感染细胞病灶,病灶逐渐扩大,若用中性红等活性染料着色,在红色的的背景中显出没有着色的“空斑”,清楚可见。由于每个空斑由单个病毒颗粒复制形成,所以病毒悬液的滴度可以用每毫升空斑形成单位(PFU)来表示。 TCID50测定法(50%组织培养感染剂量): 此方法也可以计算病毒滴度,其滴度值理论上为半个具有感染力的病毒粒子数量的稀释值,理论上即可换算为logTCID50=log plaque+0.67。 VP测定法(病毒颗粒): OD260可以检测病毒DNA和蛋白的浓度,但不能区分完整的、有感染能力的病毒和损伤的、无感染能力的病毒。这是一个可以检测全部病毒(包括存活和死亡的病毒)含量的物理实验。因此通过检测OD260可以反映并计算出病毒颗粒(VP)的浓度。但在检测OD260以前,病毒首先必须被纯化。 此外,一些病毒还有其它较为粗放的滴度检测方法,如血凝效价、OD280等。 病毒载体的应用 1、将目的基因导入细胞实现相关功能研究,特别是对难以用转染方法实现导入的细胞。 2、将目的基因导入细胞系构建稳转株,使其目的基因能稳定表达,实现相关功能、药物的研究。 3、将过表达目的基因导入细胞系,构建能生产目的蛋白的真核细胞。 4、将目的基因导入动物组织、体内获得长期表达。 5、基因治疗。 6、转基因动物。 7、基因敲除。 8、药物研究:构建表达受体蛋白的细胞系,研究药物的作用。 9、快速建立生产目的蛋白的细胞系,非常有前途的真核细胞表达方法。 END返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |