学点电化学(一):镀槽通电后的基本变化 |
您所在的位置:网站首页 › 电化学基础知识在人们生活中的作用有哪些 › 学点电化学(一):镀槽通电后的基本变化 |
学点电化学(一):镀槽通电后的基本变化
|
4 电镀的电流回路由两类导电体共同构成 在任一电镀过程中,都存在这两类导电体的导电作用。所有电镀的电流回路,都由这两类导电体共同构成。不同的是,电流在第一类导体中的流动,是靠电子的定向移动,而在第二类导体中的流动,是靠离子的定向移动。同时,这两类导体是以阴、阳极为分界的,在溶液内是离子导电的第二类导电体,在溶液以外(包括电极本身)则是电子导电的第一类导电体。 第二篇 电极反应 电镀时,电子导电是怎样转化成离子导电,离子导电又是怎样转化成电子导电的呢?电子导电是固体导电,离子导电是液体导电,两者是性质完全不同的导电形式。既然它们在阴、阳两极相连通,那么阴、阳两极与镀液接触的界面必是它们发生质变的地方,即电极反应之处。 1、阴极反应 阴极(被镀零件)原来是电中性的,当它接收了从电源负极流来的电子后,就带上了负电荷,负电荷积累到一定程度以后,就会使镀液迁移来的Ni2+在阴极与镀液的接触面取走电子,Ni2+被还原成金属镍,可用下式表示:Ni2++2e= Ni。 这是一个普通的还原反应,因它是在电极表面发生的,所以称为电极反应,又因是在阴极上发生的,又称阴极反应。凡是在阴极发生的反应都是还原反应。Ni2+夺取了阴极上的电子还原为金属镍而覆盖在阴极零件表面上,这就是通常所说的镀镍。显然,正是阴极反应这种特殊形式,实现了电子导电与离子导电的相互转化。 2、阳极反应 阳极情况与阴极相反,镍阳极原来是电中性的,但在电镀电源的作用下,电子不断从镍阳极流入电源,致使镍阳极缺少电子而带正电荷。这样就迫使作为阳极的金属镍在极板与镀液交界面放出电子给阳极,镍原子本身就氧化成镍离子而进入镀液,同时向阴极方向迁移,可用下式表示:Ni-2e= Ni2+。 当然,这也是电极反应,具体地说,反应因是在阳极发生的,所以又称阳极反应。凡是在阳极发生的反应都是氧化反应。金属镍不断地失去电子氧化成镍离子而进入镀液,这就是镀镍时镍板逐渐变薄的原因,这种现象叫做阳极溶解。阴极零件上的镍镀层实际上就是阳极溶解发生金属转移的结果。正是阳极反应的发生,实现了离子导电与电子导电的相互转化。 需要指出的是,镀镍时两极上的反应并不止这些。如阴极上除了镍的沉积外,还有氢离子得到电子还原为氢气析出;阳极上除了镍的溶解外,还有氢氧根离子失去电子氧化成水和氧气析出等。这些在电极上发生的得失电子的反应,又称作放电。现将电流流过镀槽时发生的电子导电、离子导电和电极反应三方面的变化总结如下。 (1)在电极和外电路(第一类导电体)中,有自由电子沿一定的方向移动; (2)在镀液(第二类导电体)中,有阴离子和阳离子分别沿相反方向迁移; (3)在电极与镀液的两类导体界面间,有得失电子的电极反应发生。 第三篇 电镀基本运算 当电流通过镀镍溶液时,在阴极上沉积出金属镍,同时阳极上有镍溶解。那么,通入一定的电量后,在阴极能镀上多少重量、阳极又能溶解多少重量的金属镍呢?1834年,木工出身的法拉第通过大量的实验,总结出两条定律,描述这种通入的电量与电极反应产物的重量之间的关系。 1 法拉第定律 (1)法拉第第一定律 法拉第第一定律:电流通过电解质溶液时,在电极上析出或溶解的物质的量(M)与通过的电量(Q)成正比。用公式表示即: M=CQ(C为比例常数) ……式(1) 运用上述公式,只要能够知道比例常数C的数值,就可根据通过电镀槽的电量Q(Q可通过电流强度I和电镀时间t确定,即Q=It),来计算电极上有多少物质析出或溶解。法拉第通过进一步的试验,在下面的定律中告诉我们这个比例常数C是如何求得的。 (2)法拉第第二定律 法拉第第二定律:在电极上每析出或溶解1克当量的任何物质所需要的电量都是1法拉第(1法拉第=96500库伦=26.8安培·小时)。 对参加电极反应的物质来说,它的克当量就是该物质的原子量与它在电极反应时得失的电子数(或化合价)之比,并以“克”为单位。例如,镍的原子量是58.7,电极反应时它得失的电子数都是2(或此时镍的化合价为两价),所以1克当量的镍就等于58.7/2=29.35(克)。 因此,镀镍时通入1法拉第(或96500库伦或26.8安培·小时)的电量,能析出或溶解29.35克镍。根据法拉第第一定律公式M=CQ,即C=M/Q,比例常数C的含义是指单位电量所能析出或溶解的物质重量,C又叫做电化学当量。 这样的话,镍的电化学当量C=M/Q=29.35克/26.8安培·小时=1.095克/安培·小时。其它金属的电化学当量可查看相关手册,此处略。 知道了电化学当量C的数值,就可根据通过镀槽的电流强度I和电镀时间t,计算出电极上有多少物质析出或溶解。 【例题1】在酸性镀铜溶液中,以80A电流电镀0.5h,问能镀出多少克铜(假设阴极只析出铜)? 解:必须注意,在不同的镀液中,铜的化合价可能不同。在酸性镀铜、焦磷酸盐镀铜溶液中铜呈两价,在氰化镀铜溶液中铜呈一价。因此,查电化学当量表时不要搞错。这里是两价铜离子在阴极放电还原,查表可知C=1.186克/安培·小时 又知,I=80A,t=0.5h,将这些数值代入公式M=CQ=CIt可得: M=1.186×80×0.5=47.44(克) 答:阴极上能镀出47.44克铜。 2 电流效率 然而,在电镀时,往往通入镀槽1法拉第的电量,在阴极上却得不到1克当量的金属镀层,是不是法拉第定律有误呢? 当然不是。因为电镀时,阴极上实际进行的反应不只是金属离子放电还原。比如镀锌时,阴极上除进行锌离子放电还原(Zn2++2e=Zn)外,同时还有氢离子放电析出氢气(2H++2e=H2↑)。通常把这种与主反应(如Zn2+的还原)同时进行的反应叫做“副反应”(如H+的还原)。由于副反应的存在,使得用于沉积金属的电流只是所通过的总电流的一部分,而其余部分则消耗在副反应上了。把电极上所析出的锌与氢的量合起来计算所消耗的电量,仍然是符合法拉第定律的。 阳极上也是一样,除了有金属溶解外,也有副反应存在。通常发生的是OH-放电而析出氧气:4OH--4e=2H2O+O2↑。在镀镍槽中,阳极还可能放出氯气:2Cl--2e=Cl2↑。 由于副反应的存在,对镀层重量来说,就存在一个效率的问题,因而提出了电流效率的概念。计算电流效率的公式如下: η=M∕/M×100% 式中η——电流效率(阴极电流效率为ηk,阳极电流效率为ηA)(%); M∕——电极上实际析出或溶解的金属重量(克); M——由总电量换算出的析出或溶解的金属重量(克)。 由上式可推导出电极上实际析出或溶解的金属重量M∕: M∕=Mη=CItη……式(2) 【例题2】已知氰化镀铜中,通过镀槽的电流是150A,电镀时间为1.5h,阴极电流效率ηk=70%。问能镀出多少克铜? 解:查表得C=2.371可/安培·小时(注意:此时铜呈一价) 又知:I=150安培,t=1.5小时,ηk=70% 把上述数据代入公式得: M∕=CItη=2.371×150×1.5×70%=373.43(克) 答:可镀出373.43克铜。 电流效率是评定镀液性能的一项重要指标。提高电流效率可加快镀层沉积速度,减少电能消耗。一般酸性镀液,如镀镍、酸性镀铜、酸性镀锌等,电流效率都接近100%;焦磷酸盐镀液的电流效率也较高,一般均大于90%;氰化镀液的电流效率较低,一般为60~70%;镀铬溶液的电流效率更低,一般仅为10~20%。 生产中会发现,在弱酸性镀液(如酸性镀锌、镀镍等)中,镀液的PH值会随着电镀时间延长而逐渐升高,而弱碱性镀液(如焦磷酸盐镀铜)中,PH值会随着电镀时间延长而逐渐下降。这是什么原因呢?主要是阴、阳两极电流效率的不均衡造成的。在弱酸性镀液中,阴极电流效率低于阳极电流效率,这意味着阴极消耗的H+多于阳极消耗的OH-,从而使整个镀液的H+含量相对减少,因此PH值会逐渐升高。在弱碱性镀液中,阴极电流效率高于阳极电流效率,这意味着阴极消耗的H+少于阳极消耗的OH-,使整个镀液的H+含量相对增加,因此PH值会逐渐下降。 3 镀层厚度和沉积速度的计算 (1)镀层厚度的计算 根据式M∕=CItη, 另外M∕=Sdγ,I=DS, 将以上式子合并后可得镀层厚度的计算公式: d=CDktηk×100/60γ ……式(3) 式中 d——电镀层厚度(微米); C——电化学当量(克/安培·小时); Dk——阴极电流密度(安培/ 分米2); t——电镀时间(分); ηk——阴极电流效率(%); γ——电镀层金属密度(克/厘米3)。 式中d实际是平均厚度,也就是假定镀上的金属均匀分布在零件表面。事实上镀层的厚度分布是不均匀的,在尖角、边缘处较厚,超过平均厚度;凹入处较薄,低于平均厚度。 【例题3】在锌酸盐镀锌中,所采用的电流密度是1安培/ 分米2,时间为45分钟,该溶液的电流效率为78%。问镀上的镀层厚度为多少微米? 解:查表可知锌的密度γ为7.14克/厘米3,电化学当量C为1.22克/安培·小时,将全部数据代入公式可得: d=CDktηk×100/60γ =1.22×1×45×78%×100/60×7.14 ≈10(微米) 答:镀上的镀层厚度约为10微米。 另外,因为滚镀的电流密度Dk、实际受镀面积S均不能确定,所以目前尚不能确定滚镀的镀层平均厚度d,而只能通过经验大致获得。 (2)镀层沉积速度的计算 镀层沉积速度V就是单位时间内所镀上的镀层厚度,则V=d/t,代入镀层厚度计算公式后得: V= CDkηk×100/60γ……式(4) 【例题4】在氯化铵-氨三乙酸镀锌中,采用的电流密度为1.5安培/ 分米2,电流效率为95%。求这时的沉积速度。又若镀35微米锌层,需要多长时间? 解:V= CDkηk×100/60γ =1.22×1.5×95%×100/60×7.14 =0.4(微米/分) 镀35微米锌层所需时间: t=d/V=35/0.4≈87(分钟) 答(略) 第四篇 影响电镀溶液电导率的因素 与导线、导电棒及极板等第一类导体一样,电镀溶液即第二类导体也具有电阻,它的电阻R也是与它导电部分的长度L(即两极间距离)成正比,与它导电截面积的大小S(即极板面积的大小)成反比,可用下式表示: R=ρL/S 其中ρ为电镀溶液的电阻率,表示两极间距离为1cm、极板面积为1cm2电镀溶液的电阻,即1cm3电镀溶液的电阻。 但对于电镀溶液,总是习惯用电阻R的倒数电导G或电阻率ρ的倒数电导率k来描述其导电能力的强弱,即G=1/R或k=1/ρ,则: G=kS/L 上式电导率k表示两极间距离为1cm、极板面积为1cm2电镀溶液的电导,即1cm3电镀溶液的电导。k与ρ都说明电镀溶液导电能力的强弱,只是表示的形式不用而已。 那么,影响电镀溶液电导率的因素有哪些呢? 电镀溶液的导电是离子定向移动的结果,因而其电导率主要与溶液中离子数量的多少和离子运动的速度有关,下面就影响这两方面的各种因素进行讨论。 1、电解质的本性 (1)强电解质与弱电解质 一般强电解质比弱电解质的电导率大得多,因为它的电离度大,电离出来的离子数量多。比如在钾盐镀锌溶液中,氯化钾是强电解质,因而主要起增加溶液电导率的作用,而硼酸是弱电解质,主要起调节溶液酸度的作用,对增加溶液电导率几乎没有作用。 (2)离子种类 电镀溶液中离子的种类不同,导电能力也不同,则溶液的电导率不同。比如在所带电荷相同的情况下,H 的移动速度比其他离子快5~8倍,OH-的移动速度也要比一般离子快2~3倍,所以一般强酸强碱溶液的电导率要比其他电解质溶液大得多。 (3)离子所带电荷的多少 电镀溶液中,离子所带电荷的多少对导电能力也有影响,一般情况是离子所带的电荷多,导电能力也强。 2、镀液浓度 镀液浓度越高,则单位体积内离子的数量就越多,一般来说电导率也就越大。比如,镀镍溶液中曾使用过的导电盐Na2SO4·10H2O的含量由80克/升增加到160克/升时,可使镀液的电导率增加30%左右。 但不能因此说,电镀溶液的浓度无限增大,电导率也会随着无限增大。比如,镀铬溶液的CrO3增加到一定值(450克/升)时电导率最大,但若再提高电导率反而下降。这是因为溶液中的离子之间存在着一定的相互作用,每个离子的运动均会受到周围其他离子吸引或排斥作用的牵制。浓度越高,溶液中离子的数量越多,离子间相互牵制的作用就越强,使离子运动变得困难。所以,当溶液浓度增大时,一方面导电离子数量增多使电导率增大,另一方面使离子运动困难电导率下降。当溶液浓度增大到一定值时电导率最大,之后便开始下降。 3、镀液温度 升高温度会减弱离子的水化作用和降低溶液的粘度,因而可使溶液中离子的运动速度加快,电导率提高。一般,镀液的温度高些,其他条件不变,电流总可以开得大些,原因之一就是电导率增大了。一般情况下,温度每升高10度,电镀溶液的电导率约增加10~20%。 以上所述表明,选择强电解质做导电盐以及提高镀液的浓度或温度,均可提高镀液的电导率。提高镀液电导率对改善溶液分散性能、深镀能力及节约电能等都有重要的意义。但也不能因此把镀液配得太浓,或把温度升得太高,否则会对镀层质量、镀液成本与消耗、以及生产操作等带来不利。选择导电盐应以不会对镀液、镀层、基体等产生其他不利作用为准则,否则不可使用。 第五篇 电镀过程的离子迁移现象 当电流通过电镀槽时,电镀液内的阴离子和阳离子会分别沿相反方向迁移,这种现象称之为电迁移。实际上,电镀过程中的离子除电迁移外,还同时存在着扩散和对流两种迁移现象。现以硫酸铜含量200g/L及硫酸含量60g/L的光亮硫酸镀铜溶液为例来说明这三种迁移方式。通过计算(从略),可知该酸铜溶液的H+、SO42-、Cu2+的离子迁移数分别为0.58、0.30、0.12(离子迁移数指镀液中某种离子所迁移的电量占通过该镀液总电量的比值)。另外,为简便计,该酸铜溶液的阴、阳极电流效率可视为100%。 1.电迁移 由法拉第定律可知,当通过电镀槽的电量是1法拉第时,在电极上将有1克当量的物质发生反应。先来看看上述酸铜溶液的阳极情况。当通过1法拉第电量时,阳极上将有1克当量的金属铜溶解,生成了1克当量的Cu2+。又因为在该酸铜溶液中,Cu2+的离子迁移数为0.12,则说明在通电1法拉第电量后,Cu2+从阳极区域溶液中电迁移出去0.12克当量。这样的话,相当于阳极区域溶液中的Cu2+增加了1-0.12=0.88克当量。又知H+、SO42-的离子迁移数分别为0.58、0.30,则说明在通电1法拉第电量后,H+从阳极区电迁移出去0.58克当量(相当于在阳极区留下或增加了0.58克当量的SO42-),SO42-从溶液内部电迁移至阳极区0.30克当量,则阳极区的SO42-增加了0.58+0.30=0.88克当量。这样的话,在通电1法拉第电量后,对于阳极区域溶液来说,因为Cu2+和SO42-的量同样增加了0.88克当量,所以仍然呈电中性(相当于阳极区增加了0.88克当量的CuSO4)。 再来看看该酸铜溶液的阴极情况。当通过1法拉第电量时,阴极上将有1克当量的金属铜沉积,阴极区域溶液中减少了1克当量的Cu2+。但因此时从溶液内部电迁移过来0.12克当量的Cu2+,则实际上阴极区的Cu2+减少了1-0.12=0.88克当量。又知此时从溶液内部电迁移过来0.58克当量H+相当于阴极区减少了0.58克当量SO42-),从阴极区电迁移出去0.30克当量SO42-,则阴极区的SO42-减少了0.58+0.30=0.88克当量。这样的话,在通电1法拉第电量后,对阴极区域溶液来说,因为Cu2+和SO42-的量同样减少了0.88克当量,所以仍然呈电中性(相当于阴极区减少了0.88克当量的CuSO4)。 由以上分析可知,在上述酸铜溶液通电1法拉第电量后,阳极区增加了0.88克当量CuSO4,而同时阴极区减少了0.88克当量CuSO4。此时,整个溶液仍然呈电中性。那么,随着电镀时间的延长,是否会出现这样的情况:阳极区CuSO4越来越多而阴极区CuSO4越来越少、以至于最后阴极区CuSO4为零而镀不出铜来?当然不会的,因为电镀过程的离子迁移方式除了电迁移外,同时还有另外两种方式:扩散和对流。正是由于扩散和对流这两种运动的作用,使电迁移造成的电极附近与溶液内部间物质的不平衡得以再平衡,从而维持电镀过程的正常进行。 2.扩散 当镀液中的某一种成分存在浓度差异时,由于分子热运动的结果,即使在镀液完全静止的情况下,也会发生该成分从高浓度区向低浓度区的移动。这种移动,就称为扩散。比如,在一杯静止的清水里滴入一滴墨汁,墨汁会从滴入处慢慢地分散到清水的每一个角落,直到清水全部变成墨汁的颜色。这就是一种扩散现象。扩散是因浓度场的存在而产生的一种物质迁移现象。 上述酸铜溶液在通电后,随着阳极区CuSO4浓度的不断增大,造成阳极区CuSO4与其他区域CuSO4的浓度差不断增大,则势必发生Cu2+和SO42-成对地向溶液内部扩散,进而向阴极区扩散,从而使电迁移造成的溶液各区域间物质不平衡得以减缓。由于是阴、阳离子成对地一起扩散,所以这种移动不会引起电流的传送。 3.对流 所谓对流,是指溶质的粒子随镀液的流动而迁移的一种现象,溶质与镀液之间没有相对运动(而扩散的溶质与镀液之间存在相对运动)。比如,封闭房间的空气里含有不洁的成分,当把房间前后窗户打开后,流通的空气会把原房间的空气及其所含的不洁成分一块儿赶走。这就是一种对流现象。对流是因速度场的存在而产生的一种物质迁移现象。 镀液中的对流,是由于通电或加热的原因,使镀液局部区域产生了浓度和温度的差异,引起溶液密度不同而使溶液自然流动,并带动溶质粒子一起运动。这种对流属于自然对流。电极反应时析出气泡带动的溶液翻动,也是一种自然对流。还有一种对流叫强制对流,指人为地使镀液流动而产生的对流,比如挂镀的阴极移动、空气搅拌,滚镀的向滚筒内循环喷流等都属于强制对流。 在镀液的对流过程中,能把一些电极反应的反应物或生成物带过来或带过去,从而起到传送物质、再平衡溶液各区域间物质不均的重要作用。因通电时各部分溶液都是电中性的,故这种对流不会引起电流的传送。 综上所述,当电流通过电镀槽时,电迁移造成了电极附近与溶液内部间物质的不平衡,而扩散和对流使这种不平衡得以减缓,从而保证了电镀过程的正常进行。 第六篇 电镀中的双性电极现象 请看如下示意图。
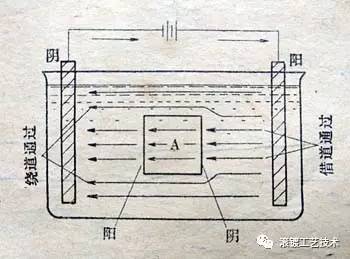
如图所示,镀液中的导体A既不与阴极相连、也不与阳极相连,当电流通过镀槽时,A的右端会有镀层沉积,而左端可能会发生金属的溶解(或钝化、腐蚀),这是为什么呢? 当电流通过镀槽时,必然会有一部分电流从金属A上直接通过,电流通过情况如图中所示。我们知道,当电流通过两类导电体的界面时,必然会发生电极反应,电流流入的地方(为阴极)发生阴极反应,电流流出的地方(为阳极)发生阳极反应。这样的话,金属A的右端为电流流入的地方,为阴极,发生阴极反应,则有镀层沉积;金属A的左端为电流流出的地方,为阳极,发生阳极反应,则可能会发生金属的溶解(或钝化、腐蚀)。这种阴、阳两极的反应同时发生在同一金属上的现象,称为双性电极现象。而金属A则为双性电极。 那么,双性电极现象在电镀生产中有什么利害呢? 例一 此例说明可利用双性电极现象为电镀生产服务。 某圆筒形钢铁零件内壁需要镀铜,目的是防渗碳,而外壁则不允许有铜镀层,因外壁需要渗碳,若有铜镀层则无法渗碳。若采用普通电镀的方法,需要先在外壁做绝缘处理(如涂防镀剂、包裹绝缘材料等),等内壁镀完铜后,还要将外壁的绝缘物质去除,否则外壁不能渗碳,比较繁琐。但若利用双性电极现象进行圆筒内壁镀铜,则操作上会简单得多。请看如下示意图。
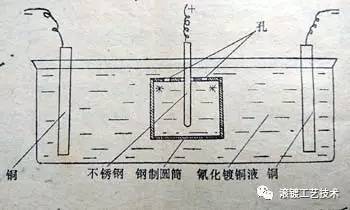
如图中所示,不锈钢阳极布置在圆筒内,当电流导通时会从圆筒内壁流入,而从圆筒外壁流出。这样的话,根据双性电极原理,圆筒内壁因是电流流入处而镀上铜镀层,从而达到防渗碳的目的。而圆筒外壁虽是电流流出处,但因是在强碱性镀液(氰化物镀铜溶液)中,所以可避免钢制圆筒外壁溶解而损坏。 另外,生产中发现,此例中圆筒上端的两个开孔较大时,图中所示的﹡处不易沉积上铜镀层,这是为什么呢?根据上文的分析知道,利用双性电极原理进行电镀时,需要电镀的部位应有电流流入。圆筒上端的两个开孔较大时,电流很容易从开孔处流走而绕开﹡处,从而使﹡处因电流不易流入而沉积不上铜镀层。这点与普通电镀正好相反,在普通电镀时,﹡处因属于高电流密度区而更容易沉积上镀层。知道了问题产生的原因,就应该知道怎么解决这个问题,此处暂做保留。 例二 此例说明双性电极现象在电镀生产中的危害。 生产中发现,采用“一槽多筒”的形式(如四头机)滚镀双层镍时,两层镍之间容易出现结合力不良问题。镍层在大气中容易钝化,所以担心半亮镍出槽后再镀亮镍会结合力不良是可以理解的。但问题往往不是由半亮镍出槽后自然钝化引起的,而是由双性电极现象造成的半亮镍层钝化引起的。采用“一槽多筒”的形式生产时,滚筒出半亮镍槽和入亮镍槽总是一只一只地接替进行,当一只滚筒出(或入)槽时,其他滚筒的电镀仍在进行,则出(或入)槽滚筒中的零件因双性电极现象而表面钝化,在表面钝化的零件上镀亮镍就会很容易出现结合力问题。而采用单槽单筒时或采用单槽多筒时滚筒同时出(或入)槽,则不会产生双性电极现象,因而不会出现两层镍间的镀层结合力问题。知道了问题产生的原因,就应该知道怎么解决这个问题,如滚筒带电入槽、滚筒同时出入槽(此法在连续生产时可能不太好操作)等。 同样的道理,钕铁硼采用“一槽多筒”的形式打底或直接镀时,(除混合周期影响上镀易造成零件表面氧化腐蚀外),也会因双性电极现象造成零件表面氧化腐蚀而影响镀层与基体的结合力,因该问题较隐蔽容易被忽视,希望有关人员看到此文后能引起注意。 当然,以上例子问题的产生还有其内因所在,比如镍层容易钝化、钕铁硼表面化学活性极强,此时再加上外因——双性电极现象,内外因结合,造成零件表面钝化或氧化腐蚀而产生结合力不良问题。若是普通钢件采用“一槽多筒”的形式,虽然也会受到双性电极现象的影响,但氧化腐蚀不明显,若非质量要求很高基本可以忽略。 生产中因双性电极现象造成危害的例子还很多,比如电镀设备(如镀液中的不锈钢加热管、镀铬槽衬铅层等)因双性电极现象而腐蚀损坏,腐蚀产物污染镀液等,篇幅所限不再一一举例。 http://www.hddashun.com返回搜狐,查看更多 |
【本文地址】