生物信息常见文件的格式以及查看方式 |
您所在的位置:网站首页 › 生物信息linux › 生物信息常见文件的格式以及查看方式 |
生物信息常见文件的格式以及查看方式
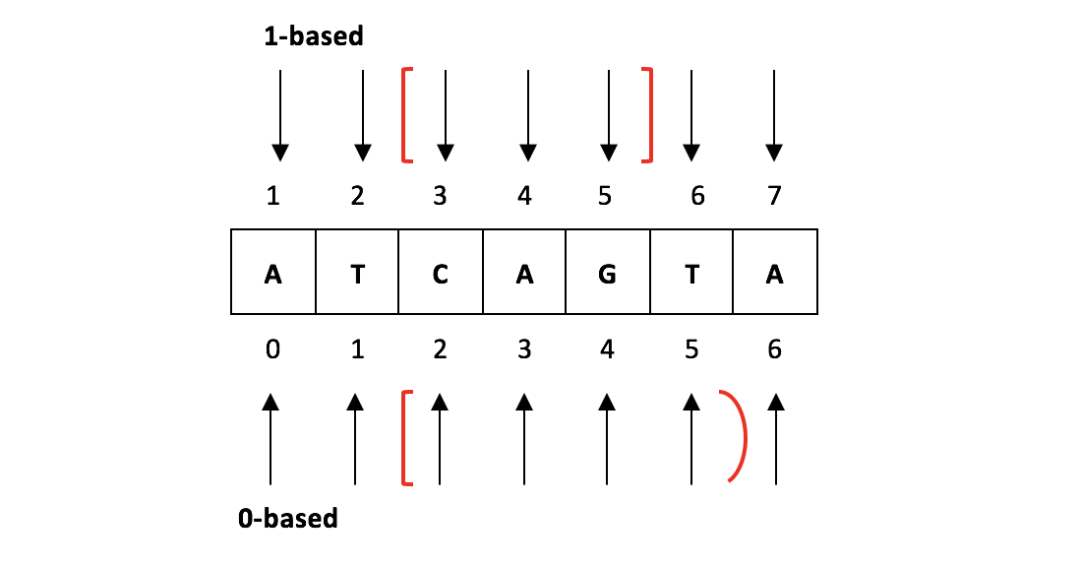
 生信分析过程中,会与很多不同格式的文件打交道,除了原始测序数据fastq之外,还需要准备基因组文件fasta格式和基因注释文件gtf格式。在分析的过程中还会有众多中间文件的生成,如bed、bed12、sam、bam、wig、bigwig、bedgraph等,生成后我们一般会查看下内容了解文件每一列的含义,以此来决定需要提取哪些有用信息列来进行下一步分析。 插播一个小剧场老板:“先查看一下bam文件内容。” 小白:嗒嗒嗒敲键盘。 $ less ehbio.bam "ehbio.bam" may be a binaryfile. See it anyway?小白:“哎呀,错了,应该这样。” 嗒嗒嗒敲键盘。 $ samtools view ehbio.bam # 回车一敲,灾难,电脑要卡死,赶紧按`control + c` $ samtools view ehbio.bam | less # 这下终于可以查看了老板:“你逗我呢……”(不失礼貌的批评) 刚接触生信分析的小白们这种尴尬的事情时有发生,为了帮助大家梳理这些剪不断理还乱的文件,本文以分析流程为主线,介绍各文件的格式以及有哪些常用命令来查看或处理它们。 1. 测序数据FASTQ文件1)文件用途:样品测序返回的数据一般存储为fastq文件,通常是压缩文件filename.fq.gz的格式,节省存储空间和传输时间。点击这里查看《FASTQ格式解释和质量评估》 2)查看方式 # zcat查看gzip压缩的文件 # head -n 8 显示前8行文件内容(前8行代表2条序列) zcat filename.fq.gz | head -n 8 # @SRR1039521.13952745/1 # TTCCTTCCTCCTCTCCCTCCCTCCCTCCTTTCTTTCTTCCTGTGGTTTTTTCCTCTCTTCTTC # + # HIJIIJHGHHIJIIIJJJJJJJJJJJJJJJJJJJJJIIJJFIDHIBGHJIHHHHHHFFFFFFE3)格式说明:fastq文件每4行代表一条序列 第一行:记录序列测序时所用仪器以及在测序通道中坐标信息,以@开头; 第二行:测序的序列信息,以ATCGN表示,由于荧光信号干扰无法判断是什么碱基时就用N表示; 第三行:通常一个+; 第四行:与第二行碱基信息一一对应,存储测序碱基的质量值。 4)其他常用命令 # 计算read数 # wc -l: 计算行数 # bc -l: 计算器 (-l:浮点运算) # 为什么除以4,又除以1000000,计算的是million值 echo "`zcat trt_N061011_1.fq.gz | wc-l` / (4*1000000)" | bc -l # 测序碱基数计算 zcat trt_N061011_1.fq.gz | awk'{if(FNR%4==0) base+=length}END{print base/10^9,"G";}'2.基因组FASTA文件此文件可以从ensemble数据库下载的(https://www.ensembl.org/info/data/ftp/index.html), 一般选择下载primary assemblyfasta(想知道为什么,点这里)。fasta文件用于序列存储,可以是DNA或蛋白序列,在此FASTA文件存储了基因组序列的信息。 序列名字行:以>符号开头,记录了该序列类型和所在基因组位置信息; 序列行(一行或多行):序列信息,soft-masked基因组会把所有重复区和低复杂区的序列用小写字母标出的基因组,小写字母n表示未知碱基。 >1 dna_sm:chromosomechromosome:GRCh38:1:1:248956422:1 REF nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn ..... ttgggctggggcctggccatgtgtatttttttaaatttccactgatgattttgctgcatg gccggtgttgagaatgactgCGCAAATTTGCCGGATTTCCTTTGCTGTTCCTGCATGTAG TTTAAACGAGATTGCCAGCACCGGGTATCATTCACCATTTTTCTTTTCGTTAACTTGCCG ..... nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn # 通常要求序列名字行简单为好,而且一般加chr作为开头 # 给第一行添加chr标签,并去掉其他多余信息 # 下面的写法复杂了些,是为了避免给已经有chr信息的名字再加一次 # 帮助无脑操作 sed 's/^>\([^chr]\)/>chr\1/' Homo_sapiens.GRCh38.dna.primary_assembly.fa |cut -f 1 -d ' ' > GRCh38.fa3. 基因组注释文件gff和gtfgff全称General featureformat,主要是用来注释基因组。gtf全称Gene transfer format,主要是用来对基因进行注释。两者均是一个9列的基因信息注释文件,前8列的信息几乎一样,区别在于第9列。 从ensemble下载的gtf文件前5行一般是以#开头的注释信息,后续分析中用不上需要去除,同时需要给第一列添加chr标签(与基因组序列一致),可通过下面的命令对文件进行加工: # grep 匹配查询 -v 输出不匹配的行 gunzip Homo_sapiens.GRCh38.94.gtf.gz -c |grep -v '^#' | sed '/^[^chr]/ s/^/chr/' >GRCh38.gtf4. bed文件分析过程中的bed文件一般代表区域信息,如表示Peak位置的bed文件,表示基因注释的bed12文件。 表示基因注释时,gtf/gff和bed文件的区别1)gtf/gff文件一行表示一个exon/CDS等子区域,多行联合表示一个gene;bed文件一行表示一个gene; 2)gtf文件中碱基位置定位方式是1-based,而bed中碱基定位方式是0-based,如下图所示。
必须包含的3列信息: 1)chrom:染色体名字 (e.g.chr3, chrY, chr2_random或者scaffold10671)。 2)chromStart:基因在染色体或scaffold上的起始位置(0-based)。 3)chromEnd:基因在染色体或scaffold上的终止位置 (前闭后开)。 可选的9列信息: 4)name:bed文件的行名。 5)score:本条基因在注释数据集文件中的评分(0-1000),在Genome Browser中会根据不同区段的评分显示对应的阴影强度(评分越高灰度越高)。 6)strand:链的方向+、-或. (.表示不确定链的方向) 7)thickStart:CDS区(编码区)的起始位置,即起始密码子的位置。 8)thickEnd:The endingposition at which the feature is drawn thickly (for example the stop codon ingene displays). 9)itemRgb:RGB颜色值(如:255,0,0),方便在GenomeBrowser中查看。 10)blockCount:bed行中外显子的数目。 11)blockSizes:逗号分割的列,数目与blockCount值对应,每个数表示对应外显子的碱基数。 12)blockStarts:逗号分割的列,数目与blockCount值对应,每个数表示对应外显子的起始位置(数值是相对ChromStart计算的)。 5. sam和bam文件sam文件全称The SequencingAlignment/Map Format,是Alignment/Map步骤bwa/STAR/HISAT2等软件对结果的标准输出文件,用于存储reads比对到参考基因组的比对结果,是一个纯文本格式,文件一般较大。为了节省硬盘存储,一般使用其高效压缩的二进制格式bam文件。 利用samtools view的-b参数就能把sam文件转为bam文件。 1)sam文件查看方式 在linux终端直接用less即可进行查看; 2)bam文件查看方式 需要借助samtools view工具进行查看 samtools view filename.bam | less -S samtools view -h filename.bam | less -SNGS分析中大多数文件都是由header和record两部分组成,加上-h参数后可以将header显示出来,默认是不显示的。 @HD VN:1.5 SO:coordinate @SQ SN:chr1 LN:248956422 @SQ SN:chr10 LN:133797422 ...... @SQ SN:chrKI270392.1 LN:971 @SQ SN:chrKI270394.1 LN:970 @RG ID:BH_H3K27ac_2 LB:BH_H3K27ac_2 SM:BH_H3K27ac_2 @PG ID:bwa PN:bwa VN:0.7.15-r1140 CL:bwa mem -M -t 8 -R@RG\tID:BH_H3K27ac_2\tLB:BH_H3K27ac_2\tSM:BH_H3K27ac_2\tPL: /MP @PG ID:MarkDuplicates VN:1.138(aa51703435dc6a423013e74e56b0b68405facd79_1439324166) CL:picard.sam.markduplicates. K00141:244:HVL3NBBXX:8:2119:27235:3145399 chr1 10016 32 115M = 10016 115 CCCTAACCCTAACCCTAACCC K00141:244:HVL3NBBXX:8:2119:27235:31453147 chr1 10016 32 115M = 10016 -115 CCCTTACCCTAACCCTAACCCheader内容 @HD:是必须的标准文件头,包含版本信息; @SQ:参考序列染色体名字和长度信息 (SN:scaffold name; LN: length); @RG:重要read group信息,通常包含测序平台,测序文库和样本ID等信息,分析时用于区分不同样本(重测序时用到); @PG:生成此文件的操作过程和参数信息 (program)。record内容 每一行就是一条read比对上参考基因组的信息,总共12列,用tab键分割。# 1. read名称; # 2. 比对信息位flag值; # 3. 参考序列染色体编号; # 4. 5′端起始位置; # 5. MAPQ:mapping quality,描述比对的质量,数字越大,特异性越高; # 6. CIGAR字符串,记录插入、删除、错配等信息; # 7. 配对read所比对到的染色体,仅双端测序的数据才有; # 8. 配对read所比对到的位置,仅双端测序的数据才有; # 9. 插入片段的长度,仅双端测序的数据才有; # 10. read序列; # 11. read质量值; # 12. 12列以后的信息都是metadata,程序用标记sam文件中第二列flag信息很重要,下面做进一步解释。 利用samtools flagstat工具可以查看bam文件中比对的flag信息,并输出比对的统计结果。 samtools flagstat *.bamflag一共有12个标签,使用16进制数表示,每个标签值是2^(n-1),其中n |
【本文地址】
今日新闻 |
推荐新闻 |