从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制 |
您所在的位置:网站首页 › 玉竹的图 › 从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制 |
从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制
|
1 材料 1.1动物与细胞 SPF级SD雄性大鼠,体质量180~220 g,由江西中医药大学动物实验科技中心提供,许可证号SYXK(赣)2020-0003。大鼠饲养于12 h光照/12 h黑暗交替的环境中,室温20~25 ℃,相对湿度为40%~60%,自由饮水与进食。动物实验经江西中医药大学实验动物伦理委员会批准(批准号JZSYDWLL-20201215)。 HuTu-80细胞购自上海富衡生物科技有限公司。 1.2药材 玉竹购自安徽道源堂中药饮片有限公司,附子、肉桂、干姜购自江西吁江生态科技有限公司,经江西中医药大学付小梅教授鉴定分别为百合科植物玉竹P.odoratum(Mill.) Druce的干燥根茎、毛茛科植物乌头Aconitum carmichaeliiDebx.的子根、樟科植物肉桂Cinnamomum cassiaPresl的干燥树皮以及姜科植物姜Zingiber officinaleRosc.的干燥根茎。 1.3药品与试剂 GLP-1、MTL、CCK、VIP试剂盒(批号20201019)购自上海恒远生物科技有限公司;RNA提取试剂盒(批号R1200)购自北京索莱宝科技有限公司;M5 Sprint qPCR RT kit with gDNA remover(批号MF949-01)、Realtime PCR Super mix SYBR green with anti-Taq(批号MF013-01)购自北京聚合美生物科技有限公司;Na + , K + -ATP 酶试剂盒(批号A070-2-2)、Ca 2+ , Mg 2+ -ATP 酶试剂盒(批号A070-3-2)购自南京建成生物工程研究所;引物由上海生工生物工程技术服务有限公司合成;AQP1抗体(批号ET1703-34)、AQP3抗体(批号HA500247)、β-actin抗体(批号EM21002)、二抗(批号HA1006)购自杭州华安生物技术有限公司;T1R2抗体(批号Ab-DF10279)购自Affinity Biosciences公司;T1R3抗体(批号A10157)购自武汉爱博泰克生物科技有限公司;α-gustducin抗体(批号bs-6149R)购自北京博奥森生物科技有限公司。 1.4仪器 Multiskan GO全波长酶标仪(美国Thermo公司);Light Cycler 96型qRT-PCR仪(罗氏集团);Chemidoc XRS+高灵敏度化学发光成像系统(美国Bio-Rad公司);752型紫外-可见分光光度计(上海菁华科技仪器有限公司);MC-347型欧姆龙电子体温计(欧姆龙大连有限公司);Allegra 64R型高速冷冻离心机(美国贝克曼库尔特公司);DYCZ-24DN型双垂直电泳仪(北京六一仪器厂)。 2 方法 2.1药物的制备 取玉竹,加水浸泡1.0 h后,加热至100 ℃,回流提取2次,同时收集挥发油,备用(得率0.98%);合并提取液,浓缩,加乙醇至含醇80%,冷藏,过滤,沉淀干燥,即得玉竹“多糖”,质量分数为73.25%,得率21.19%,且符合《中国药典》2020年版要求[14];滤液浓缩,干燥,粉碎,与上述挥发油混合均匀,即得玉竹“醇提取物”,得率12.30%,其中含总黄酮2.93%、总皂苷6.50%;合并玉竹“多糖”与玉竹“醇提取物”,即得玉竹“总提取物”。 取附子适量,加水100 ℃提取60 min后,再加入干姜、肉桂提取,滤过,药渣再提取1次,合并2次滤液,浓缩至生药质量浓度2 g/mL,即得“热性中药”提取液,4 ℃储存,备用。 2.2基于整体动物模型阐释玉竹“补而不腻”机制 2.2.1动物造模、分组及给药取大鼠50只,ig热性中药(10 mL/kg)制备阴虚证模型,以体质量、活动状态、毛发光泽、爪色、尿液颜色、粪便质地为模型评价指标[15]。造模成功后随机分为模型组、多糖(267 mg/kg,根据临床剂量及浸膏得率换算,下同)组、醇提取物(155 mg/kg)组和总提取物组(422 mg/kg)组,每组10只;另取10只大鼠作为正常组,正常组及模型组ig等体积的0.9%生理盐水,1次/d,连续28 d。 2.2.2体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率的检测参照文献方法[16],分别于给药前及给药后7、14、21、28 d进行体质量、体温、摄食量、摄水量测定。同天收集大鼠24 h的粪便,称定,记为湿质量,然后在90 ℃的烘箱中烘干3 h,称定,记为干质量,计算粪便含水率[17];取皮肤约1 cm 2 ,称定质量,记为湿质量,随即放入80 ℃烘箱中干燥2 h,称定质量,记为干质量,计算皮肤含水率[18]。 粪便含水率=(湿质量-干质量)/湿质量 皮肤含水率=(湿质量-干质量)/湿质量 2.2.3胃排空率与小肠推进率的测定末次给药后,禁食不禁水12 h,ig酚红溶液,30 min后ip戊巴比妥钠麻醉,取胃并切开,以蒸馏水冲出内容物并收集,定容,加NaOH溶液混匀,室温放置后取 上清液加入20%三氯乙酸溶液,离心后取上清液测定其吸光度(A)值,记为A实测酚红;另取0.04%酚红-明胶溶液,按上述方法,依次加蒸馏水、NaOH、三氯乙酸溶液,混匀配成标准溶液,测定A值,记为A标准酚红,计算胃排空率[19]。同时分离小肠,直铺于冰上,量取小肠全长及酚红在小肠内的推进的距离,计算小肠推进率[20]。 胃排空率=1-A实测酚红/ A 标准酚红 小肠推进率=幽门至酚红染成红色末端的距离/幽门至回盲瓣的距离 2.2.4取样在完成“2.2.3”项下实验后,取皮肤、肺、肝、胃、肾、十二指肠,放入−80 ℃超低温冰箱,备用;另腹主动脉取血,静置,离心,取上清,得血清,备用,同时收集下层红细胞,备用。 2.2.5GLP-1、CCK、MTL、VIP含量的测定取血清,按试剂盒说明书,采用ELISA法测定血清中GLP-1、CCK、MTL、VIP的含量。 2.2.6Na + , K + -ATP 酶、Ca 2+ , Mg 2+ -ATP 酶活性测定取肝、肾组织适量,按1∶9加生理盐水,匀浆,4 ℃离心,取上清测定酶的活性;取红细胞于离心管,加PBS及PMSF,置冰上破溶,离心,得红细胞膜,备用;取细胞膜,加裂解液,反复冻融3次,离心,取上清测定酶的活性。 2.2.7qRT-PCR测定AQP1、AQP3、T1R2、T1R3和α-gustducinmRNA表达取肺、胃、肾、十二指肠适量,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。
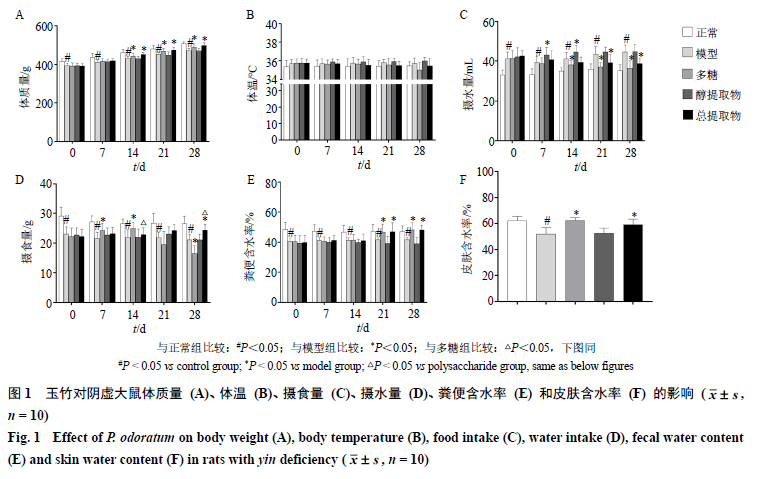
2.2.8Western blotting测定AQP1、AQP3、T1R2、T1R3和α-gustducin蛋白表达取肺、胃、肾、十二指肠适量,匀浆,加裂解液提取蛋白,测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭,加入一抗,4 ℃孵育过夜,洗膜,加入二抗孵育,洗涤,显色。 2.3基于细胞模型阐释玉竹“补而不腻”机制 2.3.1 Na + , K + -ATP 酶、Ca 2+ , Mg 2+ -ATP 酶活性测定取对数生长期的HuTu-80细胞,以4×10 5个/孔接种于6孔板,贴壁后吸去培养基,设置正常组、多糖(200 μg/mL)组、醇提取物(100 μg/mL)组和总提取物(300 μg/mL)组,正常组加入细胞培养液2 mL,给药组加入同体积的相应提取液,继续培养24 h后,消化后离心收集细胞,加缓冲液,匀浆破碎细胞,测定Na +, K +-ATP 酶、Ca 2+, Mg 2+-ATP 酶的活性。 2.3.2GLP-1含量的测定按“2.3.1”项下进行分组和给药,培养24 h后吸去培养基,再加入3 mmol/L葡萄糖,孵育5 min,小心吸取细胞培养液于EP管内,4 ℃离心10 min,取上清测定GLP-1含量。 2.3.3qRT-PCR和Western blotting测定AQP1、AQP3、T1R2、T1R3mRNA和蛋白表达按“2.3.1”项下进行分组和给药,培养24 h后吸去培养基,按“2.2.7”项下方法测定细胞中AQP1、AQP3、T1R2、T1R3mRNA表达,按“2.2.8”项下方法测定细胞中AQP1、AQP3、T1R2、T1R3蛋白表达。 2.4统计学分析 采用SPSS 19.0软件处理数据,以表示,组间均数比较采用单因素方差分析(One-way ANOVA),组间均数的两两比较采用最小显著差数(LSD)法。 3 结果 3.1 玉竹对阴虚大鼠体质量、体温、摄食量、摄水量、粪便含水率和皮肤含水率的影响 如图1-A所示,“阴虚”会导致大鼠体质量下降(P<0.05);与模型组比较,给予玉竹多糖、总提取物干预14 d后,大鼠体质量明显增加(P<0.05),而“阴虚”动物的体温并未见明显升高(图1-B)。 如图1-C所示,“阴虚”会导致动物的摄水量增加(P<0.05),而玉竹醇溶性成分则“顺应”这种规律,给予醇提取物干预7、14 d,大鼠的摄水量进一步增加(P<0.05),这可能与醇溶性提取物中含有挥发油有关[21];然而给予玉竹多糖14 d后,摄水量显著下降(P<0.05)。如图1-D所示,多糖组大鼠在给药前期(7、14 d)摄食量显著上升(P<0.05),而给药21 d后呈下降趋势,给药28 d摄食量明显下降(P<0.05);这一结果表明,玉竹多糖可能对阴虚动物具有“治疗”作用而出现摄食量增加,但久服多糖可能出现了“滋腻碍胃”效应,降低了大鼠的食欲而致摄食量下降。如图1-E所示,与模型组比较,给予玉竹多糖、总提取物组21 d后,大鼠粪便含水率明显上升(P<0.05);如图1-F所示,与模型组比较,多糖组、总提取物组大鼠皮肤含水率显著升高(P<0.05)。
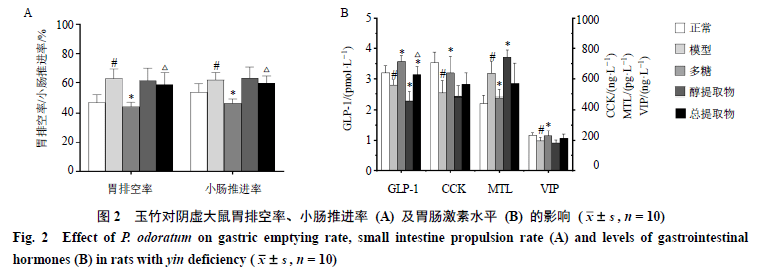
3.2 玉竹对阴虚大鼠胃排空率、小肠推进率和胃肠激素的影响 如图2-A所示,与正常组比较,模型组大鼠胃排空率、小肠推进率显著上升(P<0.05);与模型组比较,多糖组大鼠胃排空率和小肠推进率明显减慢(P<0.05);与多糖组比较,总提取物组大鼠胃排空率和小肠推进率显著增加(P<0.05)。如图2-B所示,与正常组比较,模型组大鼠血清中GLP-1、CCK和VIP含量明显降低(P<0.05),MTL含量显著升高(P<0.05);与模型组比较,多糖组大鼠GLP-1、CCK和VIP含量明显上升(P<0.05),MTL含量显著下降(P<0.05);醇提取物组大鼠GLP-1含量进一步降低(P<0.05),MTL含量却进一步明显升高(P<0.05);与多糖组比较,总提取物组大鼠GLP-1含量明显下降(P<0.05)。
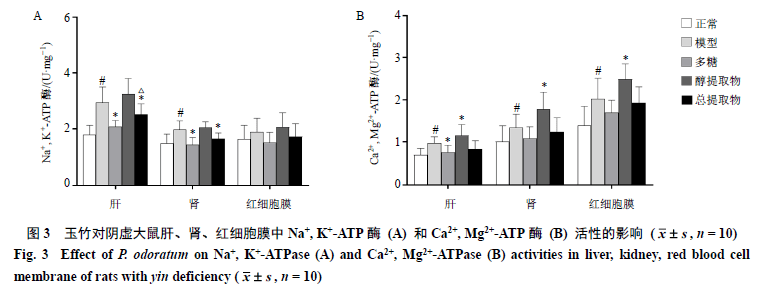
3.3 玉竹对阴虚大鼠肝、肾、红细胞膜中Na + , K + -ATP 酶和Ca 2+ , Mg 2+ -ATP 酶活性的影响 如图3-A所示,与正常组比较,模型组大鼠肝、肾组织中Na +, K +-ATP 酶活性明显上升(P<0.05);与模型组比较,多糖组、总提取物组大鼠肝、肾组织中Na +, K +-ATP 酶明显下降(P<0.05);与多糖组比较,总提取物组大鼠肝组织中Na +, K +-ATP 酶明显上升(P<0.05)。如图3-B所示,与正常组比较,模型组大鼠肝、肾、红细胞膜中Ca 2+, Mg 2+-ATP 酶活性明显上升(P<0.05);与模型组比较,多糖组肝组织中Ca 2+, Mg 2+-ATP 酶活力明显下降(P<0.05),而醇提取物组大鼠肝、肾、红细胞膜中Ca 2+, Mg 2+-ATP 酶活性进一步上升(P<0.05)。
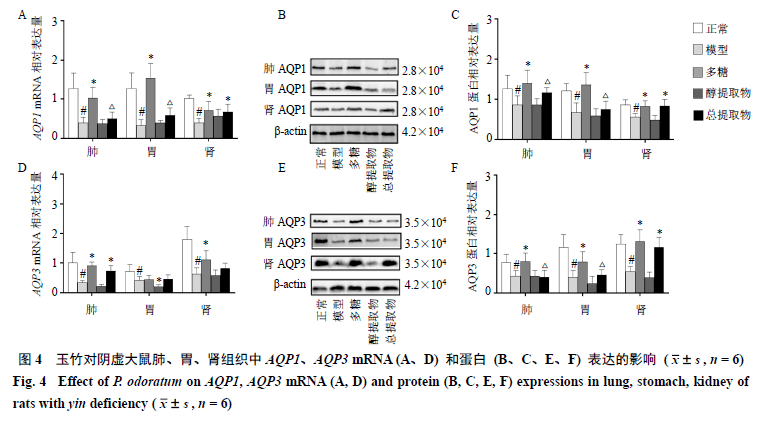
3.4玉竹对阴虚大鼠肺、胃、肾组织中AQP1、AQP3mRNA和蛋白表达的影响 如图4-A、D所示,与正常组比较,模型组大鼠肺、胃、肾中AQP1、AQP3mRNA表达水平均显著降低(P<0.05);与模型组比较,多糖组肺、肾中AQP1、AQP3mRNA表达水平明显上升(P<0.05),醇提取物组胃AQP3mRNA表达水平却显著下降(P<0.05);与多糖组比较,总提取物组大鼠肺、胃中AQP1mRNA表达水平显著下降(P<0.05)。如图4-B、C、E、F所示,与模型组比较,多糖组肺、胃、肾AQP1、AQP3蛋白表达水平均明显上升(P<0.05),总提取物组肾AQP1、AQP3蛋白表达水平明显上升(P<0.05);与多糖组比较,总提取物组肺、胃中AQP1、AQP3蛋白表达水平明显下降(P<0.05)。
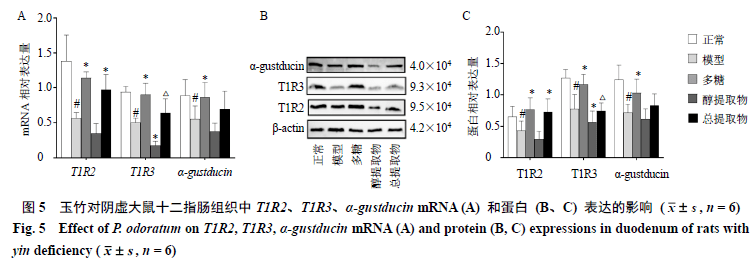
3.5 玉竹对阴虚大鼠十二指肠组织中T1R2、T1R3、α-gustducinmRNA和蛋白表达的影响 如图5-A所示,与正常组比较,模型组大鼠T1R2、T1R3和α-gustducinmRNA表达均显著降低(P<0.05);与模型组比较,多糖组大鼠T1R2、T1R3、α-gustducinmRNA表达均明显升高(P<0.05),而醇提取物组T1R3mRNA的表达则“顺应”阴虚动物的变化规律,表达进一步下降(P<0.05);与多糖组比较,总提取物组T1R3mRNA表达明显下降(P<0.05)。如图5-B、C所示,与正常组比较,模型组T1R2、T1R3、α-gustducin蛋白表达显著降低(P<0.05);与模型组比较,多糖组T1R2、T1R3、α-gustducin蛋白表达明显升高(P<0.05),醇提取物组T1R3表达进一步下降(P<0.05);与多糖组比较,总提取物组T1R3蛋白表达明显下降(P<0.05)。
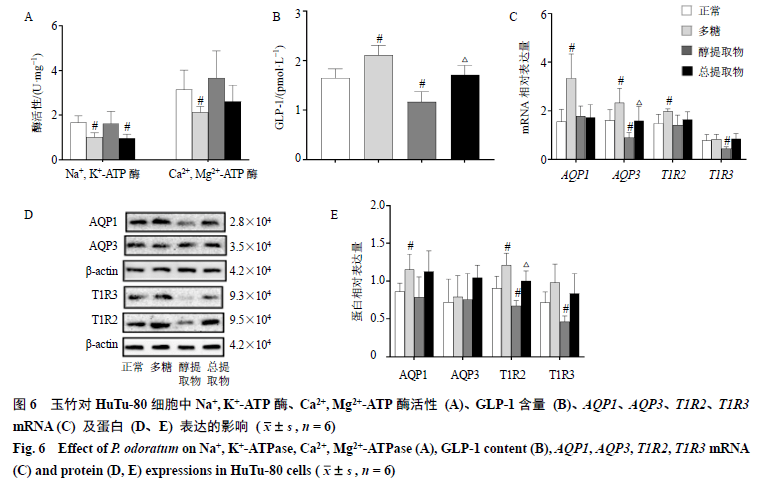
3.6玉竹对HuTu-80细胞中Na + , K + -ATP 酶、Ca 2+ , Mg 2+ -ATP 酶、GLP-1、AQP1、AQP3、T1R2、T1R3的影响 如图6-A所示,与正常组比较,多糖组Na +, K +-ATP 酶、Ca 2+, Mg 2+-ATP 酶活性明显下降(P<0.05)。图6-B显示,多糖可明显促进GLP-1的分泌(P<0.05),而醇提取物则可显著抑制GLP-1分泌(P<0.05);与多糖组比较,总提取物组GLP-1含量明显下降(P<0.05)。如图6-C所示,与正常组比较,多糖组AQP1、AQP3、T1R2mRNA表达水平明显上升(P<0.05),而醇提取物组AQP3、T1R3mRNA表达水平明显降低(P<0.05);与多糖组比较,总提取物组AQP3mRNA表达水平明显降低(P<0.05)。如图6-D、E所示,与正常组比较,多糖组AQP1、T1R2蛋白表达水平明显升高(P<0.05),醇提取物组T1R2、T1R3蛋白表达水平则明显下降(P<0.05);与多糖组比较,总提取物组T1R2蛋白表达水平明显降低(P<0.05)。
4 讨论 补阴药味“甘”,既具“滋补”之效,又有“滋腻”之弊,正如《医学源流论》所云:“补益滋腻之药”。《中医诊断学》认为,阴虚证是指人体阴液亏少,其滋润、濡养功能减退,或阴不制阳,阳气偏亢,以口咽干燥、五心烦热、潮热盗汗为主要表现的虚热证[22]。因此,补阴的“滋补”效应可看作是补阴药对阴液亏少、潮热盗汗等“症状”的缓解作用。本研究将“阴虚”动物的体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率、胃排空率、 小肠推进率、Na +, K +-ATP 酶、Ca 2+, Mg 2+-ATP 酶、GLP-1、CCK、MTL、VIP、AQP1、AQP3、T1R2、T1R3、α-gustducin作为“阴虚指标”。在这些指标中,体质量等15个指标与阴虚均有直接联系[3,23-24], 而GLP-1、T1R2、T1R3、α-gustducin 4个指标与阴虚的直接关联,还有待进一步挖掘;但研究发现GLP-1、T1R2、T1R3、α-gustducin等指标与糖尿病有关联[9,25],而糖尿病常有“阴虚”表现。在确定“阴虚指标”的基础上,将补阴药对阴虚模型动物阴虚指标的“逆转”作用确定为“滋补”作用,如“逆转”超出一定程度,即为“滋腻”作用。因此,“滋腻”不只是与胃肠蠕动减慢有关,还与其他因素有关,如AQP蛋白的表达超出一定范围,水湿停滞,也易“滋腻”。 动物模型的合理性、可重复性是中医药研究科学性、可靠性的重要保障。目前“阴虚证”动物模型的构建主要包括“模拟阴虚证临床表现、模拟阴虚证病因病机、模拟阴虚临床高发病”3种方法[26]。采用甲状腺素激素构建阴虚证即属于“模拟阴虚证临床表现”的造模方法,而采用四氯化碳导致肝炎进而出现“阴虚”,即属于“模拟阴虚临床高发病”的造模方法。本研究采用热性中药制备阴虚模型,属于“模拟阴虚证病因病机”的造模方法。《素问·阴阳应象大论》云:“阳盛则阴病”,且玉竹是典型的补阴药,主要用于胃阴虚、肺阴虚,因此ig热性中药,易导致“胃阴虚”。实验中发现,大鼠长期ig热性中药后“阴虚”症状明显,无死亡现象,重复性较好。需要指出的是,ig热性中药可能是“实热”,也可能是“阴虚(内热)”。本研究发现,造模前期,大鼠出现烦躁、易怒等“实热”症状,但“久服”热性中药后,大鼠摄水量增加,皮肤干燥,而体温却未见明显变化,表明出现了“阴虚(内热)”。 甜味受体分布广泛,激动肠道甜味受体可促进肠道L细胞分泌GLP-1。GLP-1不仅可促进胰岛素分泌,还能抑制食欲减缓胃排空[27]。因此,GLP-1体现了“滋补”、“滋腻”2种相反效应。本研究中,阴虚大鼠GLP-1的分泌下降,胃肠道蠕动能力增强,这也与胃排空与小肠推进率实验结果一致;给予玉竹多糖干预后,GLP-1分泌明显增加,而与多糖组比较,总提取物组大鼠GLP-1明显下降。从GLP-1的效应分析,服用玉竹多糖后GLP-1的分泌量明显增加,在发挥“滋补”作用的同时,也必然出现胃肠蠕动减慢等“滋腻”效应;服用由多糖、醇提取物组成的玉竹总提取物,其中的多糖促进GLP-1的分泌,而其中的醇提取物则抑制GLP-1的分泌。这可能是玉竹治疗阴虚证“补而不腻”的主要机制。同时,本研究还发现,阴虚会导致T1R2、T1R3的表达降低,玉竹多糖、玉竹醇提取物对T1R2、T1R3的表达均有作用,但作用相反;在细胞实验中T1R2、T1R3的表达也有相似的规律。可见,玉竹醇提取物可部分抵消玉竹多糖对甜味受体表达的作用,这可能是玉竹“补而不腻”主要物质基础。 课题组前期研究玉竹多糖对糖尿病大鼠甜味受体的影响,结果显示,玉竹多糖对甜味受体T1R2、T1R3的表达有促进作用[28];结合本实验结果推测,玉竹多糖可能通过上调甜味受体的表达,并在内源性甜味剂——葡萄糖的参与下,促进GLP-1的分泌;换句话说,玉竹多糖可能是甜味受体的诱导剂,而非激动剂,因此本实验未考察玉竹多糖与甜味受体激动剂/抑制剂合用后的效应;与玉竹多糖不同,玉竹醇提取物中含有的物质可能是甜味受体抑制剂,能下调甜味受体的表达;还可能既是抑制剂又是拮抗剂,在下调甜味受体表达的同时还能阻断激动剂与之结合。课题组已从玉竹醇提取物中分离纯化了“玉竹皂苷”(质量分数为63.5%),并考察了玉竹皂苷单用及与甜味受体抑制剂Lactisole合用时对GLP-1分泌的影响;接下来,将进一步研究“玉竹醇提取物”中另一种成分——玉竹黄酮对甜味受体及GLP-1的作用。 研究表明,甜味受体与AQP、Na +, K +-ATP 酶、Ca 2+, Mg 2+-ATP 酶存在关联,AQP的功能主要是是介导水的转运[29]。研究发现,皮肤中的AQP3表达与阴虚皮肤干燥存在一定联系[30];本实验中,阴虚大鼠肺、胃、肾中AQP1、AQP3表达降低,给予多糖后,AQP1、AQP3表达升高,而给予醇提取物后,胃、肾AQP3的表达在模型组的基础上进一步降低;细胞实验中的玉竹多糖、醇提取物对AQP1、AQP3表达也呈现与整体动物相似的规律。研究还发现,甲状腺功能亢进、糖尿病等“阴虚”证Ca 2+, Mg 2+-ATP 酶的活性也会发生相应改变[31]。本研究中,与模型组比较,多糖组大鼠肝Ca 2+, Mg 2+-ATP 酶活力明显下降,醇提取物组大鼠肝、肾、红细胞膜Ca 2+, Mg 2+-ATP 酶活力明显上升。本实验结果表明,玉竹多糖与玉竹醇溶性成分对Ca 2+, Mg 2+-ATP 酶活力的影响也可能存在“相反”效应,即玉竹醇溶性成分可在一定程度上“抵消”了玉竹多糖对Ca 2+, Mg 2+-ATP 酶活性的“抑制效应”。以上研究表明,玉竹多糖、玉竹醇溶性成分对AQP、Ca 2+, Mg 2+-ATP 酶的作用的方向“相反”,这可能也是玉竹“补而不腻”的机制之一。 进一步分析发现,玉竹对GLP-1、T1R2、T1R3、AQP、Ca 2+, Mg 2+-ATP 酶等阴虚指标具有“双向调节”作用;事实上,玉竹“既能滋阴又能增长阳气”[32],这就是玉竹的“双向调节”作用的中医表述。双向调节是指当机体处于失衡状态时,采用同一药物或方剂治疗后,既能使机体从亢进状态向正常状态转化,亦可使机体从低下状态向正常状态转化[33]。需要注意的是,机体从“失衡状态”到“正常状态”的转变,也可能是基于机体的“自然恢复性”。本文结果表明,模型组与给药组的阴虚指标在 “数值 ”上存在较大的差别。因此推断,玉竹对GLP-1、T1R2、T1R3、AQP、Ca 2+, Mg 2+-ATP 酶等阴虚指标具有“双向调节”作用,其机制可能与玉竹同时含有多糖、醇提取物等“多成分”有关。 综上,玉竹多糖通过上调甜味受体的表达,促进GLP-1分泌,“逆转”了AQP、Na +, K +-ATP 酶等阴虚指标,从而发挥“滋补-滋腻”正反效应,而醇提取物则部分抵消多糖对GLP-1、T1R2、T1R3、AQP、Ca 2+, Mg 2+-ATP 酶等指标的逆转效应,故玉竹总体上呈现“补而不腻”。由于目前尚无公认的用于治疗阴虚证的药物,且基于“甜味受体”治疗阴虚证的药物缺乏,本研究未设置阳性对照组。本研究从“成分”出发,分析比较玉竹中各成分对“阴虚指标”的作用方向及作用强度,从“甜味受体”一个角度,同时阐明玉竹“滋补-滋腻-不腻”,即“补而不腻”的作用机制,为玉竹、补阴药、甘味药的功效阐释提供新思路,丰富并助推了五味理论的传承与发展。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 来 源:欧阳征海,吴 璐,李 婷,邓碧莲,肖 音,杨华生.从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制 [J]. 中草药, 2023, 54(10):3179-3188.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |