实用贴 |
您所在的位置:网站首页 › 特朗普拒绝搬出白宫会怎样 › 实用贴 |
实用贴
|
简介: 血球计数板(haemocytometer)是一种很常见的生物学工具,相信在做微生物、细胞培养等方面研究的小伙伴一定不陌生。它除了被用于对人体内红、白血球进行显微计数之外,也常常用来计算一些细菌、真菌、酵母等微生物的数量。今天小编就给大家详细介绍一下血球计数板的使用和计算方法。 血球计数板是19世纪法国解剖学家(anatomist)Louis-Charles Malassez 最先发明的,当时他用来计量血细胞。由图1 可见,血球计数板是一块特制的厚型载玻片(thick glass microscope slide),中间有四条垂直的槽沟,形成了三个分开的平台。中间的平台又被分成两半,很像H形,每个半边上面各刻有小方格网,称为上、下计数池(top & bottom counting chamber)。方格网的尺寸是已知的,所以先要测定每个小方格中微生物的数量,再换算成每毫升菌液(或每克样品)中微生物细胞的数量。
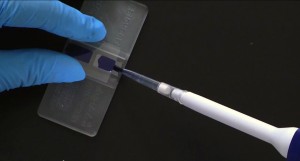
图1:一款常见的血球计数板 点样: 在使用前,大家一定要用擦镜纸(lens paper)仔细除去血球计数板(载玻片)和盖玻片(coverslip)上的灰尘颗粒。这里提到的盖玻片比平时大家用于显微镜的普通盖玻片要厚,这是为了克服液体的表面张力(surface tension)而特意设计的。在确定盖玻片放好在H形平台之后(小编亲测,哈哈气最管用),把吸管尖(pipette tip)平稳的放在计数池的V形凹槽内,缓慢的推出细胞样品(如图2所示)。在毛细现象(capillary action)的作用下,盖玻片底下的区域会被样品覆盖。通常10 µl 左右液体就足够覆盖半个计数池,注意不要点样过多。上、下计数池可以点同一个样品或是不同样品,看大家的需要。小编一般会点上相同的样品,这样计量的数据更可靠。
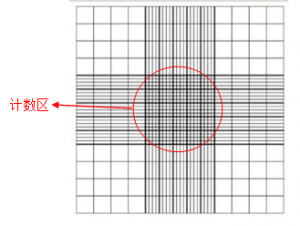
图2:在血球计数板上点样 点样之后,大家就可以把它平稳的放在显微镜的载片台(microscope stage)上。这个时候就不要再碰盖玻片了,否则气泡的产生会对准确计量造成一定的困难。显微镜的使用小编在这里就不多做介绍了,相信每个实验室都有自己熟悉的实验步骤和方法。 计算: 由图3所示,计数池一共由9个大的正方格组成,每一个的面积为1 mm2。其中最中间的正方格(被称为计数区)由25个中方格组成,而每个中方格又被分为16个小方格。另外一种的划分略有不同,计数区被分为16个中方格,而每个中方格又分成25个小方格。但是不管计数区是哪一种构造,它们都有一个共同特点,就是计数区一共由400个小方格组成。在数细胞前,一般要制定一个规矩,例如只计入压在小正方格上线和左线的细胞,而不计入下线和右线的细胞,这样可以避免重复计量而过高估计(overestimate)细胞的数量。
图3:计数池的划分 大家需要适当稀释样品,这样细胞才能均匀分布在计数池上,不会出现互相重叠而导致数据不准确的情况。根据实验经验,应该保证每次数的细胞数量至少在100个以上,才是具有统计意义的数据(statistically significant)。
图4:血球计数板正面图和侧面图 计数区边长为1mm,所以面积是l mm2,每个小方格的面积是1/400 mm2。盖上盖玻片后,计数区的高度是0.1 mm (由图4侧面图所示),所以一个计数区的体积是0.1mm3 或是100 nl。也就是说大家从计数区数出的细胞数量是体积为100 nl(10-4 ml)的样品的。通过以下公式就可以换算出每毫升细胞的数量了: 总细胞浓度 (细胞/ml)= 当然,以上方法是针对较小的细胞;对于稍微大一些的细胞的话,大家可以选择计数池四个角落的方格和最中间的方格同时计量,但要记得在计算过程中除以方格的数量。如果细胞再大的话,也可以考虑使用其他计数板,例如赛吉计数筐(Sedgwick-Rafter Cell Counting Chamber)。 图片来自网络,内容由BioEngX原创,转载请注明! 扫描下方二维码关注BioEngX官方微信公众平台
|
【本文地址】
今日新闻 |
推荐新闻 |