QbD“质量源于设计”在制药生产中的应用 |
您所在的位置:网站首页 › 满足质量要求是什么的目的 › QbD“质量源于设计”在制药生产中的应用 |
QbD“质量源于设计”在制药生产中的应用
|
QbD的应用 目前人们对QbD的关注日益加深。在药品注册前期,许多公司在工艺研发阶段投入了大量的精力和资金进行研究,其目的是在研究中形成建立“设计空间”所需的科学基础,并从中找出存在于物料和生产工艺中的一系列变量,使得工艺参数由“固定的”转变为“可变的”(如图1、2所示)。对工艺参数产生如此优化和提升的关键是,对工艺的深入和透彻理解。这样,药企就可以通过QbD的应用,减少药品生产的质量风险,降低生产成本,缩短投资回报时间。
图1 传统生产模式
图2 应用QbD生产模式 结合药品开发要素及流程(见图3):
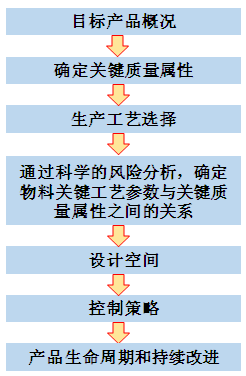
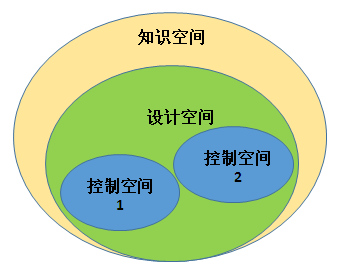
图3 药品开发要素 我们可以拓展得到,QbD理念在产品生命周期中的实施应用过程: (1)目标产品概况-定义目标产品的用途和预定义产品质量(如临床关联性、功效、安全性)。对于口服速释固体制剂而言,典型的目标产品概括一般包括性状、鉴别、含量或含量均匀性、纯度或有关物质、溶出度等; (2)工艺概括-列出对物料操作的不同单元。如称量、粉碎、制粒、总混、压片、包衣、包装等; (3)知识-对工艺知识(物料处理工艺、操作单元选择等)进行总结,通过初始风险分析来确定关键质量属性和关键工艺参数; (4)工艺研发-借助DoE(Design of Experiments,DoE,实验设计),PAT,RA(Risk Assessment,RA,风险分析)和风险控制等工具来深入研究。使用这些实用性较强的方法和技术,将会提高对产品和工艺的理解; (5)空间设计-总结对物料和工艺的理解,判断和描述质量保证的多维空间; (6)控制策略-在设计空间内确定控制策略,以指导商业化生产; (7)持续改进-基于对产品和工艺知识的理解和质量风险管理(物料、位置、范围等),对生命周期管理提出意见和改进,保证产品质量的稳定性。 在应用“质量源于设计”时,以下三个关键因素需要关注:工艺理解,设计空间,工艺改进。 3.1 工艺理解 依照QbD理念,产品的质量不是靠最终的检测来实现的,而是通过工艺设计出来的,这就要求我们在生产过程中对工艺过程进行“实时质量保证”,保证工艺的每个步骤的输出都是符合质量要求的。 要实现“实时质量保证”,就需要在工艺开发时明确关键工艺参数,要充分理解关键工艺参数的形成及其与产品关键质量属性之间的关系,即关键工艺参数是如何影响产品关键质量属性的。这样在大生产时,只要对关键工艺参数进行实时的监测和控制,保证关键工艺参数是合格的,就能保证产品质量达到要求。比如:湿法制粒工序时中的混合转速和时间、粉碎转速和时间;总混工序中的混合转速及时间等。 3.2 设计空间 通过对知识空间的风险评估和对试验方法、文件资料的研究,我们可以界定出相应的设计空间。设计空间是指一个可以生产出符合质量要求的参数空间。设计空间的优势在于为工艺控制策略提供一个更宽的操作面,在这个操作面内,物料的既有特性和对应工艺参数可以无需重新申请进行变化,因此,在设计空间范围内改变操作无需申报,如设计空间与生产规模或设备无关,在可能的生产规模、设备或地点变更无需补充申请。 控制空间、设计空间、知识空间之间的关系如图4所示。
图4 空间关系图 其中: 控制空间-常规操作范围; 设计空间-已证明的接受范围; 知识空间-先验知识(公开领域或内部文件)、生产经验、药物开发研究、传统的实验设计、生产经验、工艺理解等。 工艺开发得到的生产工艺可能具有多个控制空间,不同的控制空间有不同的控制策略,这些控制空间总称为知识空间。 ICH Q8对控制策略的定义为“源于对现有产品与工艺的理解,确保工艺性能与产品质量的一系列有计划的控制。这些控制包括:药用物质、制剂产品与成分、设施与设备操作条件、过程中间控制、成品标准以及与之相关的方法、监测频率等相关的参数与属性”。所有产品的质量属性和工艺参数,无论其是否被归类为关键,均属于控制策略范畴。建立有效、适当的控制策略是药品开发阶段的重要任务之一。控制策略的制定是以前期获得的知识与经验为基础的,其过程有效性体现在对生产工艺的受控性进行指示,而其最终的目的是保证生产出的产品符合工艺要求。控制策略是基于对工艺的风险分析与管理而建立的。控制策略因素包括:原料控制、中间产品与放行标准、性能参数、工艺参数设置点与范围、工艺监测以及保存时间等。在知识空间范围内,采用任何一种可能的控制空间都能生产出符合要求的产品。企业可以从诸多的控制策略中选择适合于自身的一个,以满足其商业生产。 3.3 工艺改进 持续地改进和提高是QbD理念的一部分,这样做会提高实际生产中的灵活性,并且使得关键技术能够在研发和生产之间得到交流。此外,通过对商业生产数据的评估,可以确定工艺改进的最佳方式。QbD的实施是团队努力对已有工艺改进的结果,工艺的改进最终增加了对工艺的理解,减少工艺的变异并实时保证质量。 如果CQA的变异不在可接受的范围内,就要进行调查分析,找出原因并实施改进纠正措施。改进后的控制策略若不在现有的控制空间内,那就会产生新的控制空间,新的控制空间以在原有的设计空间内为宜。 如果知道导致CQA产生变异的原因,可以使用现有的质量标准或操作规程对修改后的工艺进行测试,以证明新的控制策略达到了目标效果。新的工艺测量方法可能需要更先进的能够对CQA进行在线实时检测的仪器。这些来自于PAT的实时检测数据具有“实时质量保证”的作用。通过类似于SPC(Statistical Process Control,SPC,统计过程控制)控制图或其他方式来判断一个工艺是否稳定于有效的控制中。例如:过程能力与过程性能分析以及相应的指数CPK和PPK,过程监控等都是常见的分析数据的方法。 4 应用QbD的意义 将科学的基于风险的方法应用于产品、工艺研发和生产中,可以使生产资源得到更清晰的优化。同时,理解产品和工艺设计,并且将这些理念与患者需求相联系,这将会对提高企业生产效率和工艺能力有较大的帮助。依照QbD原则进行新药和已上市产品的工艺研究,可以更加科学地保证药品质量、降低监管风险,使药品开发、生产和监管更好地、可持续地满足人民群众对药品安全性、有效性的需求。而鉴于QbD理念推出不久,体系还需要通过理论研究和实践进行完善,这也为我国制药行业监管和参与规则制定方面提供了很好的机会。 将质量源于设计的理念有效地应用于药品的研发、生产、审评和监管,不但对提高药品的质量,而且对创新药在中国的发展,都有其现实意义和深远的历史意义。 5 参考文献 [1] ISPE PQLI Guide Series: Part 1 Product Realization using Quality by Design (QbD) : Concepts and Principle, 2011 [2] ISPE PQLI Guide Series: Part 2 Product Realization using Quality by Design (QbD) : Illstrative Example, 2011 [3] 人用药物注册技术要求国际协调会,一致性指南文件(草稿),药物开发 Q8, 2004年11月18日 [4] 美国注射剂协会,Technical Report No. 60,2013 [5] 仲晓燕,梁毅. 实施“质量源于设计”的五个关键因素. 机电信息,2011年,第23期返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |