国产硝苯地平缓释片的体外溶出度和虚拟生物等效性研究 |
您所在的位置:网站首页 › 溶出曲线图绘制 › 国产硝苯地平缓释片的体外溶出度和虚拟生物等效性研究 |
国产硝苯地平缓释片的体外溶出度和虚拟生物等效性研究
|
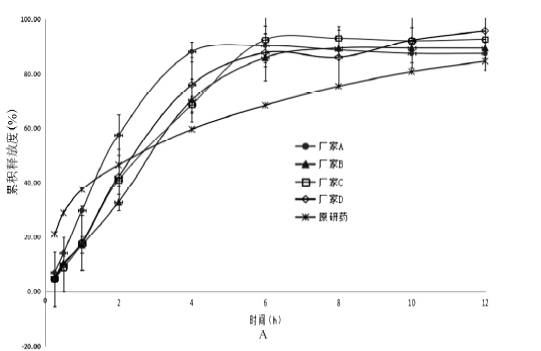
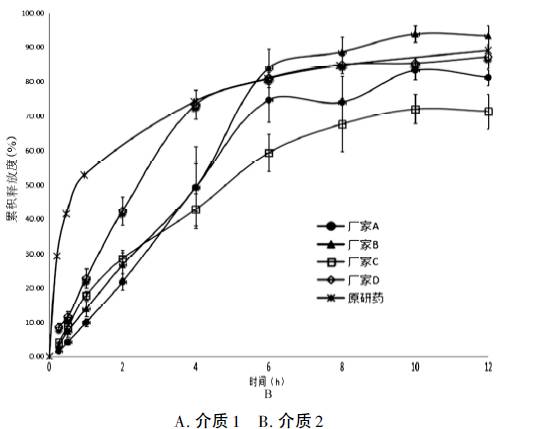
该软件已受到FDA等多国药监部门及企业的高度认可,广泛应用于药物的体内外相关性、种属间外推以及处方筛选评价。 本文以硝苯地平缓释片为模型药物,将原研制剂(德国拜耳医药有限公司,规格:20mg/片)的体外溶出度数据与GastroPlus软件结合计算得到模拟的药物体内吸收曲线,通过与文献实测值比较,选择体内外相关性良好的溶出度测定方法,再用该方法进行国产硝苯地平缓释片的溶出曲线测定,进而模拟得到国产制剂的体内吸收曲线,进行仿制药与原研药的虚拟生物等效性评价。 仪器与试药 1 仪器 Agilent1100高效液相色谱仪,包括G1322A型真空脱气机、G1312A 两元泵、G1329A 型自动进样器、G1316A型柱温箱和G1315B 型检测器( 美国Agilent 公司) ; RC8MD 溶出实验仪( 天津市天大天发科技有限公司) ; BP211D 型十万分之一天平( 德国Sartorius 公司) ; Heal Force 型超纯水仪( 上海市Canrex 仪器有限公司) 。 2 试药 硝苯地平对照品(中国食品药品检定研究院,批号:100338-201404,量:99.9%);硝苯地平缓释片(A厂家,规格:20mg/片,批号:150708;B厂家,规格:20mg/片,批号:96150801;C厂家,规格:10mg/片,批号:141201;D厂家,规格:10mg/片,批号:150601);甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。 方法与结果 1 体外溶出曲线的绘制 1. 色谱条件 色谱柱:DiamonsilC18柱(200mm×4.6mm,5μm);流动相:甲醇-水(7∶3);流速:1.0ml·min-1;柱温:25℃;采用DAD检测器;检测波长:235nm;进样量:20μl。 2. 溶出度测定 分别按中国药典2015年版收载的溶出度测定法(桨板法,转速:120r·min-1,介质1:0.25%十二烷基硫酸钠溶液,介质体积:900ml,介质温度:37℃)和日本橙皮书收载的溶出度测定法(桨板法,转速:75r·min-1,介质2:0.3%吐温-80溶液,介质体积:900ml,介质温度:37℃),在0.25,0.5,1,2,4,6,8,10,12h分别取5ml溶出介质(同时补充5ml新鲜溶出介质),滤过,弃去初滤液,取续滤液20μl进行HPLC法测定。 硝苯地平缓释片在不同溶出度测定方法下的溶出曲线见图1。
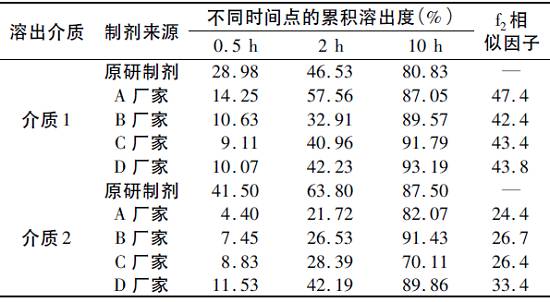
图1 不同溶出条件下的体外溶出曲线( n =6) 由图可见,原研制剂在介质1中的释放与4种国产制剂相比先快后慢,而在介质2中的释放整体比国产制剂迅速,尤其是前4h内的差异较明显。 采用溶出曲线相似性f2因子法对不同制剂在同一种介质中的溶出曲线进行比较,取样时间点为0.5,2,10h(分别对应于原研制剂释放度为30%、50%和80%的取样点)。 结果表明,4种国产制剂与原研制剂相比较,在介质1中f2均大于42,但每个时间点的累积溶出度相差较大,溶出行为不相似;在介质2中f2均小于35,溶出行为也不相似,具体见表1 表1 f2相似因子计算结果
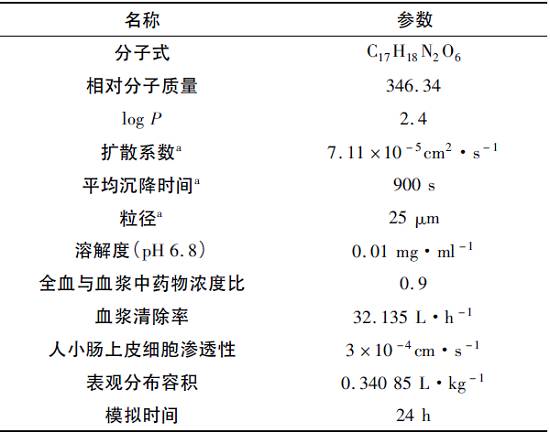
2 虚拟生物等效性研究 1. GastroPlus基础模型的搭建 根据文献报道,收集硝苯地平理化参数及药代动力学参数,包括相对分子质量、渗透性系数、油水分配系数、肝清除率等(表2),通过GastroPlus软件生理药动学处置模型模拟静脉注射1mg硝苯地平后药物在体内的转运、分布、代谢情况,得到模拟的体内药时曲线,然后与实测的硝苯地平静脉注射体内药时数据进行比较,验证处置模型的准确性。 表2 基础模型参数
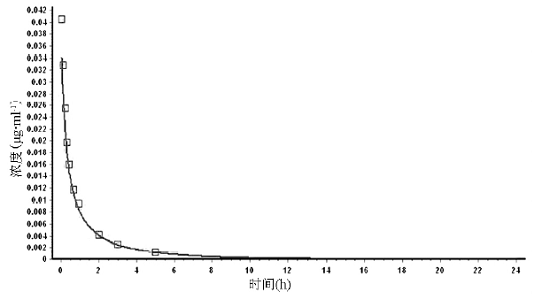
注: a为GastroPlus软件预测值或默认值。 图2中点为实测值,曲线为软件模拟值,R2=0.9300。说明该模型中用到的各参数符合硝苯地平药物本身在体内的代谢清除规律,模拟结果可反映体内真实情况。 因此,该模型用到的参数可进一步用于体内外相关性模型的建立。
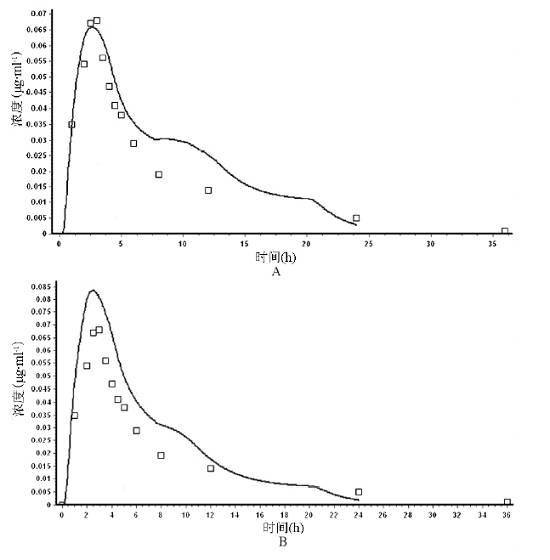
图2 实测及模拟的硝苯地平注射液的体内药时曲线 2 硝苯地平缓释片的体内外相关性评价收 集原研制剂的体外溶出数据及体内药时数据。将基础模型数据与原研制剂在介质1和介质2中的体外溶出数据同时加载入GastroPlus软件,得到硝苯地平缓释片的体内模拟数据,并与实测数据进行相关性研究。 选择体内外相关性较好的溶出方法,用于模拟4种国产硝苯地平缓释片的体内吸收曲线,进行模拟生物等效性评价。 图3A为原研制剂在介质1中的模拟体内吸收曲线,体内外相关性系R2=0.9170;图3B为原研制剂在介质2中的模拟体内吸收曲线,体内外相关性2=0.8170。 由图可见,采用中国药典方法所得体外溶出曲线模拟的体内药时曲线与实测值更接近,IVIVC方程为:Y=0.019+1.23×10-3X+1.776X2-0.891X3,其中X为体外溶出值,Y为体内溶出值。由GastroPlus软件的胃肠道吸收模型分析可知
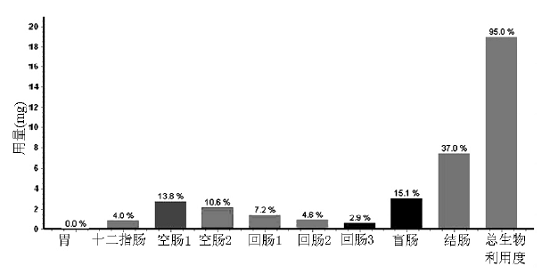
A.介质1 B.介质2 图3 实测( 点) 及模拟( 线) 的硝苯地平缓释制剂的体内药时曲线 ( 图4) ,原研硝苯地平缓释片在体内的主要吸收部位为空肠( 24.4%) 、回肠( 14.7%) 、盲肠( 15.1%) 、结肠( 37.0%) ,总生物利用度达95%。 因该药在各肠段均吸收良好,吸收速率不是硝苯地平吸收的限速步骤,各肠段吸收量的差异应与制剂的溶出和滞留时间有关。
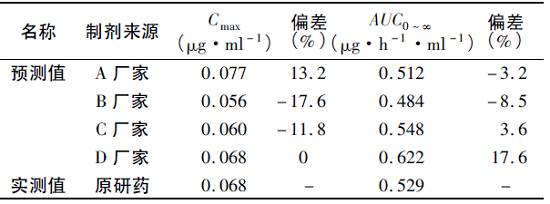
图4 模拟胃肠道各部位吸收情况 3 硝苯地平缓释片的模拟生物等效性 将4种国产硝苯地平制剂在介质1中测定的体外溶出数据加载入所建立的GastroPlus基础模型中,模拟人体空腹状态下体内药时曲线,得到Cmax和AUC0~∞的预测值。 单次模拟试验的Cmax和AUC0-inf值与参比制剂的实测值进行比较,见表3。 表3 模型预测结果
注: 由于C厂家和D厂家制剂与原研制剂规格不一致, 故将预测得到的Cmax和AUC0~∞进行了剂量校正。 可见,4种国产制剂的Cmax和AUC0~∞预测值与原研药实测值相差在±20%之内。 由500名志愿者虚拟的群体试验结果显示,Cmax和AUC0~∞均值的90%置信区间也落在原研药的80%~125%内,故可认为4种国产制剂与原研制剂生物等效。 讨 论 固体制剂的生物等效性研究和体外溶出试验是评价仿制药质量一致性的两个基本方法。 前者直接反映制剂的体内吸收效果,是评价质量一致性的重要标准,但试验成本较高;而体外溶出试验能在一定程度上模拟体内胃肠道pH及运动状态,且具有简便、廉价、高效等特点,已成为评价一种药物制剂不同厂家或不同批次之间产品质量的重要工具。 如果药物体外溶出和体内吸收之间能建立较好的相关性,仅通过体外溶出数据就能够准确预测药物的口服吸收,将会大幅度提高药品研发效率,节省大量资源。 因此找到既有区分力又有良好体内外相关性的溶出方法是进行仿制药一致性评价研究的关键环节。 硝苯地平为低溶度、高渗透性的BCSⅡ类药物,溶出速率是影响吸收的关键因素。 本文选择硝苯地平缓释制剂为研究对象,收集到国内上市的4种制剂,首先进行了体外溶出曲线的考察。 鉴于日本对制剂溶出行为的考察比较重视,且日本开展仿制药质量再评价工作较早,已经形成一套完善的理论体系,日本橙皮书收载的溶出方法比较权威,而中国药典方法是本国制剂考察的法定标准,本文选择了日本橙皮书和中国药典的方法进行硝苯地平缓释制剂的体外溶出行为考察。 由于原研制剂目前在国内买不到,其溶出曲线仅来自文献,溶出数据应用DIG软件从溶出曲线图中转换得到。 结果表明4种国产制剂与原研制剂之间的体外溶出都有明显差异。 但这种体外溶出的差异能否反应体内吸收的差异,需要进行体内外相关性研究进行确认。 近年来随着计算机技术的发展,基于药物的理化性质和人体胃肠道特征建立体内吸收模型的研究软件为制剂体内外相关性研究提供了便捷的途径。 本文选择了基于生理药动学模型GastroPlus软件预测待测药物的体内吸收,首先用文献报道的原研制剂的体内外数据建立IVIVC模型,筛选出较优的体外溶出方法。 再应用该溶出条件下的溶出数据进行国产制剂的体内吸收参数预测,再和原研制剂的实测值进行虚拟等效性研究。 结果,体外溶出差异显著的国产硝苯地平缓释制剂所得到的药动学参数Cmax和AUC0~∞预测值却与原研制剂的实测值较接近,生物模拟等效,说明所选择的溶出条件可能过度区分了制剂间的差异。 溶出行为不相似而体内生物等效的情况也是存在的。 分析其原因,是因为硝苯地平在各个胃肠段的吸收均较好,无明显吸收窗,只要在吸收区间内制剂能完全释放,制剂在某一肠段间的溶出差异并不影响制剂的整体吸收情况,但该推测与结论尚需要进一步的体内试验加以验证。 请复制以下链接,下载PDF版原文。 http://pan.baidu.com/s/1qXD1uKO 说明 来源:中国药师 China Pharmacist 2017,Vol. 20 No.5 本文由凡默谷原创排版与编辑,如转载,请注明来源。返回搜狐,查看更多 |
【本文地址】