NK细胞的CD107a检测,也适用于CD8+T |
您所在的位置:网站首页 › 流式检测原理是什么 › NK细胞的CD107a检测,也适用于CD8+T |
NK细胞的CD107a检测,也适用于CD8+T
|
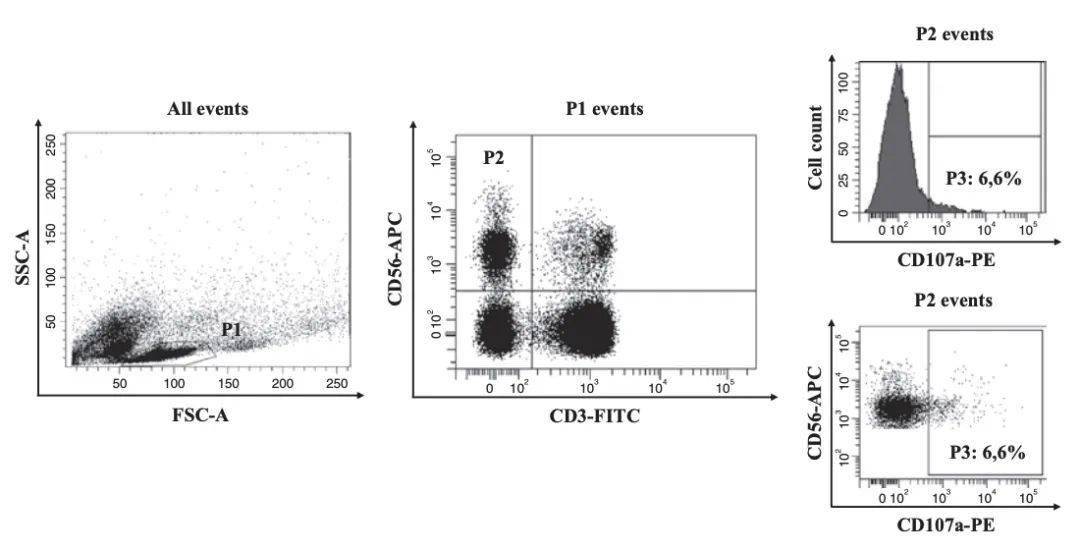
原标题:NK细胞的CD107a检测,也适用于CD8+T 自然杀伤 (NK) 细胞是免疫细胞的一个亚群,在固有免疫反应中发挥核心作用,能够消除正常的应激细胞,例如病毒感染的细胞以及恶性转化的细胞。 NK 细胞活性由通过其表面表达的激活和抑制受体转导的信号的平衡来调节,与 T 细胞相比,NK的激活不需要事先的抗原启动。在这一系列调节受体中,NKG2D是调节 NK 细胞功能的关键受体。在人类中,NKG2D 配体包括应激调节分子,例如 MHC I 类多肽相关序列 A/B (MICA/B) 和 UL16 结合蛋白 (ULBP) 分子,它们在肿瘤细胞表面过度表达。 溶酶体相关膜蛋白-1(CD107a 或 LAMP-1)是一种存在于溶酶体中的高度糖基化跨膜蛋白。在 NK 细胞和细胞毒性 T 细胞中,CD107a 是溶细胞颗粒中最丰富的蛋白质之一,位于囊泡膜的内层,其高度糖基化的部分隐藏在腔侧,短尾暴露于细胞质。脱颗粒结束时,颗粒的外膜与 NK 细胞膜合并,导致 CD107a 分子暴露于表面,是保护效应细胞免受脱颗粒相关自杀的机制。 CD107a在膜上的表达被认为是活化细胞毒性淋巴细胞的标志物,包括 CD8+ T 细胞和 NK 细胞。通过流式细胞术分析评估CD107a的表达与 NK 细胞细胞毒活性和细胞因子分泌之间存在直接相关性,故CD107a成为评估针对各种刺激的免疫细胞细胞毒反应的可靠测定方法,也被提议作为一种诊断细胞毒性遗传疾病的方法,NK细胞脱颗粒缺陷是某些疾病预后不良因素。 CD107b/LAMP-2 和 CD63/LAMP-3 是与 CD107a 属于同一家族的,也存在于 NK 细胞和细胞毒性 T 细胞的溶解囊泡膜中。与 CD107a 相比,NK 细胞活化导致的 CD107b 表面暴露程度较弱,并且 CD63 膜表达与 NK 细胞中的活化没有明显相关性,所以这两个分子并不是NK 细胞脱颗粒的可靠标志物。 与其他检测方法相比,通过检测表面 CD107a 来测量 NK 细胞的活化具有几个优点。最重要的是,该方法提供了有关效应群体的直接信息,而细胞毒性测定仅检测靶细胞的最终裂解。此外,CD107a 的标记允许根据激活水平区分多个 NK 细胞亚群。然而,该测定应辅以 NK 细胞细胞毒性和/或细胞因子产生测定的检测,以便更深入地了解针对给定刺激发生的免疫机制。 下面介绍一下用 流式细胞术检测NK细胞CD107a表面表达的详细方案。同样,该方法也 适用于检测 CD8+ T 细胞中的 CD107a。 步骤 1.培养K562细胞,从血样中用Ficoll提取PBMC。 2.将K562和PBMC均离心去上清,细胞沉淀重悬于新鲜的完全培养基中。将K562细胞浓度调整为10E6个细胞/mL,将PBMC浓度调整为10E7个细胞/mL,以获得 10:1 的效靶比(E:T)。 3.设置三组:基础脱颗粒水平组(100ul PBMC + 100ul 培养基)、共培养组(100ul PBMC + 100ul K562)、阳性对照组(100ul PBMC + 100ul含100 ng/mL PMA 和 2 μg/mL 离子霉素的培养基)。按三组的设置,加入到96孔U形板中,这样,每孔均为200ul总体积。 4.紧接着,在每孔中加入 10 μL 抗人 CD107a 抗体,并在 37 °C 和 5% CO2 下孵育 4 h。 5.在第4步的孵育过程中,切记在孵育1小时的时候,将2μL GolgiStop加到75μL培养基中制备成莫能菌素溶液,然后将该溶液按照每孔5μL的量加入96孔板中,并通过枪头吹打混合。 6.就这样,总共孵育4小时后,将每个孔的液体分别转移到5 mL流式管中,用 1× PBS 洗涤细胞两次(室温下以 400×g 离心 5 分钟)。 7.各管分别加入区分T和NK的系列特异性抗体:5μL抗人CD3抗体、5μL抗人CD56抗体。轻轻震荡混匀,室温下孵育25分钟。 8.孵育结束后,用 1× PBS 洗涤细胞(室温下以 400×g 离心 5 分钟)。去上清,将细胞沉淀重悬于 300–400 μL 1× PBS 中。将细胞保持在冰上并避光,直到上机采集。 展开全文结果分析
↑设门步骤,基础脱颗粒水平组
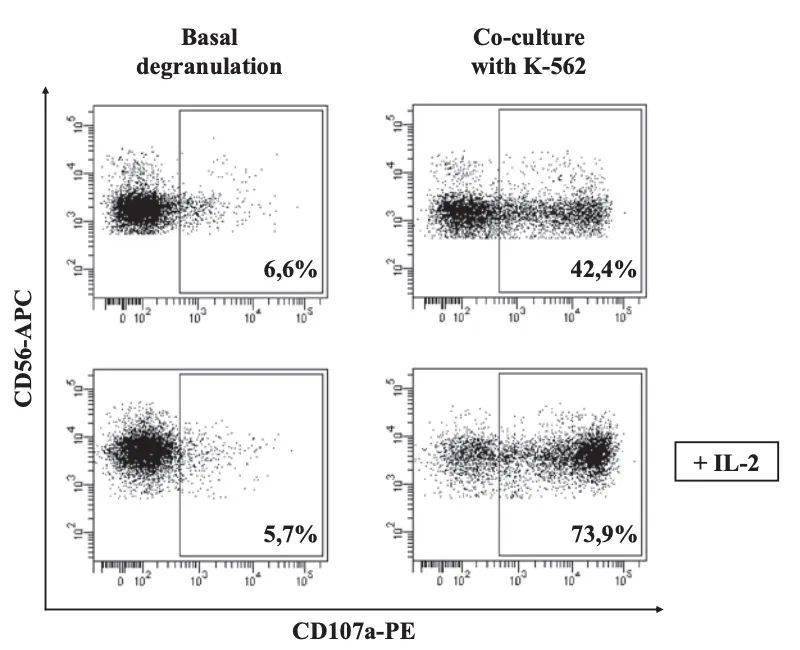
↑共培养组,下面这组另外加了IL-2,增强NK杀伤能力 实验要点解析 1.CD107a检测通常需采集同一样本至少两个不同的白细胞层(可能细胞组成会有所不同)进行,以确保结果的可重复性。 2.白细胞层的细胞密度高,红细胞可聚集成团捕获PBMC,会造成淋巴细胞的丢失。所以有必要减少红细胞聚集,因此用 1× PBS 稀释全血很重要。 3.Ficoll 的密度随温度变化,影响梯度分离的时间和有效性。在 18–20 °C 的温度下可获得最佳结果。 4.密度梯度离心后,离心管内出现四个分化层,分别是:顶层,主要是血浆;白色混浊层,PBMC;Ficoll 层;最底部是红细胞和粒细胞。 5.长时间接触 Ficoll 溶液会对细胞产生毒性,因此建议在单个核细胞层取出后,立即用培养基清洗细胞沉淀,以消除残留的 Ficoll,避免细胞损伤。 6.在某些情况下,PBMC层中仍会混有红细胞,从而污染回收的PBMC。可通过使用预热的 Ficoll 来避免。 7.NK 细胞脱颗粒水平高度依赖于靶细胞的免疫原性, 当NK与某些免疫原性差的肿瘤细胞系共培养时,无法观察到可检测的 CD107a 染色。向培养基中 添加 IL-2激活 NK 细胞能够克服这个问题。 8.CD107a 测定也可以使用 IL-2 刺激的纯化 NK 细胞作为效应细胞群体。可以使用磁珠分选NK细胞实现。 9.PMA 和离子霉素以粉末形式提供。配制成溶液后,建议将其小体积分装(5–10 μL)到EP管,避免反复冻融。这些试剂应储存在-20°C,避光。 10.PMA 和离子霉素的工作浓度分别为50ng/mL和1μg/mL。务必通过计算明确阳性对照中PMA和离子霉素终浓度符合该要求。 11.为了获得具有代表性和可靠的数据,应至少获取5×10E3个NK细胞。 本文来自流式中文网(flowcyto.cn)欢迎转发到朋友圈,但谢绝复制粘贴转载如有需要请联系[email protected] Promotions below 返回搜狐,查看更多 责任编辑: |
【本文地址】