mRNA、RNP、pDNA:详解CRISPR基因编辑疗法三大递送形式与应用趋势 近期热门文章 ★CRISPR基因编辑疗法开疆拓土,不断刷新多种疾病治疗新范式 ★基因编辑让癌细胞“从良”,下一个抗癌新趋... |
您所在的位置:网站首页 › 注射器讲解图 › mRNA、RNP、pDNA:详解CRISPR基因编辑疗法三大递送形式与应用趋势 近期热门文章 ★CRISPR基因编辑疗法开疆拓土,不断刷新多种疾病治疗新范式 ★基因编辑让癌细胞“从良”,下一个抗癌新趋... |
mRNA、RNP、pDNA:详解CRISPR基因编辑疗法三大递送形式与应用趋势 近期热门文章 ★CRISPR基因编辑疗法开疆拓土,不断刷新多种疾病治疗新范式 ★基因编辑让癌细胞“从良”,下一个抗癌新趋...
|
来源:雪球App,作者: 医麦客,(https://xueqiu.com/5603603160/247261811)
近期热门文章 ★CRISPR基因编辑疗法开疆拓土,不断刷新多种疾病治疗新范式 ★基因编辑让癌细胞“从良”,下一个抗癌新趋势? 2023年4月13日/医麦客--星耀研究院新闻 PharmaBIGStar News/--自2013年以来,以CRISPR/Cas9为代表的新一代基因编辑技术开始崭露头角,改变了传统的基因治疗方式。对于基因编辑来说,无论是在体外还是体内,递送都是其发挥功能的第一步。目前,CRISPR基因编辑工具常以编码的质粒DNA(pDNA)、mRNA、或直接作为核糖核蛋白复合体(RNP)三种形式通过病毒(如AAV、LV)或非病毒载体(LNP、VLP等)递送到细胞中,历经不同的胞内过程,在sgRNA 的导向下,完成靶基因的编辑进而发挥作用。 在临床应用中,由于质粒DNA、mRNA以及RNP复合体三者本质不同,并具备不同的胞内过程,因此三者的生产难度、稳定性、起效时间、编辑效率、脱靶效应和安全性等方面也不尽相同。本文主要从国内外基因编辑领军企业的管线应用以及进展分析其应用现状及未来发展趋势,并对三种不同形式介导的各类基因编辑手段做简单对比分析。
pDNA介导的CRISPR基因编辑 PharmaBIGStar News pDNA介导的CRISPR/基因编辑,即将Cas9蛋白和sgRNA编码进单个或多个质粒DNA载体中,该策略由于质粒DNA易于构建、操作简单且成本低等优势而成为一种极具吸引力的方法。 然而,这方式也存在一些局限性,如编码后pDNA的尺寸过大会显著增加CRISPR/Cas9系统递送和表达的难度;pDNA进入细胞核后的转录过程会降低基因编辑的效率并且还会导致治疗过程的延迟;此外,基于pDNA的表达通常会导致Cas9蛋白长时间存在于细胞中,这可能会导致更高的脱靶效应和强烈的免疫应答等。因此,如选择质粒DNA进行基因编辑,应对其风险进行全面评估。 在临床应用中,基因编辑企业Editas此前的体内基因编辑管线EDIT-101和EDIT-103均是采用pDNA形式,以AAV为载体,将Cas9蛋白编码基因和向导RNA编码基因递送至体内。
EDIT-101通过AAV5载体将编码Cas9核酸酶变体SaCas9的基因和两个指导RNA(gRNA)递送到感光细胞中,用于治疗Leber先天性黑蒙10型(LCA10)。2022年11月,Editas公布了EDIT-101的1/2期临床试验数据:14名接受治疗的患者有3名达到了预期。 EDIT-103是一种不依赖于突变的CRISPR/Cas9的体内基因编辑疗法,利用双AAV5载体递送,旨在敲除和替换视紫红质基因中的突变以保持感光器功能,从而治疗视紫红质相关的常染色体显性视网膜色素变性 (RHO-adRP),该候选药物有望解决150多种可导致RHO adRP病的RHO功能获得型的突变。临床前数据显示:EDIT-103的敲除内源性RHO的能力接近100%,在动物实验中,其替代RHO基因产生的蛋白质水平超过正常RHO基因产生蛋白质的30%以上。 EDIT-101、EDIT-103此前公布的临床疗效均可圈可点,但遗憾的是,在今年1月该公司公布的战略调整中,由于疫情、患者群体少以及未来商业模式等因素,公司已将这两款基因编辑产品暂停。 mRNA介导的CRISPR基因编辑 PharmaBIGStar News mRNA介导的CRISPR基因编辑是指将Cas9 mRNA和sgRNA共同递送至靶细胞。该方法与质粒DNA相比,mRNA在细胞中的转换速度更快,可以较快启动基因编辑;与此同时,由于mRNA不需要再进入细胞核转录,因此能够对剂量进行精确控制,同时限制了蛋白质的持久性,有助于降低CRISPR系统的脱靶效应。 但相较而言,mRNA的稳定性相对较差,为了实现对mRNA高效且精准的递送,在载体的设计方面必须保护mRNA免受胞外核酸酶的降解。 目前,从临床布局管线来看,以mRNA形式介导的CRISPR基因编辑是目前应用最多的策略,包括Intellia Therapeutics、Beam Therapeutics 以及本导基因等龙头企业的在研管线均采用了mRNA形式进行编辑工具的递送。 LNP-mRNA Intellia在研管线中进展较快的体内基因编辑疗法NTLA-2001和NTLA-2002,均使用LNP包封Cas9 mRNA和sgRNA进行递送。
NTLA-2001旨在通过LNP递送技术将靶向TTR基因的CRISPR/Cas9组合递送到肝脏,实现对肝细胞内的突变甲状腺素运载蛋白(TTR)基因特定DNA片段实施敲除编辑。这也是首款进入临床试验的全身性给药CRISPR基因编辑疗法。2022年11月在美国心脏协会科学年会上公布的最最新1期数据显示,所有患者在单次静脉注射NTLA-2001后28天的血清TTR降低90%以上,药物整体耐受性良好。 NTLA-2002是另一款在研全身性给药体内基因编辑疗法,旨在通过LNP递送CRISPR/Cas9系统,对激肽释放酶B1基因(KLKB1)进行编辑,从而特异性关闭KLKB1基因的表达,拟用于治疗遗传性血管水肿(HAE)。其最新1/2期临床试验数据显示:接受NTLA-2002治疗的HAE成人病患血浆激肽水平大幅度下降且HAE发作次数降低。 Beam Therapeutics首个体内碱基编辑疗法BEAM-301,同样是利用LNP将碱基编辑组件以mRNA的形式递送到肝脏,修复G6PC基因的R83C点突变,以治疗糖原贮积病Ia型(GSDIa)患者。
目前,该疗法还尚处于临床前研究阶段,该公司预计将在2023年年底或2024年年初提交IND申请。 SEND-mRNA 2021年8月,张锋团队在国际顶尖学术期刊 Science 发表的一项题为“Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery” 的研究论文中,开发了一种全新的RNA递送平台——SEND(Selective Endogenous eNcapsidation for cellular Delivery),SEND的核心是逆转录病毒样蛋白PEG10,它能够与自身的mRNA结合并在其周围形成球型保护囊,研究团队将其改造设计后用来包装和递送RNA。 研究表明,SEND能够在不使用非人类蛋白成分的情况下将外源性mRNA 组分(例如Cas9)递送到体外的细胞中。与其他递送载体相比,SEND系统是利用人类内的组分自组装为病毒样颗粒,所引起的免疫反应更少,更具安全性。张锋表示,SEND 技术可以补充现有的病毒递送载体和脂质纳米颗粒,以扩展向细胞递送基因和编辑疗法的工具箱。 值得一提的是,张锋团队以SEND技术孵化了初创企业Aera Therapeutics。目前,SEND递送策略的应用尚处于起步阶段,未在临床中应用。
VLP-mRNA 本导基因自研用于治疗单纯疱疹病毒型角膜炎(HSK)的眼用注射液BD111也是mRNA介导的体内基因编辑疗法。
BD111旨在利用其原创性递送技术VLP转导CRISPR基因编辑工具直接靶向切割单纯疱疹病毒(HSV-1)的基因组,达到清除HSV-1病毒基因组的目的,从而实现对疱疹病毒型角膜炎的治疗,BD111具有以下特点: (1)Cas9 mRNA使基因编辑酶在体内停留时间短,可以有效降低免疫反应和基因编辑脱靶风险; (2)仅需切割病毒基因组,不需要改变任何人的基因,临床前和IIT临床研究中均未检测到对动物或人体基因组的脱靶效应。 BD111已于2022年6月获得了美国FDA孤儿药资格认定,是全球首个CRISPR抗病毒基因编辑治疗药物,也是国内首个进行IND申请的体内基因编辑药物,同步开展了FDA的IND申报。此前,本导基因与复旦大学附属眼耳鼻喉科医院于2020年开始合作开展了BD111治疗病毒性角膜炎IIT临床试验,在长期临床观察中初步证明了该创新药物的安全性和有效性。 RNP介导的CRISPR基因编辑 PharmaBIGStar News 对于CRISPR/Cas系统来说,最高效的打开方式就是跳过pDNA或mRNA在细胞内的转录或翻译,而是将Cas9蛋白和sgRNA直接进行递送,这可以最大程度地降低脱靶效应。目前大部分基于Cas9蛋白的递送体系都是以RNP(核糖核蛋白)的形式进行递送。 RNP复合体由Cas9蛋白和sgRNA组成,该方法具有以下优势: Cas9-gRNA复合体可递送到多种类型的细胞中,包括难以转染的细胞,如免疫细胞和干细胞,这一优势很大程度上决定了Cas9-gRNA RNP的临床治疗潜质; 将RNP直接递送至细胞,可以解决某些罕见真核启动子导致的蛋白质表达困难,如许多CRISPR质粒中发现的CMV或EF1A启动子,保证较高的基因编辑效率; Cas9 RNPs转染后很快就能检测到高水平的Cas9 RNPs,随后通过蛋白质降解途径迅速从细胞中清除,较短的半衰期使其具有限制脱靶效应的可能性。 但与此同时,RNP介导的CRIPR基因编辑也面临一定的挑战。首先,Cas蛋白注入血液后易被蛋白酶降解;其次,RNP分子较大,可能限制其穿透细胞膜。因此,目前RNP形式的应用多限于体外,通过电穿孔等物理手段可实现较高效率的入胞入核,但要应用于体内,需要开发合适的递送载体解决以上难题。另一方面,生产过程中需保证Cas蛋白的纯度和活性,这是Cas蛋白发挥基因剪切作用的必要条件。 目前,Editas在研的基因编辑产品EDIT-301和CRISPR/Vertex合作开发的Exa-cel均为RNP介导的体外基因编辑疗法。 EDIT-301旨在将Cas12a与gRNA组成的RNP复合体在体外转至造血干细胞内,编辑后输送回患者体内,用于治疗β地中海贫血(TDT)和镰刀型细胞贫血病(SCD),目前正在开展I/II期临床研究。去年12月,Editas 公布了在I/II期RUBY试验中接受EDIT-301治疗的前两例SCD患者的早期积极临床数据,显示了良好的耐受性与疗效,两例接受治疗的患者均表现出成功的中性粒细胞和血小板植入。此外,在治疗后5个月和1.5个月的随访中,两例患者均未发生任何血管阻塞危象。 今年3月,Editas创始人张锋团队还在《Nature》上发表了最新研究,开发了一种全新的蛋白递送系统,具有将任何蛋白精准递送到任何指定人类细胞的潜力。这项突破性技术旨在利用细菌“注射器”,将蛋白质注射到人类细胞中。研究人员借助人工智能蛋白设计平台AlphaFold,通过氨基酸序列预测蛋白质结构,重新设计了发光杆菌的注射器,使之从靶向结合昆虫细胞改为靶向结合人类细胞。基于这一套系统,研究人员通过改造让其装载不同的作用物质,包括基因编辑系统的核酸酶Cas9、碱基编辑器、可以杀死癌细胞的毒素等。
推荐阅读:张锋团队Nature重磅研究|新型递送革新精准肿瘤、基因治疗 CRISPR/Vertex合作开发的Exa-cel通过使用Cas9蛋白在体外对患者造血干细胞的BCL11A增强子位点进行编辑,提高胎儿血红蛋白(HbF)的表达量从而达到治疗目的。
根据在2022 ASH上公布的数据,接受exa-cel治疗的44名TDT患者中,42名维持不需要接受血红细胞输注;在接受exa-cel治疗的SCD患者中,所有患者均未出现SCD患者中常见的VOC。目前,该疗法已在4月3日向FDA完成了BLAs的提交,Exa-cel有望成为首款上市的CRISPR基因编辑药物。 David Liu团队也正在探索RNP的应用潜力并开发了一种工程化无DNA病毒样颗粒(eVLP)的新型递送系统。该团队表示其eVLP是在逆转录病毒的基础上做了大量改造和优化,以克服包装、递送和释放中的瓶颈,可以有效包装和递送碱基编辑器和CRISPR-Cas9的核糖核蛋白(RNP),能够在人类细胞、小鼠原代细胞和多种小鼠器官和组织(肝脏、大脑、眼睛)中进行有效的基因编辑。值得一提的是,David Liu团队利用eVLP技术孵化了Nvelop Therapeutics。 从以上基因编辑几大领军企业的管线应用来看,各家采取的策略不尽相同,Editas此前在体内基因编辑领域专注于以AAV为载体的DNA技术为主,在体外基因编辑领域则采用RNP技术;CRISPR公司的体外基因编辑同样选择RNP形式;而Intellia公司在体内/体外基因编辑疗法领域则均以mRNA为主要递送形式。 总的来说,CRISPR/Cas系统常见的三种应用模式质粒DNA、mRNA和Cas-RNP各有优缺点,而无论是哪一种形式,递送手段都尤为重要。因此,科学家们仍在不断探索开发新型的蛋白/核酸体内递送系统,以最大化实现基因编辑用于疾病治疗的潜能。另外,从张锋、刘如谦的最新发文来看,未来RNP形式的蛋白递送或将成为继mRNA之后的下一个焦点,占领重要地位。 基因编辑作为“一次治疗,终身受益”的治疗手段,不论是哪种方式进入体内,其长期安全性以及有效性等都仍需在长期试验中进行验证。今年,我们即将迎来首款上市的基因编辑疗法,未来必将会不断吸引企业跻身基因编辑的创新药赛道,革新基因疗法发展潮流。 声明及版权说明 声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。 版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。 基因治疗系列文章一览 1、AAV空壳率检测技术一览 2、AAV商业化之路 3、16家CGT领域CDMO企业概览 4、AAV上下游产业链(上游篇) 5、AAV上下游产业链(下游篇) 6、AAV的临床应用优势与挑战 7、AAV衣壳改造新技术 8、国内基因疗法监管体系完善方向 9、具有差异化的CGT CDMO企业 10、AAV基因疗法罕见病领域 11、国内AAV疗法监管法规 12、AAV载体优化策略(上) 系列长图文章一览
|
【本文地址】

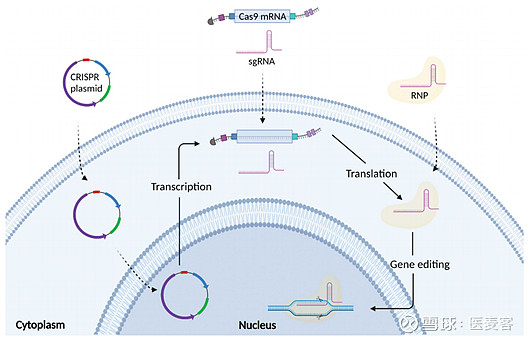 ▲ CRISPR/Cas系统的三种应用模式(图源:参考资料1)
▲ CRISPR/Cas系统的三种应用模式(图源:参考资料1)