【诊疗方案】恶性胸腔积液治疗的中国专家共识(2023年版) |
您所在的位置:网站首页 › 治疗胸水的药物 › 【诊疗方案】恶性胸腔积液治疗的中国专家共识(2023年版) |
【诊疗方案】恶性胸腔积液治疗的中国专家共识(2023年版)
|
本共识经过多次工作会议,确定了共识的框架,适用对象为年龄≥18周岁,除恶性胸膜间皮瘤以外的各种恶性肿瘤导致的MPE。共识主体分四章:MPE的发病机制、MPE的预后评估、胸腔局部治疗、针对MPE的全身抗肿瘤治疗。 围绕MPE的治疗,各位专家对相关循证医学证据进行了系统的检索、筛选、评价。经专家组成员反复讨论,形成统一意见,并广泛征求国内相关领域专家的意见后,经过多次修改,最终定稿,形成推荐意见。由中国循证医学中心提供方法学支持,证据和推荐意见的评价与GRADE分级原则保持一致[10],具体推荐强度及证据质量分级和定义见表1、2。
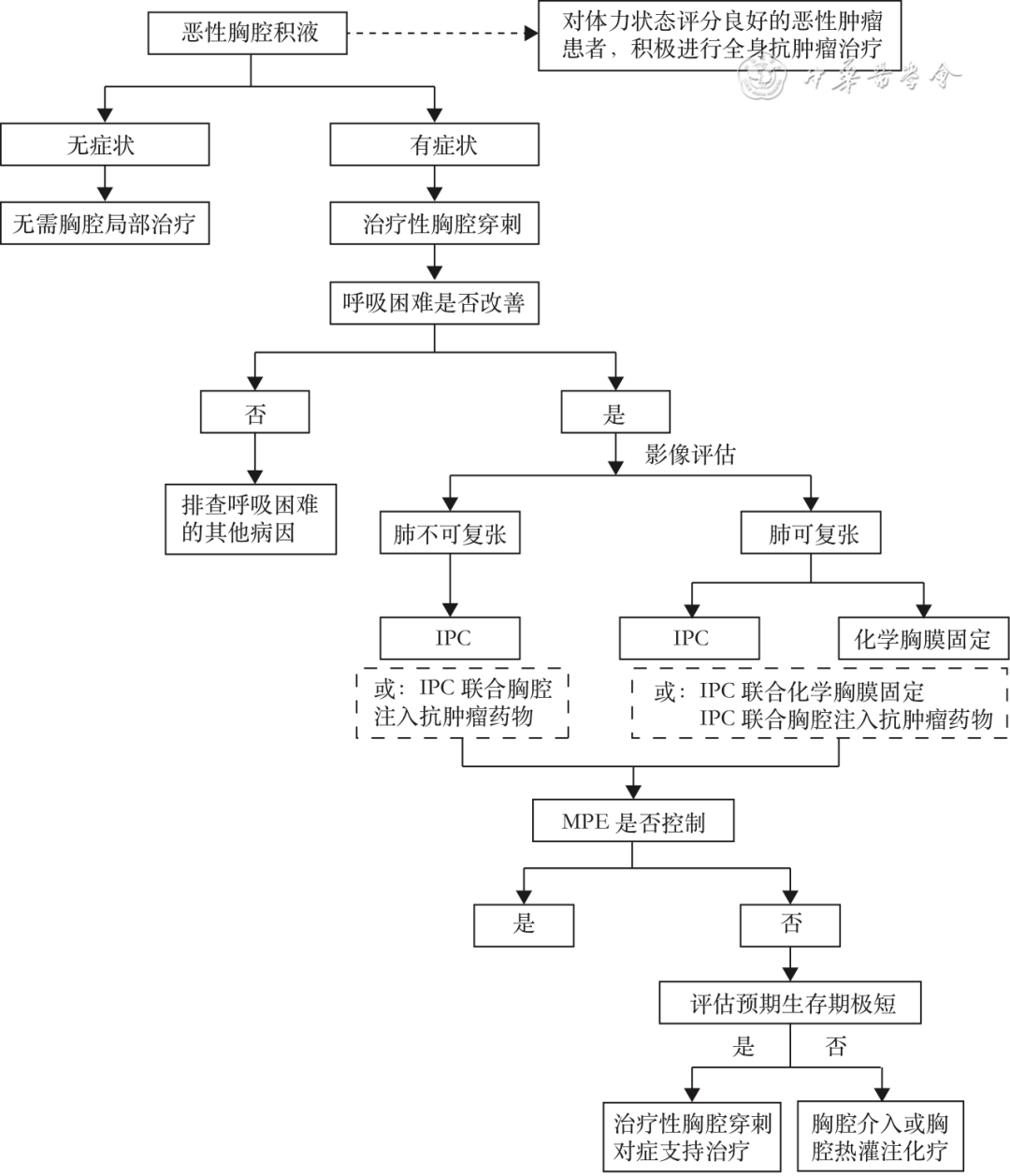
恶性胸腔积液的处理流程见图1。
一、MPE的发病机制 MPE的发病机制包括肿瘤细胞与胸膜腔微环境中的宿主淋巴及血管系统、免疫系统和其他宿主细胞之间的相互作用,共同驱动导致淋巴管阻塞、血管新生、血管渗透性增强、胸膜炎症等病理生理过程,形成胸腔积液[11, 12, 13]。恶性肿瘤可通过直接侵袭或血行转移进入胸膜,破坏胸膜屏障功能导致胸腔积液[14]。恶性肿瘤还可以引起淋巴管的阻塞或破坏,导致胸腔内液体排出受阻[14]。肿瘤细胞能释放多种细胞因子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)等促进新生血管形成,并导致胸膜血管通透性增加[15, 16, 17, 18]。MPE中的间皮细胞、粒细胞和淋巴细胞与肿瘤细胞相互作用,诱发炎症反应,导致血管渗透性增加,促进MPE形成[12,19]。MPE中还存在大量具有免疫抑制特征的免疫细胞和细胞因子,有助于肿瘤免疫逃逸,促进胸膜肿瘤生长和MPE形成[13]。 二、MPE的预后评估 1. 患者体力状态和症状:美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状态(performance status,PS)评分越高,患者预后越差[20];采用呼吸困难视觉模拟量表(visual analog scale for dyspnea,VASD)评估患者呼吸困难症状[21],出现呼吸困难的MPE患者生存期更短。 2. 肿瘤类型及病理特征:MPE患者的肿瘤原发部位、病理分型、分期等不同,其预后存在差异。胸膜间皮瘤伴MPE患者预后最好,其次为乳腺癌和淋巴瘤伴MPE患者,肺癌伴MPE患者预后最差[22, 23]。 3. 预后模型:LENT模型[4](包括胸腔积液乳酸脱氢酶、PS评分、血中性粒细胞计数与淋巴细胞计数的比值和肿瘤类型等4个变量)、PROMISE模型[24][包括血红蛋白、C反应蛋白、白细胞计数、PS评分、肿瘤类型、既往接受化疗和既往接受放疗、胸水基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinases 1,TIMP1)浓度等8个变量]和BLESS模型[25](https://biostatistics.mdanderson.org/shinyapps/BLESS)等可协助临床医生评估MPE患者的预后,但尚无证据表明,基于预后模型制定的治疗方案可以改善患者预后。 【推荐意见1】MPE的预后评估对治疗方案的制定有参考价值,建议结合患者的体力状态评分、肿瘤类型和实验室指标来综合评估患者预后(2B)。 三、胸腔局部治疗 MPE的诊断可参考《胸腔积液诊断的中国专家共识》[26]。对于有呼吸困难症状的MPE患者,无论全身抗肿瘤治疗策略如何,都应考虑在抗肿瘤治疗的早期阶段针对MPE进行胸腔局部治疗[27, 28];对于无症状的MPE,无需胸腔局部治疗。 (一)治疗性胸腔穿刺 治疗性胸腔穿刺可在门诊或病房进行,操作简单且相对安全,通常可迅速缓解患者症状。 1. 适用人群:对有呼吸困难症状的疑诊或确诊MPE患者,治疗性胸腔穿刺是胸腔局部初步处理措施。治疗性胸腔穿刺也适用于预期生存期极短或无法耐受更具侵入性操作的终末期患者。而对于预后较好的患者,不建议反复胸腔穿刺抽液;反复胸腔穿刺会增加气胸、出血、感染等风险。首次治疗性胸腔穿刺后呼吸困难如果未缓解,要进一步排查潜在病因,如:肺栓塞、癌性淋巴管炎、肺不张、肿瘤堵塞气道、合并感染等。胸腔穿刺排液后应使用胸部X线平片或胸部CT或超声评估肺是否复张,为制定后续干预措施提供参考[29]。 2. 禁忌证:无绝对禁忌证;相对禁忌证包括少量积液(壁层胸膜与脏层胸膜之间的距离7.3时,TMP和滑石粉胸膜固定术疗效相当[104, 105, 106],但目前尚缺乏更多证据支持其临床广泛应用。正在进行的AMPLE-3研究是一项对比接受胸腔置管±滑石粉胸膜固定和VATS胸膜固定术(包括滑石粉喷洒和其他多种手术操作技术等)的多中心随机对照研究,期待这项研究的结果为MPE的治疗提供更优策略[107]。 【推荐意见11】外科手术治疗MPE的价值尚不确切,建议慎重考虑在临床实践中的应用,或开展严格的临床研究(2C)。 (七)胸腔热灌注化疗(hyperthermic intrathoracic chemotherapy,HITHOC) HITHOC应用便捷,总体耐受性良好[108, 109]。相较于常温胸腔灌注化疗,HITHOC显著提升MPE控制率、缩短引流管安置时间、延长患者PFS和OS[110];但相较于滑石粉胸膜固定术,HITHOC并未延长患者OS[111, 112]。HITHOC可作为肺切除术、胸膜切除术/去皮术或减瘤手术的辅助治疗,改善患者预后[113, 114, 115]。但整体而言,证据质量不高,缺乏大样本的前瞻性随机试验。 1. 适用人群与禁忌证:适用于胸膜有弥漫性癌性结节的MPE患者[116];禁忌证包括:(1)心肺功能重度受损;(2)急性感染;(3)伴有发热,体温>38 ℃;(4)有出凝血功能障碍;(5)精神病患者等[116]。 2. 灌注参数:灌注时间1 h左右;灌注温度通常控制在42~45 ℃之间,一般设置为43 ℃[116, 117, 118]。采用循环机治疗时,灌注循环溶液1 000~1 500 ml;采用外辐射加热治疗时,胸腔内灌注液容量100~200 ml[116]。 3. 置管形式:优先考虑胸腔镜辅助下置管,创伤较小且恢复快;B超引导下置管创伤小、费用低,但穿刺置管风险较大;开胸创伤大,多在肺切除术或胸膜全切/去皮术时使用[109, 110]。 4. 灌注液:常为生理盐水,慎用蒸馏水[119, 120]。 5. 化疗药物:顺铂是最常用的化疗药物,推荐剂量为150~175 mg/m2,最大耐受剂量225 mg/m2[118,121, 122, 123]。可单药,也可联合用药,其他化疗药物可选择洛铂、培美曲塞、博来霉素、丝裂霉素、吉西他滨、重组人血管内皮抑制素等。化疗药物应根据肿瘤类型、药敏情况等进行选择,警惕肾损伤、骨髓抑制、胃肠道毒性等不良反应[121,124]。 6. 灌注流程:包括置管、热灌注冲洗和热灌注循环化疗3个步骤,具体流程参照中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)热疗专家委员会2020年发布的《肿瘤热疗中国专家共识》[116]。 7. 并发症:主要包括恶心、呕吐、食欲减退、骨髓抑制、胸痛和发热等;部分患者会出现心力衰竭、肺水肿和气胸等[116,125]。 【推荐意见12】对于胸腔置管引流或胸膜固定术后,MPE仍未控制的患者,建议在有条件的单位,酌情考虑行胸腔热灌注化疗(2B)。 (八)分隔性MPE的治疗 由于恶性肿瘤的生物学特性,胸腔积液中纤维蛋白的沉积以及化疗药物对脏、壁层胸膜的作用,使之产生化学性炎症,形成分隔性MPE(loculated malignant pleural effusion),或称包裹性MPE(encapsulated malignant pleural effusion)。据报道,约33.3%的MPE出现多房分隔[126]。出现分隔性MPE时,由于多房分隔的存在造成胸腔积液难以有效地引流,不能缓解患者的症状;也使注入胸腔的药物不能与胸膜充分接触,降低局部药物的疗效,从而影响治疗效果和患者预后,成为MPE治疗的难点[127, 128]。 可通过胸部超声和胸部CT来判断胸腔积液是否存在多房分隔[26,129]。超声识别多房分隔优于胸部CT[6]。出现分隔性MPE时需要根据患者的病情和症状来决定是否需要将造成分隔的纤维隔离带切割和清除,便于胸腔积液的有效引流和提高局部药物治疗的疗效。目前常用方法包括经胸腔内注射纤维蛋白溶解剂和经胸腔镜粘连带分离。 1. 胸腔内注射纤维蛋白溶解剂:胸腔内注射纤维蛋白溶解剂是通过降解胸腔中的纤维蛋白,降低胸腔积液的黏稠度,减少胸膜粘连及胸腔分隔,促进积液排出。 尿激酶和链激酶是最常用的药物[129, 130, 131, 132]。小样本前瞻性观察性研究发现,胸腔内注入尿激酶或链激酶均可促进分隔性胸腔积液的排出[130]。但前瞻性、随机双盲试验显示,对包裹性胸腔积液,相较于胸腔注入安慰剂,胸腔内注入尿激酶不能显著改善患者的呼吸困难,也不能提高胸膜固定成功率,但可以延长患者OS[131]。而一项随机双盲、安慰剂对照研究显示,对分隔性MPE,与安慰剂比较,胸腔注入链激酶可显著增加积液引流量,促进肺复张[132]。尿激酶通常10~25万 U/次,1次/d胸腔注入,连续3 d;链激酶通常25万 U/次,1~2次/d,连续3 d。tPA和DNase对分隔性MPE有一定的疗效[133, 134],但缺乏高质量的研究证据。 2. 经胸腔镜粘连带分离:对于症状明显而不能有效引流的分隔性MPE患者,在胸腔镜下可用活检钳、电刀或氩气刀等工具进行切割、分离和清除纤维隔离带[100,135]。通过胸腔镜进行切割分离纤维间隔后直视下注入尿激酶,对分隔性MPE有更好的疗效[136, 137]。胸腔镜存在一定的风险,如出血、气胸、空气栓塞等,因此术前需充分评估患者病情和操作风险。 【推荐意见13】对于有症状的分隔性MPE,建议胸腔内注入纤维蛋白溶解剂(如链激酶、尿激酶)来促进积液排出(2C)。 【推荐意见14】对于有症状的分隔性MPE,建议在充分评估风险后,酌情考虑通过胸腔镜清除胸腔内黏连带,注入纤溶剂来促进排液(2C)。 四、针对MPE的全身抗肿瘤治疗 所有体力状态评分良好的晚期恶性肿瘤伴MPE患者,均应针对原发肿瘤,根据指南采用相应的全身抗肿瘤治疗。 (一)化疗 部分肿瘤对化疗敏感,在接受静脉化疗后,原发肿瘤退缩,MPE也会随之得到有效控制。既往的Ⅱ期临床试验结果提示紫杉醇联合卡铂化疗对非鳞NSCLC引起的MPE有一定治疗效果[138]。针对小细胞肺癌(small-cell lung cancer,SCLC)伴MPE患者,经一线化疗后,55%的患者同侧胸腔积液消失[139]。而另一项小样本量研究则提示,伴有MPE的SCLC患者,化疗后骨髓抑制更明显,这可能是由于化疗药物在胸腔积液中积累导致毒性增加[139, 140, 141]。因此,建议在全身化疗前先引流胸腔积液。 (二)靶向治疗 在一项单臂、前瞻性研究中,76例MPE且伴有EGFR敏感突变的NSCLC患者,口服吉非替尼治疗[142],其中70例患者(92%)的积液量减少>50%且持续3个月以上,但其中48例患者出现MPE复发。 一项前瞻性单臂Ⅱ期临床研究发现,奥希替尼联合静滴贝伐珠单抗治疗EGFR敏感突变NSCLC伴MPE患者,安全性好,但没有显著延长PFS[143]。小样本回顾性研究显示,对ALK/ROS1融合基因阳性NSCLC伴MPE患者,接受相应的酪氨酸激酶抑制剂靶向治疗有一定疗效,但缺乏OS获益的证据[144]。 (三)抗血管生成治疗 常用抗血管生成药物主要包括贝伐珠单抗、阿帕替尼、安罗替尼等。贝伐珠单抗联合铂类化疗是晚期非鳞NSCLC的一线治疗方案之一,广泛应用于临床实践。多项研究表明,对于晚期非鳞NSCLC伴MPE,相较于含铂双药化疗,贝伐珠单抗联合化疗作为一线治疗方案可提高MPE控制率,且耐受性良好[138,145, 146, 147]。一项纳入胸膜固定术失败的非鳞NSCLC伴MPE患者的Ⅱ期单臂研究发现[148],贝伐珠单抗联合化疗可有效控制MPE。贝伐珠单抗的不良反应包括高血压、出血、蛋白尿、肠穿孔、血栓栓塞等[149]。阿帕替尼属于口服小分子抗血管靶向药,两项回顾性研究初步探讨了阿帕替尼联合化疗治疗MPE的疗效,均提示联合治疗较单纯化疗能更有效控制MPE,也更具有持久性,且安全性可接受[150, 151]。安罗替尼是一种多靶点的酪氨酸激酶抑制剂,Ⅱ期多中心随机对照研究发现,对SCLC合并MPE,安罗替尼组DCR为63%,中位PFS 2.8个月,中位OS 6.5个月,均显著高于安慰剂组[152]。 (四)免疫检查点抑制剂治疗 一项研究纳入伴有MPE和不伴MPE的NSCLC,免疫检查点抑制剂单药在伴有MPE的NSCLC患者中,中位PFS和OS均更短,提示免疫单药难以控制MPE,且与PD-L1表达无相关性[153],另一项研究发现,伴有MPE的NSCLC患者,接受帕博利珠单抗治疗的PFS显著更短[154]。研究发现,伴MPE的非鳞NSCLC患者,免疫治疗联合化疗的中位PFS显著长于免疫检查点抑制剂单药治疗[155]。 此外,尽管免疫检查点抑制剂在黑色素瘤、食管癌、头颈部鳞状细胞癌等多种肿瘤中获批了适应证[156, 157, 158],但评估免疫治疗在这些肿瘤合并MPE中疗效的研究较少。 【推荐意见15】对不同恶性肿瘤继发的MPE,若患者体力状态评分良好,推荐针对原发肿瘤进行全身抗肿瘤治疗(1C)。 撰写组组长:李为民(四川大学华西医院) 顾问:王辰(中国医学科学院北京协和医学院);瞿介明(上海交通大学医学院附属瑞金医院);陈荣昌(深圳市呼吸疾病研究所);曹彬(中日友好医院);谢灿茂(中山大学附属第一医院);陈良安(解放军总医院);白春学(复旦大学附属中山医院);孙鑫(四川大学华西医院) 执笔:田攀文(四川大学华西医院);李亚伦(四川大学华西医院);周建英(浙江大学医学院附属第一医院);项轶(上海交通大学医学院附属瑞金医院);应颂敏(浙江大学呼吸疾病研究所);曾运祥(广州医科大学附属第一医院) 参与编写专家(按姓氏拼音排序):曹超(宁波市第一医院);曹勇(华中科技大学同济医学院附属同济医院);陈闽江(北京协和医院);程越(四川大学华西医院);冯靖(天津医科大学总医院);顾其华(中南大学湘雅医院);黄建安(苏州大学附属第一医院);侯刚(中日友好医院);蒋延文(北京大学国际医院);李长毅(重庆医科大学附属第二医院);李丹(四川大学华西医院);李洪娟(四川大学华西医院);李千瑞(四川大学华西医院);李冉(北京大学人民医院);李之曦(四川大学华西医院);梁志欣(解放军总医院);廖槐(中山大学附属第一医院);刘丹(四川大学华西医院);刘丽华(广西医科大学第一附属医院);刘庆华(上海市东方医院/同济大学附属东方医院);刘双林(陆军军医大学第二附属医院);罗汶鑫(四川大学华西医院);罗壮(昆明医科大学第一附属医院);任徽(西安交通大学第一附属医院);宋慧芳(内蒙古自治区人民医院);宋磊(吉林大学第一医院);王爱华(山东大学齐鲁医院);王凯歌(四川大学华西医院);王可(广西医科大学第一附属医院);王苒(安徽医科大学第一附属医院);王涛(遵义医科大学附属医院);王赞峰(中国医科大学附属第一医院);吴学玲(上海交通大学医学院附属仁济医院);向菲(华中科技大学同济医学院附属协和医院);许飞(南昌大学第一附属医院);杨澜(四川大学华西医院);杨萌(中日友好医院);杨拴盈(西安交通大学第二附属医院);曾惠清(厦门大学附属中山医院);张艺(兰州大学第一医院);张苑(同济大学附属上海市肺科医院);赵爽(四川大学华西医院);赵欣(南京医科大学第一附属医院);周国武(中日友好医院);周红梅(南方科技大学医院);朱红(北京大学第三医院);朱雨琦(四川大学华西医院) 文献秘书:曾灏(四川大学华西医院);鲜京宏(四川大学华西医院) 参考文献(略) 撰写组组长:李为民(四川大学华西医院) 顾问:王辰(中国医学科学院北京协和医学院);瞿介明(上海交通大学医学院附属瑞金医院);陈荣昌(深圳市呼吸疾病研究所);曹彬(中日友好医院);谢灿茂(中山大学附属第一医院);陈良安(解放军总医院);白春学(复旦大学附属中山医院);孙鑫(四川大学华西医院) 执笔:田攀文(四川大学华西医院);李亚伦(四川大学华西医院);周建英(浙江大学医学院附属第一医院);项轶(上海交通大学医学院附属瑞金医院);应颂敏(浙江大学呼吸疾病研究所);曾运祥(广州医科大学附属第一医院) 参与编写专家(按姓氏拼音排序):曹超(宁波市第一医院);曹勇(华中科技大学同济医学院附属同济医院);陈闽江(北京协和医院);程越(四川大学华西医院);冯靖(天津医科大学总医院);顾其华(中南大学湘雅医院);黄建安(苏州大学附属第一医院);侯刚(中日友好医院);蒋延文(北京大学国际医院);李长毅(重庆医科大学附属第二医院);李丹(四川大学华西医院);李洪娟(四川大学华西医院);李千瑞(四川大学华西医院);李冉(北京大学人民医院);李之曦(四川大学华西医院);梁志欣(解放军总医院);廖槐(中山大学附属第一医院);刘丹(四川大学华西医院);刘丽华(广西医科大学第一附属医院);刘庆华(上海市东方医院/同济大学附属东方医院);刘双林(陆军军医大学第二附属医院);罗汶鑫(四川大学华西医院);罗壮(昆明医科大学第一附属医院);任徽(西安交通大学第一附属医院);宋慧芳(内蒙古自治区人民医院);宋磊(吉林大学第一医院);王爱华(山东大学齐鲁医院);王凯歌(四川大学华西医院);王可(广西医科大学第一附属医院);王苒(安徽医科大学第一附属医院);王涛(遵义医科大学附属医院);王赞峰(中国医科大学附属第一医院);吴学玲(上海交通大学医学院附属仁济医院);向菲(华中科技大学同济医学院附属协和医院);许飞(南昌大学第一附属医院);杨澜(四川大学华西医院);杨萌(中日友好医院);杨拴盈(西安交通大学第二附属医院);曾惠清(厦门大学附属中山医院);张艺(兰州大学第一医院);张苑(同济大学附属上海市肺科医院);赵爽(四川大学华西医院);赵欣(南京医科大学第一附属医院);周国武(中日友好医院);周红梅(南方科技大学医院);朱红(北京大学第三医院);朱雨琦(四川大学华西医院) 文献秘书:曾灏(四川大学华西医院);鲜京宏(四川大学华西医院) 参考文献(略) 阅读原文”,阅读全文返回搜狐,查看更多 |
【本文地址】