【微信精品文章】氮及其化合物的分子结构分析 |
您所在的位置:网站首页 › 氮气的杂化方式 › 【微信精品文章】氮及其化合物的分子结构分析 |
【微信精品文章】氮及其化合物的分子结构分析
|
1.2一氧化氮
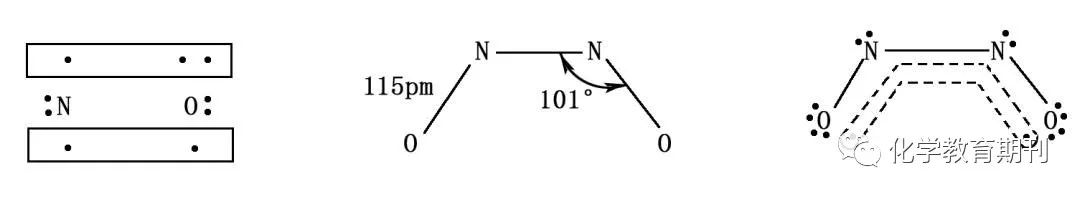
图2 NO、(NO)2分子成键方式及电子云分布 NO为直线型极性分子,键长为115pm。N原子采取sp杂化,分子中有1个σ键,、一个π键和一个大π键(Π23)。N原子上有孤电子对,具有一定的配位能力,可以生成配位化合物。键级为2.5,分子轨道中有单个电子,气态时显示顺磁性,低温下液态和固态显示逆磁性,红外光谱证明 NO 发生了聚合作用,生成了二聚物,结构如图所示,(NO)2在气态和晶体中,N—N 的距离很长,分别为 223.7pm和 218pm,迄今对它们的成键情况还没有满意的解释[2],可能存在离域π键Π44。 1.3氢氰酸和氰
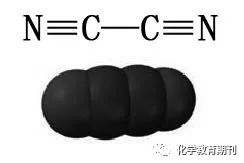
图3 氰分子的模型及成键方式 HCN分子为直线型(H—C≡N),中心碳原子以sp杂化轨道与H(s)、N(px)形成两个σ键,未杂化的py、pz电子与氮原子的py、pz电子形成两个相互垂直的π键,键长(C—H、C—N)为110pm、116pm[3]。HCN为极性分子,其水溶液显弱酸性,ka=1.3×10-9(18℃),酸性比碳酸弱,比碳酸氢根强,因此不能与碳酸盐反应放出CO2。 氰分子如图所示,四原子共直线,是非极性对称性分子,中心两个碳原子采取sp杂化,分别与C、N形成σ键,碳原子剩余未参与杂化的py、pz电子与氮原子的py、pz电子各形成两个相互垂直的π键。 1.4N2O、NO2+和N3-
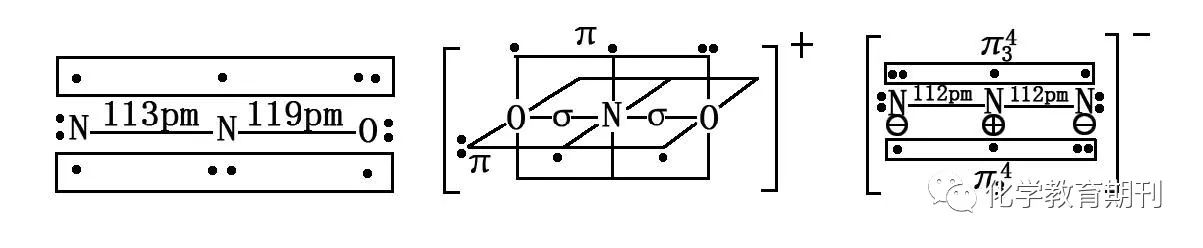
图4 N2O、NO2+和N3-的成键方式 N2O、NO2+和N3-均为CO2的等电子体,三者均为直线型结构。N2O分子中心氮原子采取sp杂化,与两端的N、O的px轨道形成两个σ键,剩余未杂化的py、pz轨道分别与两端的N、O原子的py、pz轨道形成两个相互垂直的离域π键Π34。由于N—N之间的成键强,所以键长比N—O键短一些。 NO2+中间的N原子为sp杂化, 分别与两个O原子形成σ键, N两个剩余的p轨道分别与两个O原子形成两个相互垂直的大π键(Π34), 分子结构为直线形。 N3-中心氮原子先失去1个电子变成带正电的原子,两端的氮原子分别结合外界的电子和中心原子失去的电子变成两个带负电的原子(电子排布左侧为2s2、2px1、2py2、2pz1;右侧为2s2、2px1、2py1、2pz2),然后中心原子采取sp杂化,两个杂化的轨道呈直线形,分别与两端氮原子的px形成两个σ键,然后中心原子未参与杂化的py1、pz1与两端氮原子的py、pz形成两个相互垂直的离域π键Π34。 2 sp2杂化 2.1NO2和N2O4
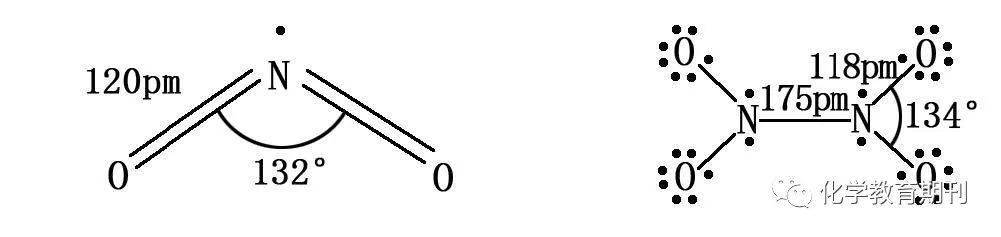
图5 NO2和N2O4的成键方式 NO2分子中氮原子采用sp2杂化,3个杂化轨道各有1个单电子,其中两个杂化轨道分别与两个氧原子的2px1形成两个σ键,另一个杂化轨道的单电子未参与成键;氮原子未参与杂化的2pz2轨道与两个氧原子的2pz1形成离域π键Π34。一对未参与成键的杂化轨道上有一个单电子,由于成键电子对之间的排斥力大于单电子对成键电子的排斥力,所以使得键角大于120°。 NO2分子结构的另外一种解释为:一对孤对电子占据N原子的一个sp2杂化轨道,π电子形成Π33,因为单占的孤对电子能量较高,Π33比Π34 强,对分子稳定有利。但分子的电子自旋共振及分子轨道的量子化学计算结果比较支持第一种观点。[4] NO2二聚体为N2O4分子,中心两个氮原子仍采用sp2杂化,3个杂化轨道全部参与成键,形成5个σ键;未参与杂化的2pz2轨道分别与两个氧原子的2pz1形成两个离域π键Π34(另一说法为一个离域π键Π68),由于氧原子的电负性大,对成键电子对的斥力增加,N-N键长较大(正常键长145pm),ONO之间的夹角也稍变大。 2.2N2O3和N2O5
图6 N2O3和N2O5的成键方式 N2O3分子中N原子均采用sp2杂化,其中左侧的氮原子采用不等性杂化,有一个杂化轨道上有一对孤电子,右侧的氮原子采取等性杂化,杂化轨道一共形成了4个σ键。两个N原子未参与杂化的2pz1、2pz2轨道分别与其他三个氧原子的2pz1形成一个离域π键Π56(另一说法左侧为正常π键,右侧为离域π键Π34)。 N2O5分子与N2O3分子成键结构非常相似,每个N原子采用等性sp2杂化与其他三个O原子形成6个σ键,每个N原子未杂化的2pz2轨道与其他两个氧原子的2pz1分别形成一个离域π键Π34,中心氧原子采用sp杂化呈直线型,整个分子为一个平面结构。 2.3亚硝酸及亚硝酸根
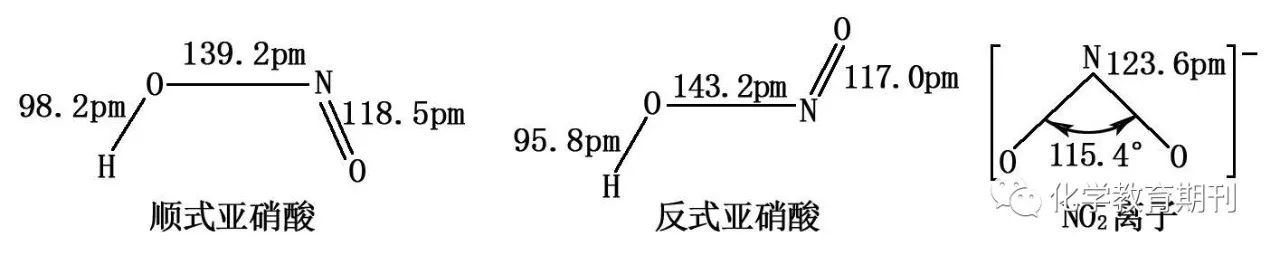
图7 亚硝酸及亚硝酸根离子的结构 亚硝酸分子中心氮原子采取sp2杂化,其中1个杂化轨道有一对孤对电子,2个杂化轨道各有1个单电子,分别与两个氧原子的2px1形成两个σ键;氮原子未参与杂化的2pz1轨道与端基氧原子的2pz1形成π键。两种结构中反式比顺式稳定。[5] NO2-的中心氮原子得到一个电子,采用sp2杂化,其中2个杂化轨道各有1个单电子,分别与两个氧原子的2px1形成两个σ键;氮原子未参与杂化的2pz2轨道与两个氧原子的2pz1形成离域π键Π34。氮原子未参与成键的杂化轨道上有一孤对电子,由于孤对电子对成键电子对之间的排斥力大于成键电子对之间的排斥力,所以使得ONO键角小于120°。 2.4硝酸及硝酸根
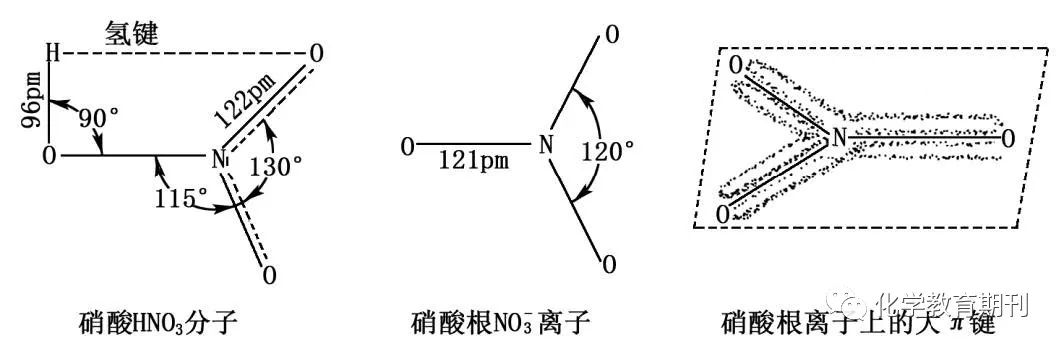
图8 硝酸和硝酸根离子的结构 硝酸分子中心氮原子采用sp2杂化,3个杂化轨道各有1个单电子,分别与三个氧原子的2px1形成三个σ键;氮原子未参与杂化的2pz2轨道与端基两个氧原子的2pz1形成离域π键Π34。 根据VSEPR理论计算: 硝酸根离子的孤电子对l=(6-2*3)1/2=0 m=n+l=0+3=3,则中心氮原子采取sp2杂化形式,杂化轨道为平面三角形,任意两个N—O键之间夹角均为120°。硝酸根离子中,中心氮原子以三个等性sp2杂化轨道分别与三个氧原子形成σ键,未参与杂化的2pz2轨道与端基三个氧原子的2pz1以及从外界得到的1个电子形成离域π键Π46。 3 sp3杂化 3.1NH3和NH4+
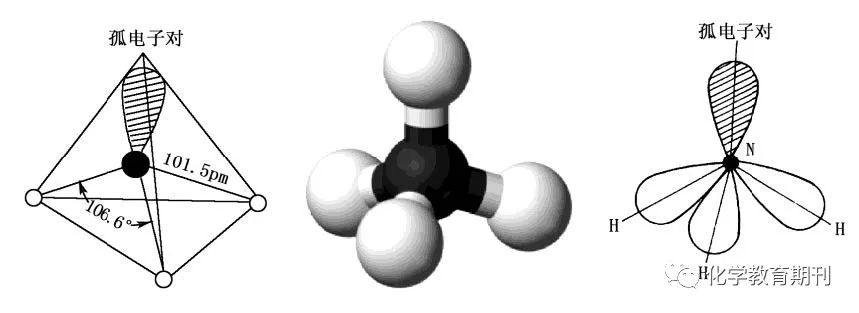
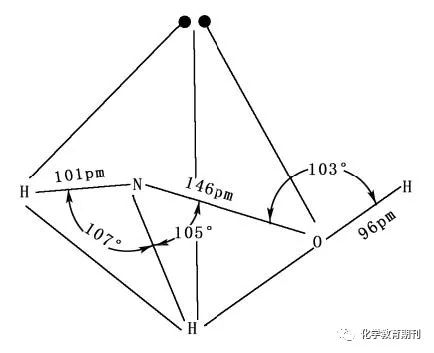
图9 NH3和NH4+的结构 NH3分子中氮原子采取不等性sp3杂化,其中含有单电子的三个杂化轨道与三个氢原子形成σ键,另一杂化轨道有一对孤电子对,由于孤电子对对成键电子的排斥作用大于成键电子对之间的排除作用,所以相邻N—H之间的夹角不是正四面体的109°28',而是106.6°,分子形状为三角锥型,加上N原子上的孤电子对使得NH3分子有强极性且易形成氢键,也易形成配合物。 NH4+与甲烷为等电子体,中心原子N失去一个电子后采用等性sp3杂化,每个杂化轨道有一个单电子,与四个氢原子形成σ键,相邻N—H之间的夹角是109°28',构型为正四面体。 3.2N2H4
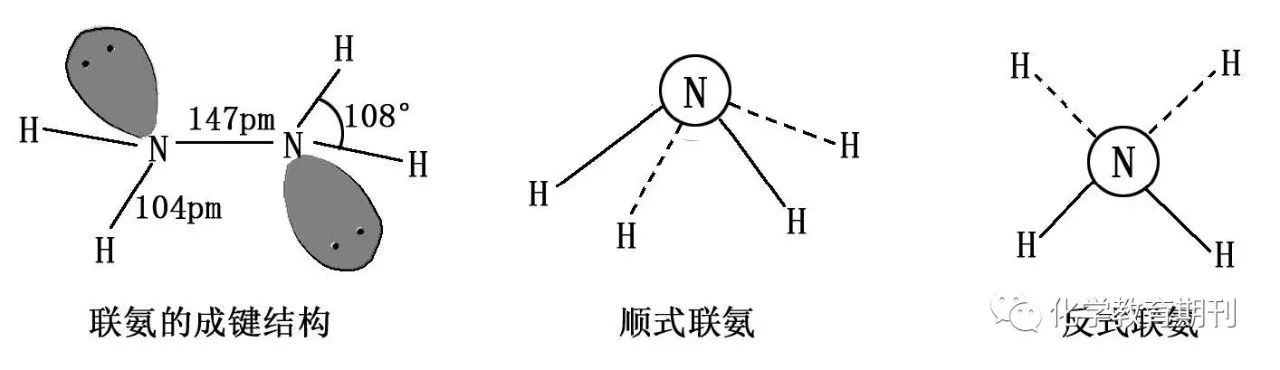
图10 联氨的结构及投影图 N2H4分子中氮原子采用不等性sp3杂化,形成5个σ键后每个氮原子剩余一对孤电子对,所以可与金属离子形成配位化合物。N2H4 有顺式和反式两种构象, 沿N-N键方向观察,得到两种投影图,如图10所示。根据联氨分子具有很大的极性,可判断它的稳定构型为顺式结构。 3.3NH2OH
图11 羟氨的成键结构 羟胺可以看做氨分子中的氢原子被羟基取代的产物,分子中的氮原子采用不等性sp3杂化,除成键之外还有一对孤电子对,可以作为配位体形成配合物。 4 混合杂化 4.1叠氮酸
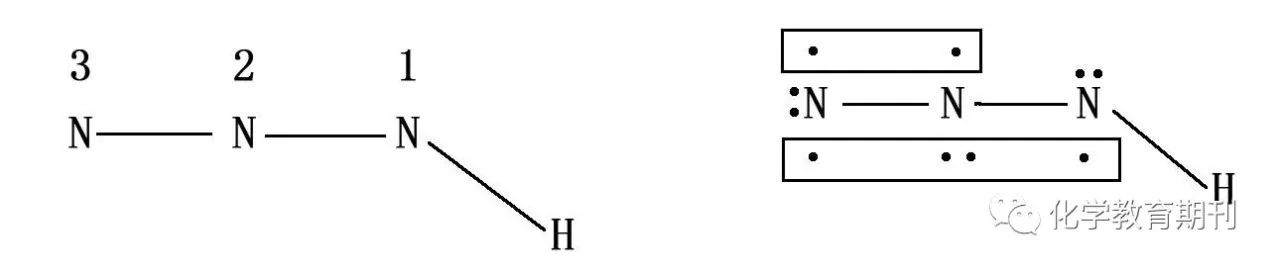
图12 叠氮酸的成键结构 联氨被亚硝酸氧化时,得到叠氮酸HN3。N1采取sp2不等性杂化,N2、N3采取sp杂化,在N2、N3之间有一个正常的π键,在N1、N2、N3之间还有一个离域π键Π34。HN3是氮的氢化物中唯一的弱酸性物质,其酸性类似于醋酸,Ka=1.8×10-5。[6] 4.2N5+
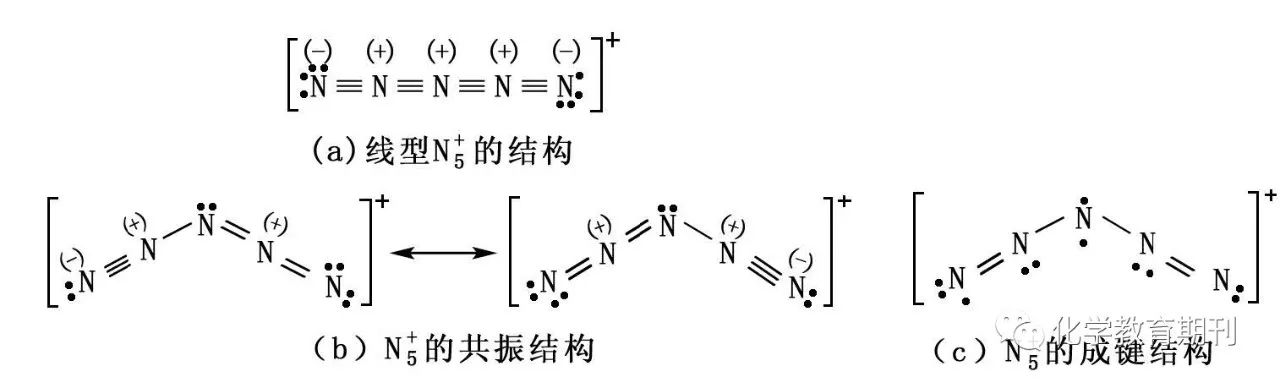
图13 N5+的成键结构 根据X射线实验的结果,N5+所有原子共面,空间构型为V形,中心氮原子采用sp2杂化,靠近端基的氮原子采用sp杂化,由于孤电子对的排斥作用,中心氮原子的键角小于120°,为111°[7]。笔者认为除了共振结构外,也可以解释为:中心氮原子失去一个电子后采用sp2等性杂化,呈平面三角形,杂化轨道上各有单电子,其中两个形成σ键,然后两端靠近端基的氮原子采用sp杂化,与其他原子形成σ键外,再与端基N原子形成一个正常的πy键,这样中心原子未参与杂化的pz1和其他氮原子剩余的pz轨道上的电子形成离域π键Π57,如图c所示。由于该结构含有单电子,极不稳定,室温下就可能爆炸。 综上所述,分子的几何构型是讨论分子成键的根据。当氮原子和周围原子呈直线型配位时,氮原子以sp杂化成键;当氮原子和周围原子或孤电子对呈平面三角形配位时,氮原子以sp2杂化成键,剩余的p轨道通常参与离域π键的形成;当氮原子和周围原子呈三角锥形或四面体时,氮原子以sp3杂化成键。
参考文献 [1] 武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:645 [2] 麦松威,周公度,李伟基.高等无机结构化学.北京:北京大学出版社,2006:413-415 [3] 周公度.化学辞典.2版.北京:化学工业出版社,2010:518 [4] 周公度,段连运.结构化学基础.4版.北京:北京工业大学出版社,2008:164 [5] 武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:663 [6] 武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:657 [7] 互动百科,http://www.baike.com/wiki/氮五正离子.html
图片来源 图1:1、3幅,武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:663,644—645; 2、4副,华南师范大学无机化学精品课程[EB/OL],http://202.116.45.198/wjhx/wjhx03/ziliaoku/jiegou/jiegou2.html 图2:麦松威,周公度,李伟基.高等无机结构化学.北京:北京大学出版社,2006:413-415 图3:搜狗百科图片,http://pic.baike.soso.com/p/20140507/20140507173221-1272444163.jpg 图4:1副,武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:660; 2、3副,华南师范大学无机化学精品课程[EB/OL],http://202.116.45.198/wjhx/wjhx03/ziliaoku/jiegou/jiegou2.html, 图5:华南师范大学无机化学精品课程[EB/OL],http://202.116.45.198/wjhx/wjhx03/ziliaoku/jiegou/jiegou2.html, 图6:华南师范大学无机化学精品课程[EB/OL],http://202.116.45.198/wjhx/wjhx03/ziliaoku/jiegou/jiegou2.html 图7:武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:663 图8:武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:667 图9:1副,武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:663 2副,维基百科图片,http://wiki.gateway.frdic.com/wikipedia_zh/I/m/Ammonium-3D-balls.png 图10:百度文库,https://wenku.baidu.com/view/3d089959ed630b1c58eeb55d.html 图11:武汉大学、吉林大学等.无机化学(下册).3版.北京:高等教育出版社,2001:658 图12:百度文库,https://wenku.baidu.com/view/3d089959ed630b1c58eeb55d.html 图13:百度百科,https://baike.baidu.com/pic/氮五正离子.html 微信征稿:观点评述、教学案例、教学心得、微课视频、实验视频、趣味实验、活动报道、科普文章、论文交流、人物事迹、试题评析等,新鲜、热门、有趣、实用,统统都可以,让分享促进你我成长,让传播增强化学力量!如果文章阅读人数超过3000,朋友圈分享人数超过300,则赠送1套全年《化学教育》!投稿邮箱:[email protected],邮件主题请写明“微信投稿”。鼓励原创,若参考了他人的文章,请注明来源,以免引起抄袭和剽窃的争议。返回搜狐,查看更多 |
【本文地址】