NMPA受理首个AKT靶点药物Capivasertib!乳腺癌患者治疗迎来新曙光@MedSci |
您所在的位置:网站首页 › 氟维司群用多久有耐药性 › NMPA受理首个AKT靶点药物Capivasertib!乳腺癌患者治疗迎来新曙光@MedSci |
NMPA受理首个AKT靶点药物Capivasertib!乳腺癌患者治疗迎来新曙光@MedSci

来源:CDE官网 Capivasertib是一种高效选择性抑制剂,可以针对AKT亚型(AKT1/2/3)进行作用。AKT,也称为磷酸激酶B (PKB),在多种级联信号传导机制中扮演重要角色,涉及细胞生长和分裂、细胞凋亡抑制以及血管生成。AKT信号通路的激活可能出现在许多HR+/HER2-晚期乳腺癌患者中,这与PIK3CA、AKT1和PTEN的改变有关,但也可能在没有这些基因改变的患者中观察到。 Capivasertib基本信息(截至2023.10.09)
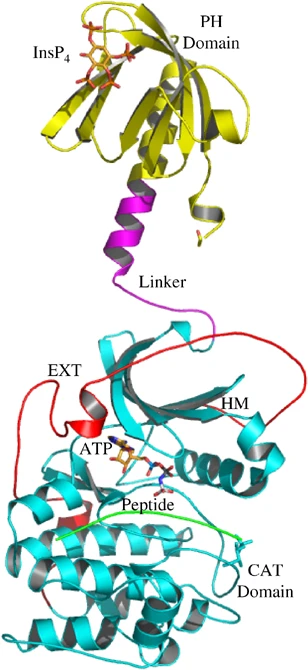
来源:全球药物研发数据库 【AKT的靶点机制】 AKT属于一类丝氨酸/苏氨酸激酶,又称 蛋白激酶B(PKB),是经典信号通路 PAM 中的关键分子。PAM 即磷脂酰肌醇3-激酶(PI3K)- AKT-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,参与调控肿瘤细胞的增殖、分化和凋亡等过程,是抗肿瘤药物研发关注的重要信号通路之一。 AKT 位于PI3K-AKT-mTOR 通路的核心位置,有3 种亚型:AKT1、AKT2 和AKT3,三者具有相似的结构,均由氨基末端的PH 结构域、中部的激酶结构域(ATP 结合域)和羧基末端的调节结构域组成。
AKT通过磷酸化多种激酶和转录因子来调节细胞功能。以下是一些例子: 1. 磷酸化TSC1/TSC2复合体:AKT磷酸化TSC1/TSC2复合体,进而激活mTORC(mTOR复合体),从而促进蛋白质的合成和细胞生长。 2. 抗凋亡机制:AKT通过磷酸化多种下游蛋白,参与抗凋亡过程。例如,AKT磷酸化BCL-2家族成员BAD,阻止其与BCL-XL结合,从而抑制凋亡信号。 3. 转录因子的调节:AKT磷酸化转录因子FOXO1,阻止其进入细胞核,抑制其转录激活作用。另外,AKT活化也导致抑制因子IκB的降解,从而增加核转录因子NF-κB的核转位,激活其靶基因表达,促进细胞迁移和侵袭等过程。 综上所述,AKT通过磷酸化多种激酶和转录因子,对细胞的生长、凋亡、迁移和侵袭等功能进行调节。 AKT信号通路的异常激活与多种肿瘤有关。当前的研究认为,这种异常激活可能与多个因素相关,包括PTEN基因的突变或缺失,以及AKT1、AKT2、AKT3和PIK3CA基因的突变或扩增。此外,异常激活的AKT信号通路在一些肿瘤类型中更为普遍,如复发性卵巢癌、乳腺癌和前列腺癌等。
[研究背景] 该项NDA是基于一项代号为CAPItello-291的III期试验数据。研究共纳入708例HR+/HER2-晚期乳腺癌患者,这些患者在接受芳香化酶抑制剂治疗期间或之后疾病复发或进展。研究旨在评估Capivasertib+氟维司群对比安慰剂+氟维司群的疗效和安全性。 主要终点方面,在全体人群中,capivasertib+氟维司群组和安慰剂+氟维司群组的中位PFS分别为7.2个月和3.6个月,capivasertib+氟维司群将疾病进展或死亡风险降低了40%(HR=0.60(0.51-0.71,two-sided P<0.001)。  Capivasertib在国内有至少5项III期临床试验在进行中,适应症包括激素受体阳性和人表皮生长因子受体2阴性的晚期乳腺癌、联合多西他赛用于治疗既往经过新型内分泌药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌、新发PTEN缺失的转移性激素敏感性前列腺癌、三阴性乳腺癌等。
Capivasertib在国内有至少5项III期临床试验在进行中,适应症包括激素受体阳性和人表皮生长因子受体2阴性的晚期乳腺癌、联合多西他赛用于治疗既往经过新型内分泌药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌、新发PTEN缺失的转移性激素敏感性前列腺癌、三阴性乳腺癌等。
Capivasertib部分适应症研发进度(截至2023.10.09) 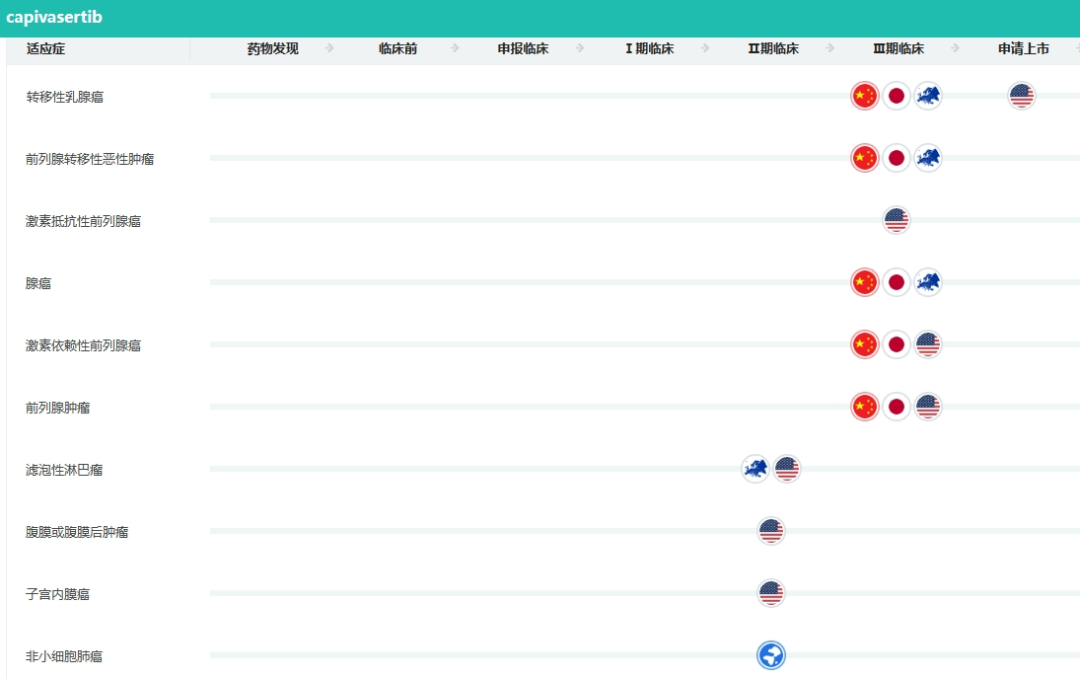
来源:全球药物研发数据库
【关于AKT未来展望】 AKT抑制剂的作用机制非常复杂,并受到许多影响因素的调节。因此,在临床研究中,AKT抑制剂仍面临许多挑战。这些挑战包括药物的多靶点抑制、缺乏精准选择、生物利用度低、严重的不良反应、不足的治疗效果,以及狭窄的治疗窗口等缺点。此外,还需要探索更合适的给药间隔和频次等问题。未来,需要进一步改进和提升这类药物的效能,以使其具有临床应用的价值。 参考文献: 【1】DOI:10.1186/S13058-023-01716-2 【2】van der Ploeg, Phyllis et al. “The effectiveness of monotherapy with PI3K/AKT/mTOR pathway inhibitors in ovarian cancer: A meta-analysis.” Gynecologic oncology vol. 163,2 (2021): 433-444. 【3】Kumar, Chandra C, and Vincent Madison. “AKT crystal structure and AKT-specific inhibitors.” Oncogene vol. 24,50 (2005): 7493-501. 编辑:Potato
|
【本文地址】
今日新闻 |
推荐新闻 |