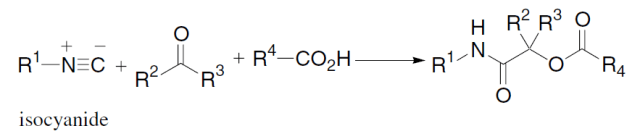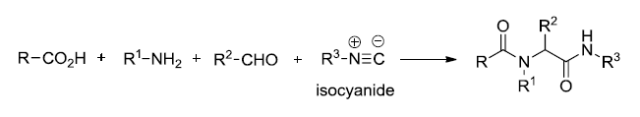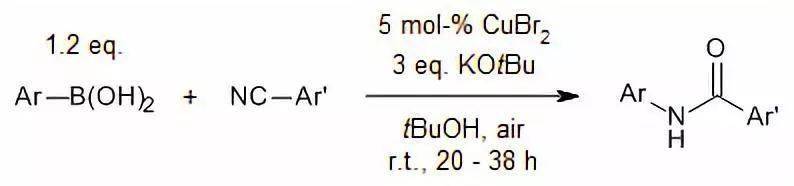最全酰胺的制备汇总 |
您所在的位置:网站首页 › 有机铵盐 › 最全酰胺的制备汇总 |
最全酰胺的制备汇总
|
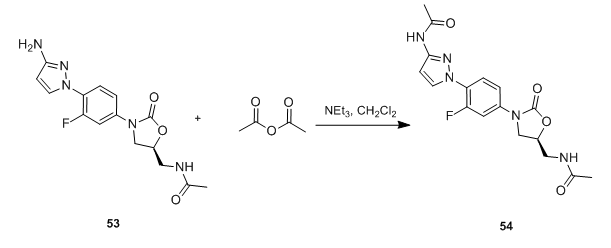
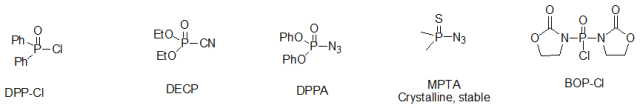
四、 (酰氯、酰溴和酰氟)与氨或胺作用是合成酰胺的最简便的方法。通过酰氯、酰溴与脂肪族、芳香族胺均可迅速酰化,以较高的产率生成酰胺。酰氟对水和其他亲核试剂较为稳定。其可通过三氟均三嗪在吡啶的存在下制备(Tetrahedron lett. 1991,32(10),1303)。并可以通过层析分离出来。一般酰氯、酰溴与胺反应是放热的,有时甚至极为激烈,因此通常在冰冷却下进行反应,亦可使用一定量的溶剂以减缓反应速度。常用溶剂为二氯乙烷、乙醚、四氯化碳、甲苯等。由于反应中生成的卤化氢,因此需要用碱除去卤化氢,以防止其与胺成盐。有机碱和无机碱均可用于此类反应,常用的有机碱有三乙胺、吡啶等,常用的无机碱有 Na2CO3,NaHCO3, K2CO3,NaOH, KOH等。在研究中我们发现,许多反应用无机碱反应更干净且容易处理。 (点击查看:酰卤的制备 ) 甲酸铵脱苄基或Cbz后酰基化是不是有原料M+28的副产物? 五、利用有机磷类缩合剂制备酰胺 多种磷酸酯和磷酰胺类缩合剂也被广泛应用于酰胺的缩合。如二苯基磷酰氯(DPP-Cl)、氰代磷酸二乙酯(DECP)、叠氮化磷酸二苯酯(DPPA、硫代二甲基磷酰基叠氮(MPTA)、二(2-氧-3-唑烷基)磷酰氯(BOP-Cl)等。
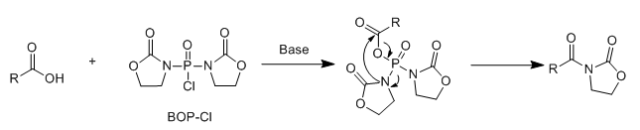
在这些磷酸酯和磷酰胺类缩合剂中,DECP常用于小量的多肽的合成,BOP-Cl特别适合与氨基酸的合成,其收率高、不易消旋,但其缺点是,当胺的反应活性低时,常常得到酰化的唑烷。
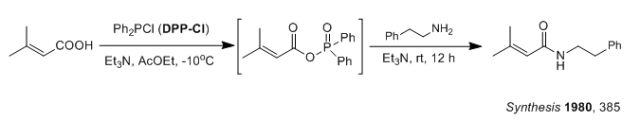
另外,BOP-Cl的溶解性较差,导致反应时间较长,有时会长达四五天,常用DMF做反应溶剂。 以下反应用DCC只有15%的收率, 但用DPP-Cl可以得到94%收率。
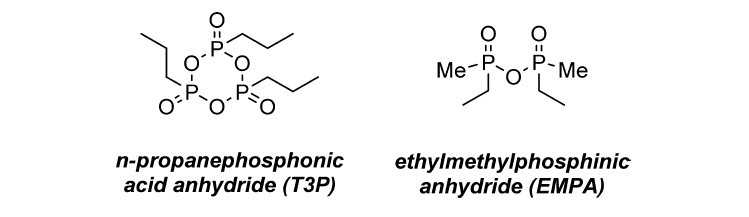
羧酸-磷酸混酐制备酰胺 (点击查看详细内容) 另外有更加适合放大的制备羧酸-磷酸混酐的试剂被发现,如正丙基膦酸酐(T3P)和乙基甲基次膦酸酐(EMPA),下面作详细介绍。
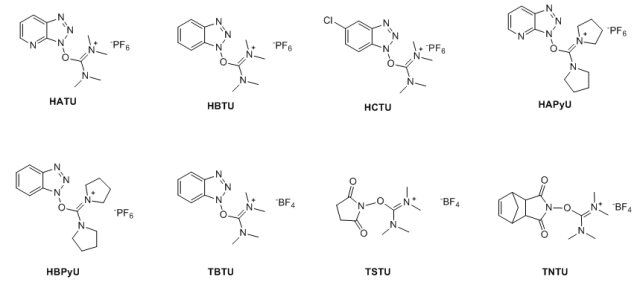
正丙膦酸酐,通常被称为T3P,是在1980年作为肽偶联剂被开发出来的【 Angew. Chem., Int. Ed. Engl. 1980, 19, 133.】。在过去的十年中,这种试剂已经实现了大规模制备酰胺【(a) Synthesis 2013, 45, 1569. (b) Synlett 2000, 1369. (c) Synlett 2007, 1328.】。 六、利用鎓盐类缩合剂制备酰胺 近年来,许多盐缩合剂被相继开发出来用于酰胺的缩合反应,从盐的种类来分,主要有两类,一类是碳鎓盐,目前常用的为O-(7-氮杂苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(HATU)、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(HBTU)、O-(5-氯苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(HCTU)、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓四氟硼酸盐(TBTU)、O-(N-丁二酰亚胺基)-二(二甲胺基)碳鎓四氟硼酸盐(TSTU)、O-(N-endo-5-降莰烯-2,3-二碳二酰亚胺)-二(二甲胺基)碳鎓四氟硼酸盐(TNTU)等。
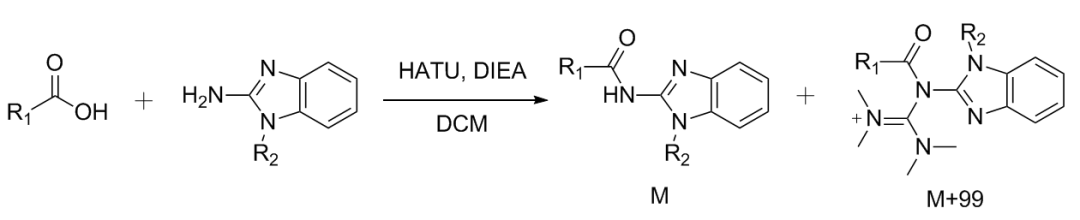
HATU作为缩合剂的酰胺化反应中的副产物
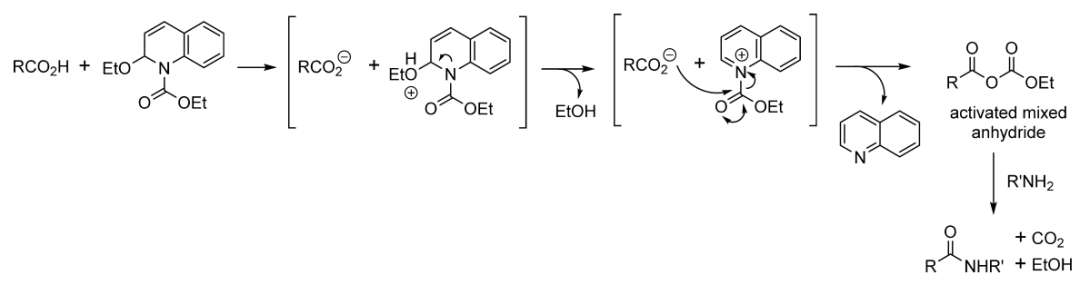
七、碳二亚胺类缩合剂制备酰胺 利用碳二亚胺类缩合剂缩合制备酰胺在药物合成中应用极为广泛,目前常用的缩合剂主要有三种:二环己基碳二亚胺( DCC) 、二异丙基碳二亚胺( DIC) 和1-(3-二甲胺基丙基)-3-乙基碳二亚胺( EDCI) 。 八、活性酯法制备酰胺 活性酯法早期主要应用酸与氯甲酸乙酯或异丁酯反应生成混合酸酐,而后再与胺反应得到相应的酰胺,这一反应如果酸的a-位位阻大或者连有吸电子基团,有时会停留在混合酸酐这一步,但加热可以促使其反应;这一反应也可用于无取代酰胺的合成。 酰胺化试剂----EEDQ
九、制备酰胺的非常规方法 酰基叠氮也是一个较为温和的酰化试剂,由于在反应时其不会引起光学活性物质的 消旋且对水及其他亲核试剂较为稳定,因而常用于肽及化合物库的合成.但酰基叠氮由于反应活性低,对于位阻大且亲核性低的胺是不适用的。
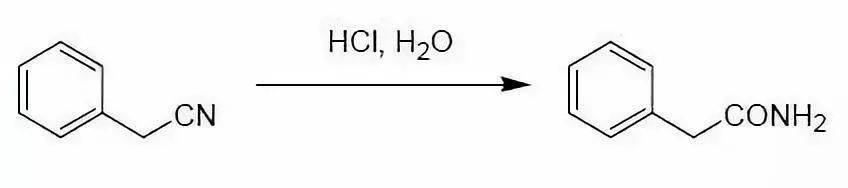
十、腈合成酰胺 腈加水可以分解为伯酰胺。由于伯酰胺会继续水解为羧酸,一般要控制水解的条件。 目前有许多方法报道,有时需要根据底物的特性选择酸性,碱性或中性的水解条件。作为中性的条件,也有文献报道使用镍或钯催化剂的方法。 在酸性条件下与饱和碳相连的氰基,可以在酸中很方便的水解转化为酰胺,并在条 件较为剧烈时,很容易进一步水解成酸。但乙烯基或芳基腈的水解条件则要求剧烈得多,一般需要强酸条件,而且一般不会进一步水解。 在碱性条件下,利用过氧化氢氧化的方法可在室温下短时间内水解腈为伯酰胺,这 是一个较为可靠的方法。利用NaOH(aq.)-CH2Cl2 相转移催化体系,DMSO-K2CO3 体系,可以用于各种腈水解为伯酰胺。
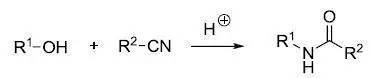
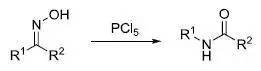
十一、Ritter反应
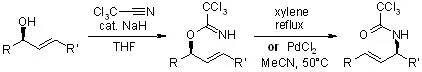
在强酸环境下醇和腈反应制备酰胺的反应。 十二、 Overman重排
通过烯烃的1,3-位置互换将烯丙基三氯乙酰亚胺酯转化为烯丙基三氯乙酰胺进而将烯丙醇转化为烯丙胺的反应。 十三、Passerini反应
羧酸,C-异氰化合物和羰基化合物三组分缩合得到α-酰氧基酰胺的反应,此反应与 Ugi反应类似。 十四、 Ugi反应
羧酸, C -异腈,胺和羰基化合物进行四组分缩合得到二酰胺(二肽)的反应。 十五、Schotten-Baumann反应 1884年,C. Schotten报道了在水中氢氧化钠存在下由哌啶和苯甲酰氯反应高效合成N-苯甲酰基哌啶的反应。1886年,E. Baumann发现在相同的反应条件下,醇和苯甲酰氯反应可以得到苯甲酸酯,醇和苯甲酰氯在水中混合,然后加入氢氧化钠水溶液,产物酯可以快速高产率的析出。Baumann还发现多羟基的化合物如葡萄糖和甘油也可以利用此反应进行苯甲酰化。在碱的水溶液催化下,醇或胺与酰卤或酸酐反应制备酯或酰胺的反应被称为 Schotten-Baumann反应。 十六、Polonovski反应
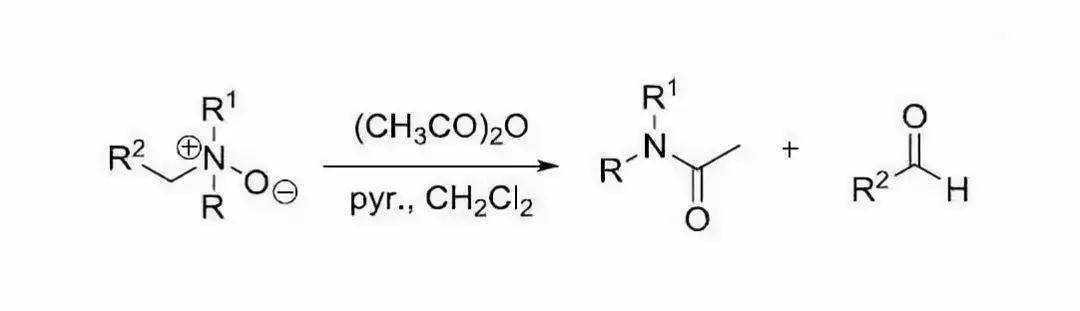
叔胺的氮氧化物用活性试剂(如乙酸酐)处理,重排生成 N,N-二取代乙酰胺和醛的反应。 十七、Schmidt重排
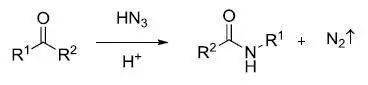
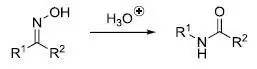
Schmidt反应是指酸催化下叠氮酸或叠氮化合物和亲电试剂(羰基化合物,叔醇和烯烃)反应重排放出氮气得到胺,腈,酰胺或亚胺的反应。 十八、
在酸催化下肟重排得到酰胺的反应 十九、 Wolff重排 α-重氮酮重排得到烯酮的反应。烯酮是非常重要的有机中间体。可以和水反应制备羧酸,和醇反应制备酯,和胺反应制备酰胺,发生 Staudinger烯酮环加成合成各种四元环化合物(可以和烯烃,醛酮和亚胺进行 [2 + 2] 环加成得到环丁酮,β -内酯和β -内酰胺)。 二十、Eschenmoser–Claisen酰胺缩酮重排
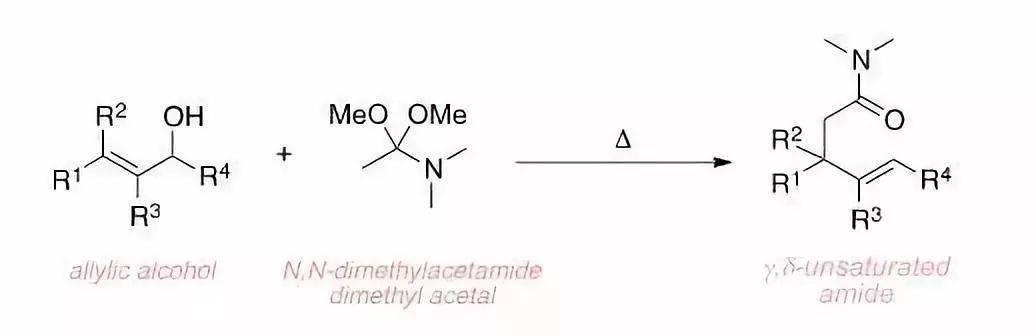
烯丙醇类化合物和N,N-二甲基乙酰胺二缩酮在加热条件下重排得到γ,δ-不饱和酰胺的反应。由于Eschenmoser是基于Meerwein对于酰胺交换的研究而发现此反应,此反应也被称为Meerwein–Eschenmoser–Claisen重排。 二十一、Chan–Lam C–X偶联反应
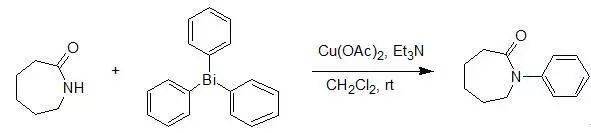
【 Synthesis , 2017, 49, 1834-1838】 酰胺类化合物或腈和硼酸反应得到多取代的酰胺。 二十三、Goldberg偶联反应 酰胺类化合物和芳香卤代物反应得到多取代的酰胺。 二十四、Buchwald_Hartwig反应 酰胺类化合物和芳香卤代物反应得到多取代的酰胺 二十五、铜盐催化下三芳基铋和酰胺反应 铋盐参与的芳基化最近也有一些报道,且收率较相应的硼酸为好。它的反应条件更为温和,可以在室温条件下反应完全。铋盐除了可以对简单的酰胺进行芳酰胺化外,还可以对酰亚胺,脲以及磺胺等进行芳酰胺化。由于铋盐存放在空气中是稳定的,因此其反应操作简便。但是三芳基铋一般需要自制并且当芳环上有强吸电子基团时不易合成,这也是用三芳基铋进行芳酰胺化的局限性。当酰胺的N上没有取代基时,会发生二芳基化产物,所以三芳基铋较多用来内酰胺和仲酰胺的芳酰胺化。当底物位阻较大时,可以将溶剂换成氯仿,从而提高反应的温度,反应的转化率也较高。
A slurry of thesubstrate, triphylbismuth (1.1 eq), anhydrous Cu(OAc) 2 (1.0 eq.),the teriary amine (1.0 eq.) in methylene chloride (2.5 ml / mmol of substrate)was stirred at room temperature for 24 hr. the products were isolated by direchflash column chromatography of the crude reaction mixture with preabsorption onsilica gel in 93%.
二十七、Kinugasa β-内酰胺合成反应
二十八、Breckport β-内酰胺合成
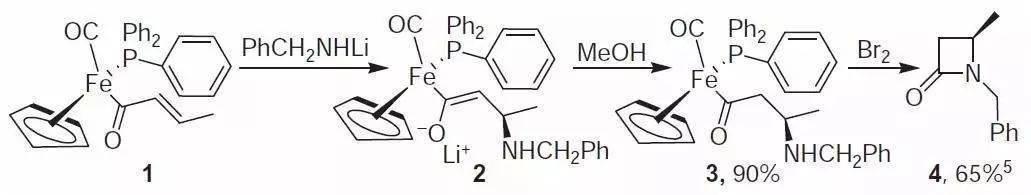
二十九、Davies铁手性助剂
三十、氮上含有活泼氢的酰胺通过Mitsunobu反应 和醇反应进行烷基化得到复杂酰胺。由于酰胺氢有一定的酸性也可以通过强碱(如NaH)拔氢后直接烷基化。 三十一、Alper羰基化反应
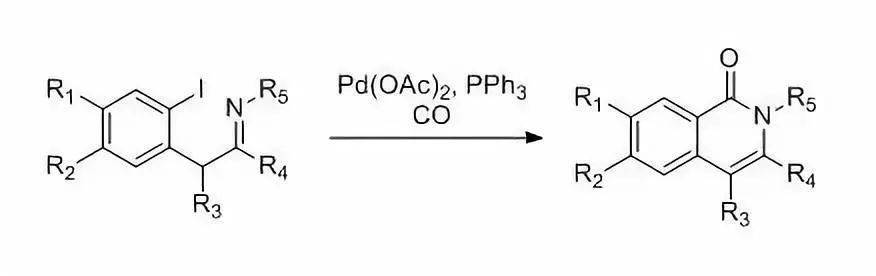
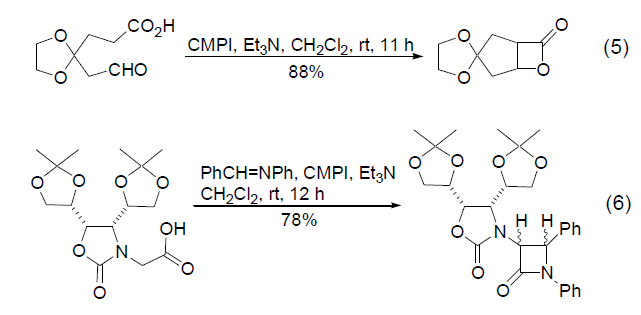
邻位含有脂肪胺的卤代芳烃,烯基胺,烯基氮杂环丙胺等等和一氧化碳在Pd,Ru或Rh等催化剂催化下,进行插羰关环制备环酰胺的反应。 三十二、Snieckus氨基甲酸酯重排 氨基甲酸- O -芳基酯进行邻位金属化后,氨基甲酰基由氧迁移到邻位的碳上得到邻酚基苯酰胺的反应。与 Hauser–Beak反应 类似。空间位置相近的位点也可以进行反应。 三十三、常用试剂----Mukaiyama试剂 CMPI促进的羧酸与亚胺生成β-内酰胺的反应也具有重要的合成价值 (式6)[12],但是高分子负载试剂不能发生该反应。如果将吡啶环上的氯原子换为碘原子生成改良的Mukaiyama试剂,在超声的条件下也可以得到满意的结果[13]。
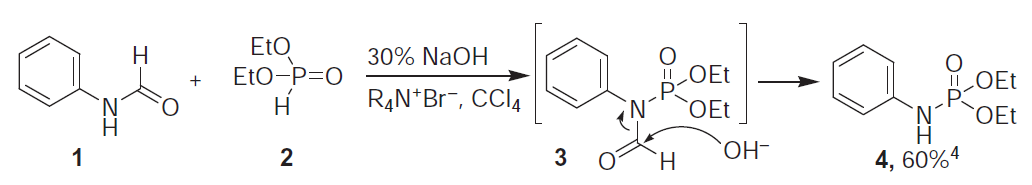
三十四、Atherton-Todd反应 制备磷酰胺
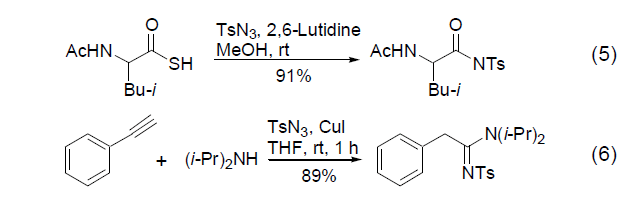
亚磷酸二乙酯的P-H键在温和的碱性条件下与四氯化碳的作用,把P-H键转换成P-Cl键,接着和胺反应合成磷酰胺。 三十五、常用试剂----二氯亚磷酸苯酯 合成磷酰胺 三十六、常用试剂----对甲苯磺酰叠氮 TsN3 与硫代羧酸在室温下反应可以方便地生成相应的酰胺是一个非常有趣的结果(式5)[11]。而TsN3在CuI 的存在下与一分子胺和炔发生的反应非常值得关注 (式6)[12]。
三十七、Arndt–Eistert同系化反应 反应如果在醇类或胺类存在下进行,则生成相应的酯或酰胺。 三十八、 插羰反应制备羧酸及其衍生物实例 插羰反应也可以制备酰胺。 三十九、 Minisci反应
四十、其他 【有机合成路线】返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |