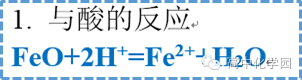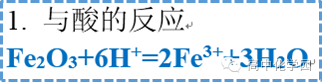高中化学元素及其化合物方程式总结! |
您所在的位置:网站首页 › 有机金属化合物的反应方程式怎么写 › 高中化学元素及其化合物方程式总结! |
高中化学元素及其化合物方程式总结!
|
3 过氧化钠 3 过氧化钠
4 碳酸钠 4 碳酸钠
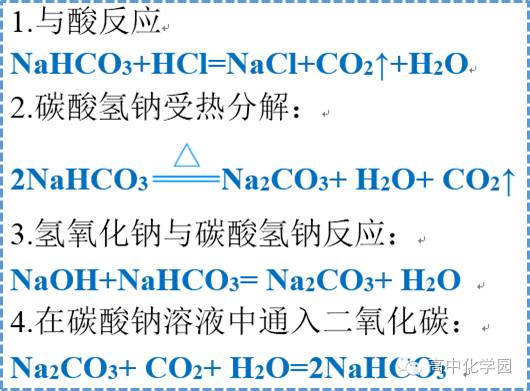
5 碳酸氢钠 5 碳酸氢钠
6 氢氧化钠 6 氢氧化钠
铝及其化合物 铝及其化合物 1 铝单质 1 铝单质
2 氧化铝 2 氧化铝
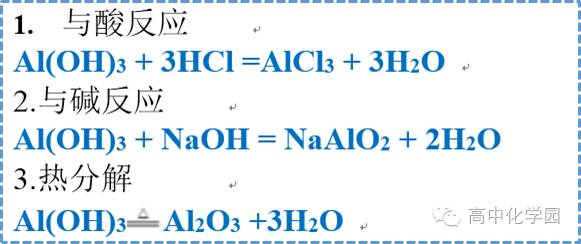
3 氢氧化铝 3 氢氧化铝
4 铝盐和偏铝酸盐 4 铝盐和偏铝酸盐
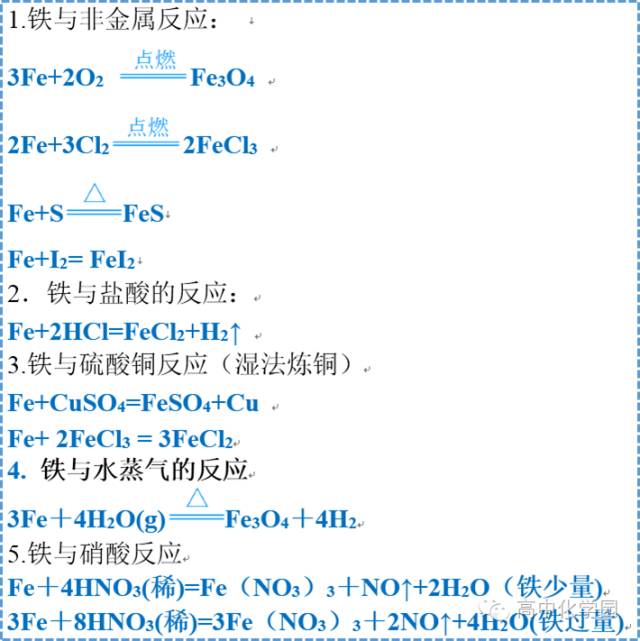
铁及其化合物 铁及其化合物 1 铁单质 1 铁单质
2 氧化亚铁(FeO) 2 氧化亚铁(FeO)
3 氧化铁 3 氧化铁
4 四氧化三铁 4 四氧化三铁 5 氢氧化亚铁 Fe(OH) 2 5 氢氧化亚铁 Fe(OH) 2
6 氢氧化铁 Fe(OH) 3 6 氢氧化铁 Fe(OH) 3
7 亚铁盐与铁盐相互转化 7 亚铁盐与铁盐相互转化
镁及其化合物 镁及其化合物
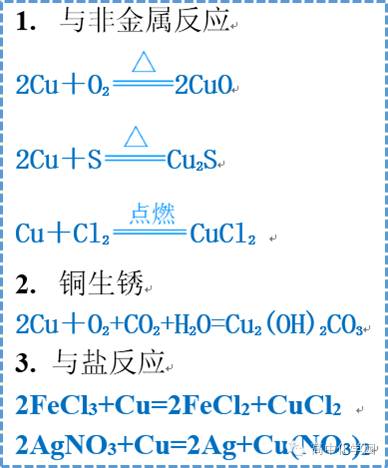
铜及其化合物 铜及其化合物
硅及其化合物 一、硅 Si+O2 SiO2 Si+2NaOH+ H2O=Na2SiO3+2H2↑ 二、二氧化硅(和二氧化碳比较) 1、与酸反应 SiO2 + 4HF=SiF4↑+2H2O 2、与烧碱反应 SiO2+2NaOH = Na2SiO3+H2O 2NaOH+CO2(少量)=Na2CO3+H2O NaOH+CO2(过量)=NaHCO3 3、与CaO反应 SiO2+CaO CaSiO3 CaO+CO2=CaCO3 4、与碳酸盐反应 SiO2+Na2CO3Na2SiO3+CO2↑ SiO2+CaCO3CaSiO3+CO2↑ 5、制取粗硅: 2C+ SiO2 2CO↑ + Si 由粗硅制纯硅: Si(粗)+2Cl2 SiCl4 SiCl42 Si+4HCl 三、硅酸 H2Si03+2NaOH=Na2SiO3+2H2O 四、硅酸盐 Na2SiO3+2HCl=2NaCl+H2SiO3↓ Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓ 氯及其化合物 一、氯气 1、新制氯水变质的原理 2HClO 2HCl+O2↑ 2、与金属钠反应 2Na+Cl22NaCl 3、与金属铁反应 2Fe+3Cl22FeCl3(常温下,干燥的铁和Cl2不反应) 4、与金属铜反应 Cu+Cl2CuCl2 5、与氢气反应 H2+Cl22HCl;H2+Cl22HCl 6、与水反应 7、制漂白液 Cl2+2NaOH=NaCl+NaClO+H2O 8、制漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 9、漂白原理 漂白粉在空气中变质 Ca(ClO)2+H2O+CO2(少量)= CaCO3↓+2HClO Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO Ca(ClO)2+2H2O+2CO2(足量)= Ca(HCO3)2↓+2HClO Ca(ClO)2+HCl=CaCl2+2HClO (强酸制弱酸) 10、实验室制法 MnO2+4HCl(浓) MnCl2+Cl2↑2O 11、Cl2的检验(使湿润的KI-淀粉试纸变蓝) Cl2+2KI=2KCl+I2 二、氯水 1、氯离子的检验 Ag++Cl―=AgCl↓ 三、次氯酸 HClO+H2O+SO2=H2SO4+HCl 四、卤素 2F2+2H2O=4HF+O2 2Cl2 +NaBr=2NaCl+Br2 Cl2 +2KI=2KCl+I2 Br2 +2KI=2KBr+I2 Ag++Br―=AgBr↓(浅黄色) Ag++I―=AgI↓(黄色) 硫及其化合物 一、硫(俗称硫黄) S+O2 SO2 H2+S H2S Fe+S FeS 2Na+S Na2S 2Cu+S Cu2S 二、二氧化硫 2SO2+O2 2SO3 SO2+H2O⇌ H2SO3(亚硫酸) SO2+2NaOH=Na2SO3+H2O SO2+NaOH=NaHSO3 Na2SO3+SO2+H2O=2NaHSO3 SO2+Cl2+2H2O=2HCl+H2SO4 SO2+ Br2+2H2O = H2SO4+2HBr SO2+ I2+2H2O = H2SO4+2HI 2H2S+SO2=3S↓+2H2O SO2(少量)+2NH3·H2O=(NH4)2SO3+H2O SO2(足量)+NH3+H2O=NH4HSO3 三、三氧化硫 SO3+H2O=H2SO4 SO3+CaO=CaSO4 SO3+Ca(OH)2=CaSO4+H2O 四、浓硫酸 Cu+2H2SO4(浓) CuSO4+ SO2 ↑2O C + 2H2SO4(浓)CO2↑+2SO2↑2O 2Ag+2H2SO4Ag2SO4+SO22O S+2H2SO43SO 22O H2S+H2SO4(浓)=S↓+SO2↑+2H2O 或H2S+3H2SO44SO2↑+4H2O 2NaCl+H2SO4(浓)=Na2SO4+2HCl↑ 2HI+H2SO4(浓)=I2+SO2↑+2H2O 2HBr+H2SO4(浓)=Br2+SO2↑+2H2O FeS+H2SO4=FeSO4+H2S↑【实验室制H2S】 五、亚硫酸钠 2Na2SO3+O2=2Na2SO4 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O【实验室制SO2】 Na2SO3+H2O+Cl2=Na2SO4+2HCl 氮及其化合物 一、氮气 N2+O2 2NO N2+3H2
2NH3 3Mg+N2 Mg3N2 二、一氧化氮 2NO+O2=2NO2 4NO+3O2+2H2O=4HNO3 三、二氧化氮 3NO2+H2O=2HNO3+NO 2NO2+2KI=I2+2KNO2 4NO2+O2+2H2O=4HNO3 NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O 四、氨 NH3+H2O ⇌NH3·H2O ⇌NH4++OH- NH3·H2ONH3↑+H2O NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 4NH3+5O2 4NO+6H2O8NH3+3Cl2=N2+6NH4Cl 2 NH4Cl +Ca(OH)2CaCl2+2NH32O【实验室制NH3】 五、硝酸 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O C+4HNO3(浓) CO2↑+4NO2↑2O S+6HNO3H2SO4+6NO22O。 3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O 4HNO3 O2↑+ 4NO2↑+ 2H2O 六、铵盐 (NH4)2SO3+H2SO4(浓)=(NH4)2SO4+SO2↑+H2O 2NH4HSO3+H2SO4(浓)=(NH4)2SO4+2SO2↑+2H2O NH4Cl NH3↑+HCl↑ NH4HCO3 NH3↑+CO2↑+H2O(NH4)2CO3 2NH3↑+CO2↑+H2ONH4++OH- NH3↑+H2O 编辑整理by中学化学园~返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |