翻译组与转录组、蛋白质谱的关联分析 |
您所在的位置:网站首页 › 散点图相关系数r2 › 翻译组与转录组、蛋白质谱的关联分析 |
翻译组与转录组、蛋白质谱的关联分析
|
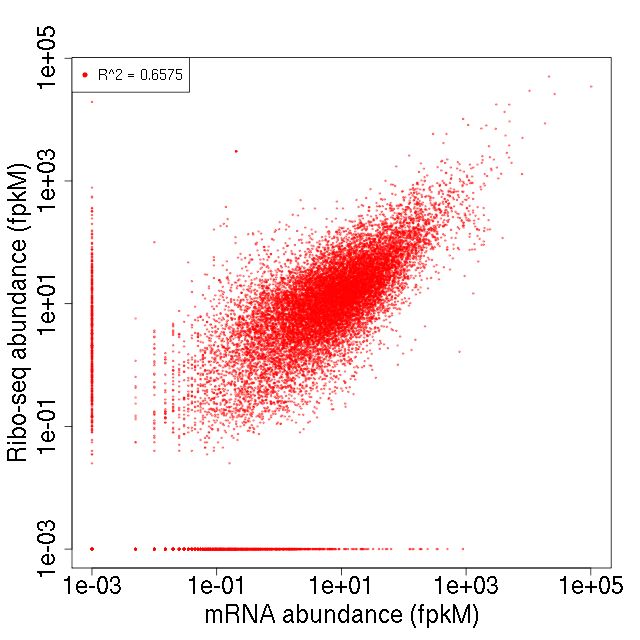
为什么呢?因为研究翻译组,大部分的目的就是研究样本中有多大比例的基因正在进行翻译合成蛋白,以及不同实验处理条件下基因的翻译变化。只有结合转录组,才能更深入地对转录后调控进行研究。 首先从下面的散点图我们可以直观地看到转录组和翻译组两个组学的相关性(皮尔森相关系数R2)。例如下图中R2=0.65,表明转录组与翻译组相关性比较强。我们平时做转录组与蛋白组的关联分析时,往往两个组学的相关性会非常低,这是因为中间有翻译调控的存在。那么用翻译组在中间搭个桥,可以使得两组学相关性提高,更精细地研究蛋白的翻译调控机制。
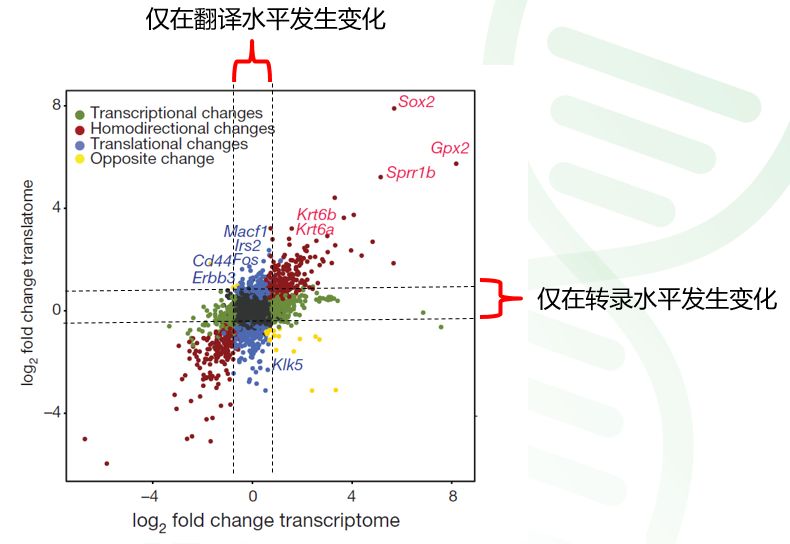
然后,我们可以通过下面这个九象限图来进行基因转录差异与翻译差异的比较。与转录组和蛋白组关联分析的经典九象限图类似,转录组与翻译组的九象限图也能非常清楚地展示具有不同表达差异的基因,可以帮助老师快速找到与预期变化一致的候选基因。 例如下面的这张九象限图,来自2017年的nature文章[1],横坐标是癌细胞与正常细胞比较组的基因在转录组水平上的表达量差异倍数log2值,纵坐标是基因在翻译组水平上的表达量差异倍数log2值,5类不同表达变化的基因分别用不同颜色的点显示。 从图中发现,有573个基因只在翻译组差异变化,包括了Cd44, Fos, Erbb3, Irs2等与肿瘤发生相关的基因。一些基因如Krt6, Gpx2, Sox2则在癌细胞中转录和翻译表达量都上调。
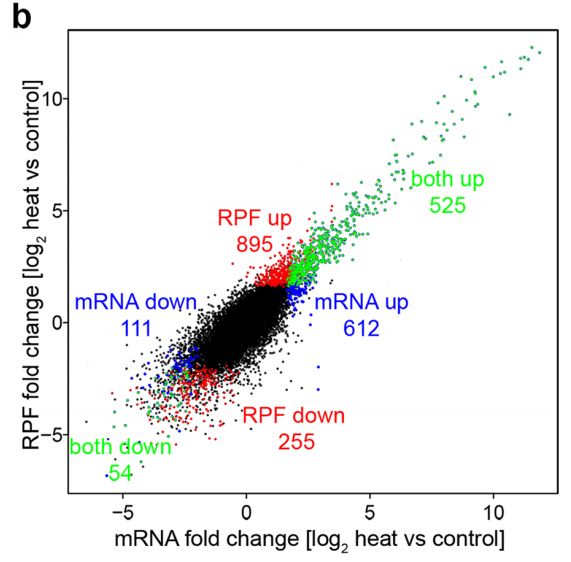
悄悄透露一下,很多文章都会做这个分析呢!例如这篇2016年发表在BMC Plant Biology上的文章[2],在九象限图上就标出来了仅在转录组水平或翻译组水平上调或下调的基因数目、以及在两个组学水平上同时上调和下调的基因数目,一目了然。
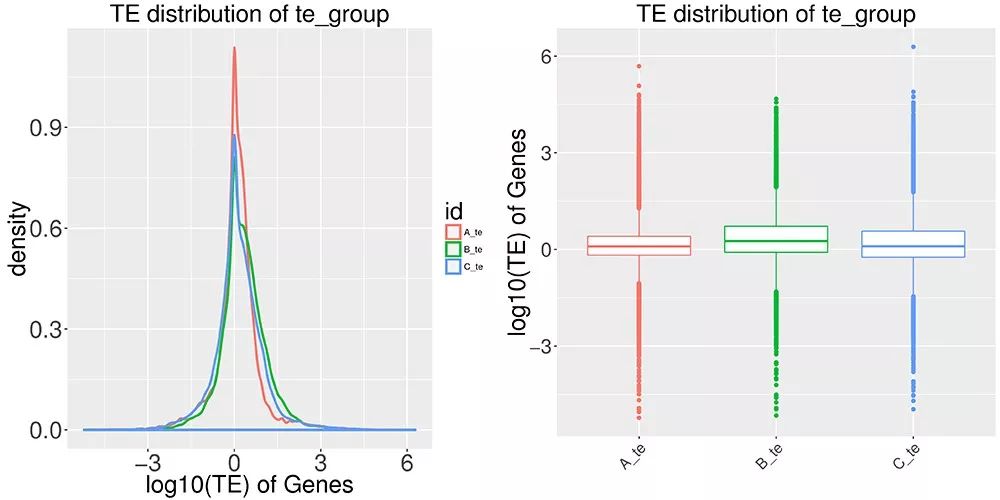
另外,有了基因的表达量数据,就可以进行“翻译效率”的计算,从而可以研究基因在不同处理条件下翻译的变化。 这里我们引入一个重要的概念——翻译效率(Translational Efficiency,TE)。翻译效率是指样本中某个基因的总RNA分子(通常指mRNA)与核糖体结合并进行翻译的比例。利用基因的Ribo-seq和RNA-seq的数据,就可以直接计算这个数值,具体计算公式为: TE =(FPKM in Ribo-seq) / (FPKM in RNA-seq) 是不是很简单呢?上期我们也提到过,ribo-seq的定量方法与RNA-seq类似,也是用FPKM/RPKM值。因此,翻译效率的计算公式就是用翻译的表达量除以转录的表达量。 那么,怎么利用翻译效率来研究讨论不同处理条件下基因的翻译调控差异呢?首先我们可以通过TE丰度分布密度图或盒型图来比较不同处理组的整体翻译效率水平:
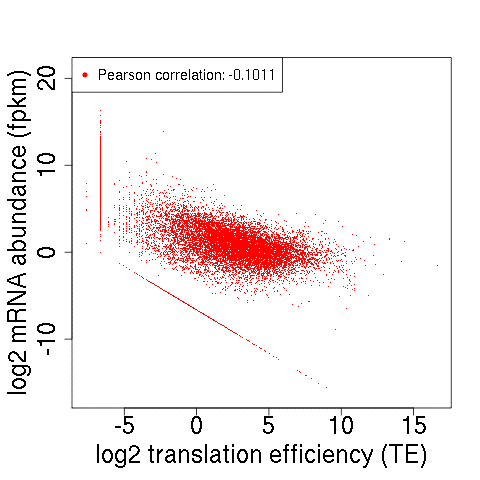
与上面所述的转录组与翻译组相关性散点图类似,也可以计算翻译效率与转录组的相关性,绘制散点图,来分析基因翻译效率与转录丰度之间的相关性高低。如下图所示,皮尔森相关系数为负,说明基因转录水平越高,翻译效率越低。
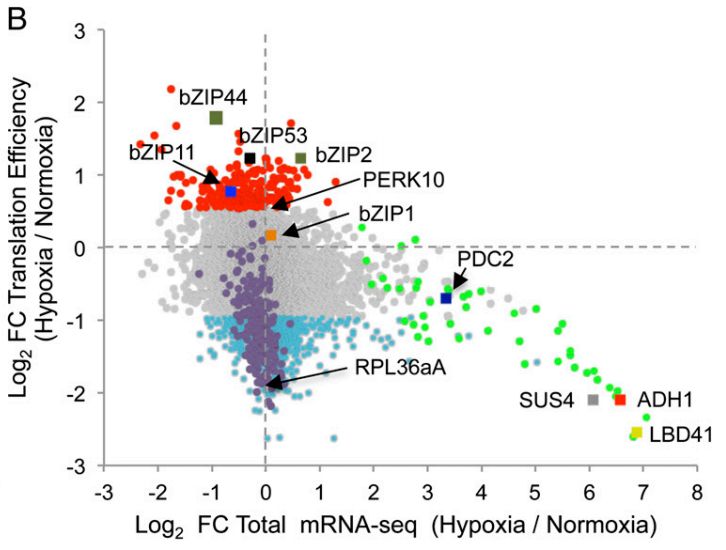
与基因表达量一样,我们也可以计算翻译效率显著差异的基因,简称差异翻译效率基因(DTEG)。 差异筛选的标准也是FDR1。然后就可以比较基因转录差异与TE差异的关系了。类似于基因转录差异与翻译差异的九象限图,基因转录差异与TE差异九象限图也将5类不同表达变化的基因分别用不同颜色的点显示,有助于快速找到与预期变化一致的候选基因。 如下面的九象限图来自2014年PNAS文章[3],展示了拟南芥在低氧胁迫下基因在转录水平和翻译效率上的差异变化,可以看出在低氧胁迫下高表达的基因,其翻译效率并没有显著变化,甚至是降低了。
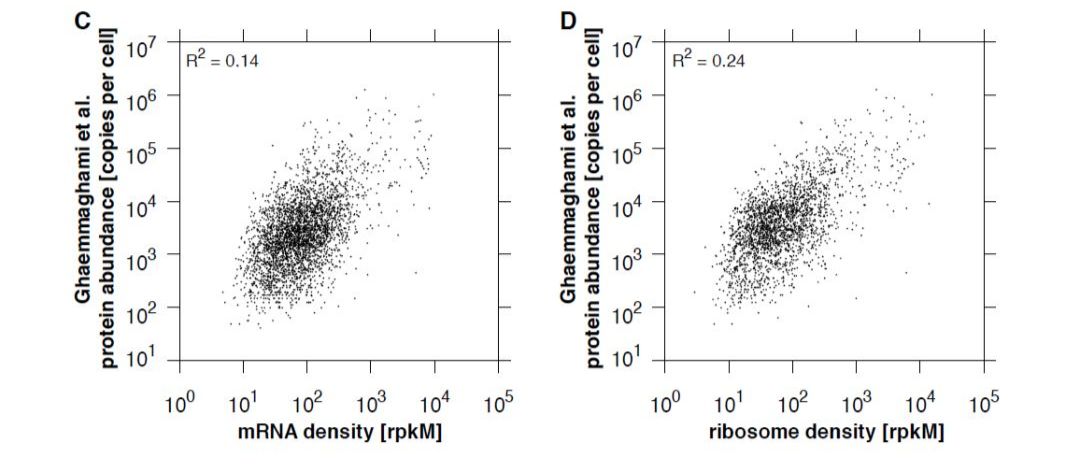
备注:翻译组文章中这个图也是标配~ 二 翻译组与蛋白组的关联分析 由于转录后调控、翻译调控以及其他因素如移码翻译等现象的普遍存在,转录组数据与蛋白组数据的相关性通常很差,因此很难准确分析基因转录与蛋白表达之间的关系。 而翻译组是连接转录组与蛋白质组的桥梁,是对正在翻译的基因进行精确定量,从而可以从基因组水平间接检测蛋白质的表达,因此翻译组数据与蛋白组之间往往有更强的相关性,如下图翻译组最早的文章2009年的Science文章[4]所示:
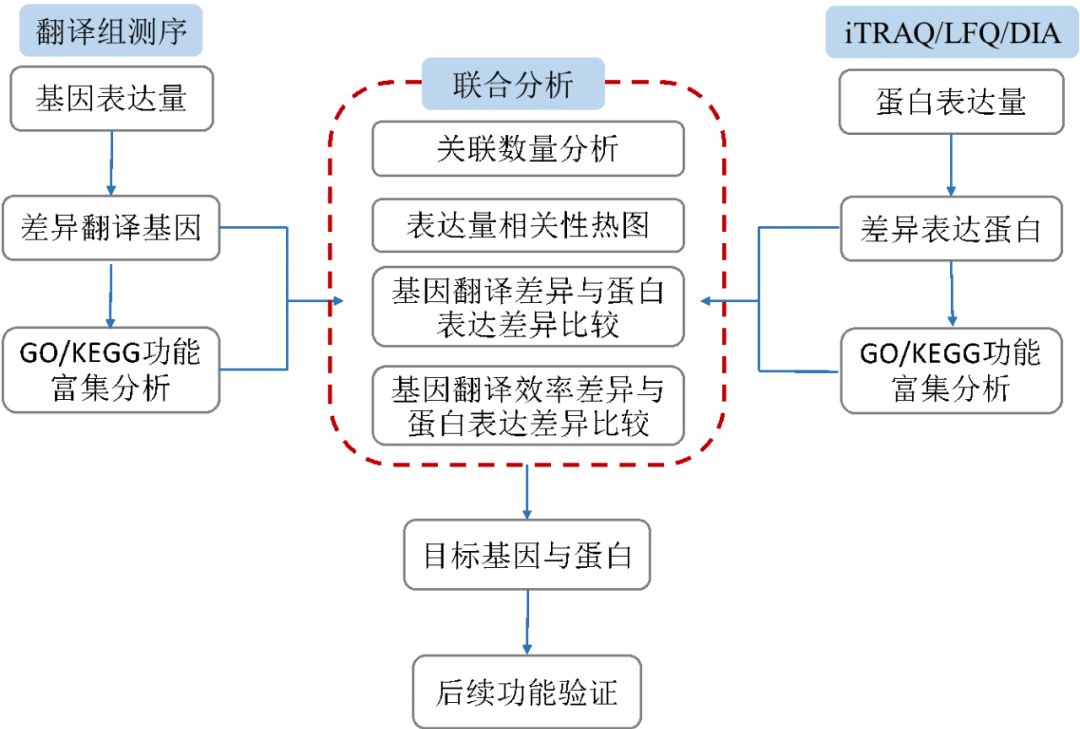
因此,将翻译组与蛋白组进行关联分析,可以更准确地研究蛋白的翻译调控。那么如何进行翻译组与蛋白组的关联分析呢?思路和翻译组与转录组关联分析一样,也是通过比较两个组学的表达量相关性、比较翻译效率差异与蛋白表达差异,来找出目标候选基因。
例如2014年CellReport文章[5]中,将基因在翻译效率的差异与蛋白水平上的差异绘制了散点图,并分类讨论。
右上图是翻译效率上调和蛋白表达量上调的基因维恩图,右下图是翻译效率下调和蛋白表达量下调的基因维恩图。约有40%表达上调的蛋白是由翻译效率显著上调的mRNA编码的(category I),总的来说,果蝇卵子活化过程中基因的翻译上调可增加相应蛋白的表达水平,但翻译以外的其他因素同样存在。 比如category II包含的基因翻译效率没有显著变化,但编码的蛋白表达量却显著上调,这可能是由于翻译后调控稳定了这些蛋白质,或增加了其半衰期,因此蛋白得以积累。而在翻译上调的mRNA中,只有25%其编码蛋白表达上调,大部分的mRNA编码的蛋白表达量没有显著变化(category III unchanged),或者表达下调(category III decreased)。 猜测可能是由于翻译的加速被蛋白的降解所平衡,或者新合成蛋白仅占已积累蛋白的一小部分,因此这些蛋白的翻译表达上调几乎检测不出来。Category V包含的蛋白表达量下降,其mRNA的翻译效率没有显著变化,说明这些蛋白的表达量主要受到翻译后调控影响,而不是翻译调控,这些蛋白表达量的下降主要是由于蛋白降解。 总结一下,翻译组与转录组、蛋白组关联分析,是最常见的实验设计与文章思路。翻译组与转录组关联,可比较基因转录与翻译的关系、计算翻译效率、比较翻译效率的差异。 翻译组与蛋白组关联,可研究瞬时翻译与蛋白积累的关系、蛋白的翻译调控与翻译后调控机制。当然,也有三组学一起关联分析的,那么文章的论证就更加严密、结果更加丰富了。 另外,miRNA、RNA甲基化(m6A)等的转录调控与表观修饰,也会对基因的翻译产生影响,联合这些组学与翻译组进行联合分析,可以更深入地研究基因的转录翻译调控,发表文章层次更高。具体可以查看我们之前解读过的一篇翻译组与m6A关联分析的文章(具体请查看“翻译组与m6A技术联合研究翻译调控”)。 Tips:对翻译组技术与转录组、蛋白质谱等分析感兴趣的老师和同学可留言咨询,基迪奥会为您量身定制专业的个性化实验分析方案。 参考文献 [1] Sendoel A , Dunn J G , Rodriguez E H ,et al. Translation from unconventional 5′ start sites drives tumourinitiation[J]. Nature, 2017, 541(7638):494-499. [2] Lukoszek R , Feist P , Ignatova Z .Insights into the adaptive response of Arabidopsis thaliana to prolongedthermal stress by ribosomal profiling and RNA-Seq[J]. Bmc Plant Biology, 2016,16(1):221. [3] Juntawong P , Girke T , Bazin J , etal. Translational dynamics revealed by genome-wide profiling of ribosomefootprints in Arabidopsis[J]. Proceedings of the National Academy of Sciences,2014, 111(1):E203-E212. [4] Ingolia N T , Ghaemmaghami S , NewmanJ R S , et al. Genome-Wide Analysis in Vivo of Translation with NucleotideResolution Using Ribosome Profiling[J]. Science, 2009, 324(5924):218-223. [5] Kronja I , Yuan B , Eichhorn S , etal. Widespread Changes in the Posttranional Landscape at the DrosophilaOocyte-to-Embryo Transition[J]. Cell Reports, 2014, 7(5):1495-1508.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |