肿瘤微生物:瘤内微生物是如何促进胰腺癌发生? |
您所在的位置:网站首页 › 怎样抓取小鼠细菌视频 › 肿瘤微生物:瘤内微生物是如何促进胰腺癌发生? |
肿瘤微生物:瘤内微生物是如何促进胰腺癌发生?
|
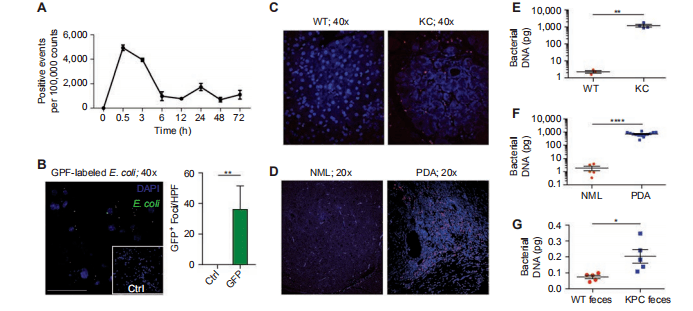
01 如何确定肠内细菌是否进入胰腺? 通过口服给药给野生型(WT)小鼠荧光标记的粪肠球菌发现,细菌迁移到胰腺,表明肠道细菌可以直接影响胰腺微环境(图1A)*1 ,GFP标记的大肠杆菌观察到类似的结果(图B)。FISH表示无论是在老鼠还是人类中,PDA样本中细菌含量明显远大于正常胰腺组织(图C和D),qPCR分析也证实了相同结论(图E和F)。用抗生素处理过的野生型小鼠实验表明, Pdx1 Cre 、LSL-Kras G12D 、Trp53 R172H (KPC) *2 小鼠的肠道微生物组与野生型小鼠相比,具有更高的向胰腺转移的能力(图G)。
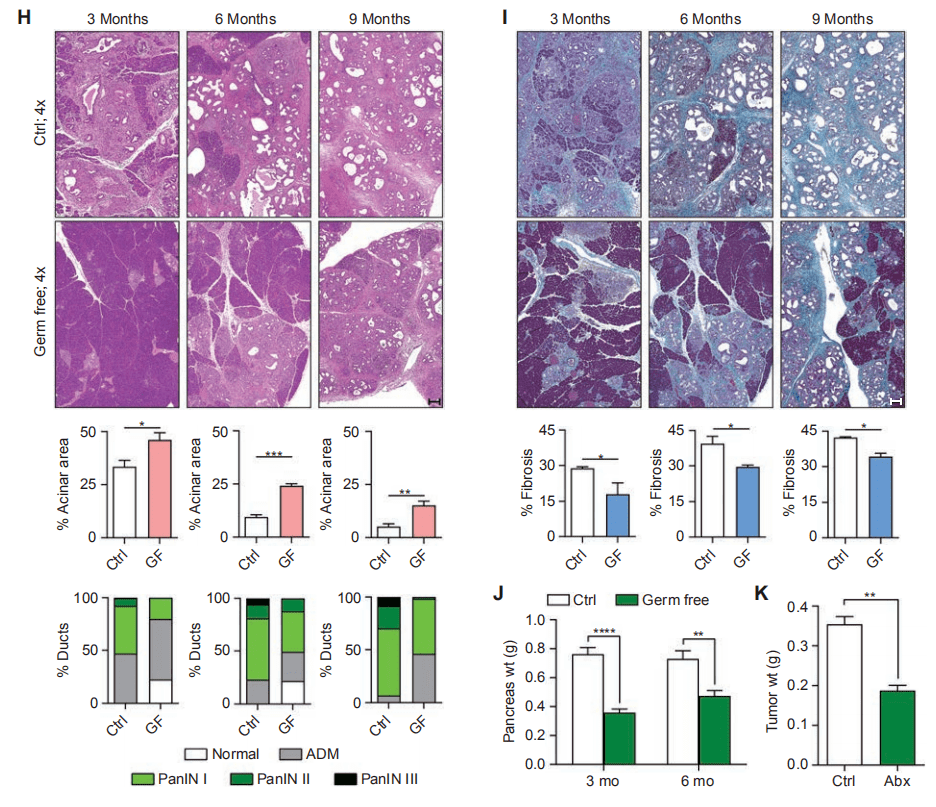
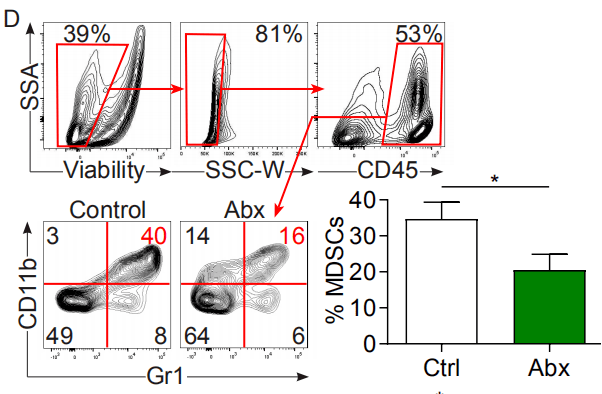
*1:图1A除了指示肠道细菌可以迁移到胰腺,还提示了各位研究者,口服菌0.5h左右就能到达组织,6h后基本就所剩无几。如果后期研究者们要做灌胃实验,要把握好取样时间哦。 *2:KPC( LSL-Kras G12D /+;LSL-Trp53 R172H /+; Pdx-1-Cre) Kras G12D 是人类肿瘤中常见的 Kras 基因的活化突变体,Trp53 R172H 则是 P53 基因的突变体。KPC小鼠是胰腺癌这一癌症之王的研究提供了绝好的研究工具。 02 细菌是否促进胰腺异常增生的进展? 无菌KC小鼠对疾病进展和基质扩张有保护作用。与年龄相仿的对比组KC老鼠相比,无菌组显示腺泡消退延迟,胰腺异常增生减少,瘤内纤维化减少,胰腺重量降低(图H-J)。同样,在入侵原位PDA模型使用KPC驱动的肿瘤细胞,经口服消蚀抗生素治疗的WT小鼠的肿瘤负荷减少了50%(图K)。
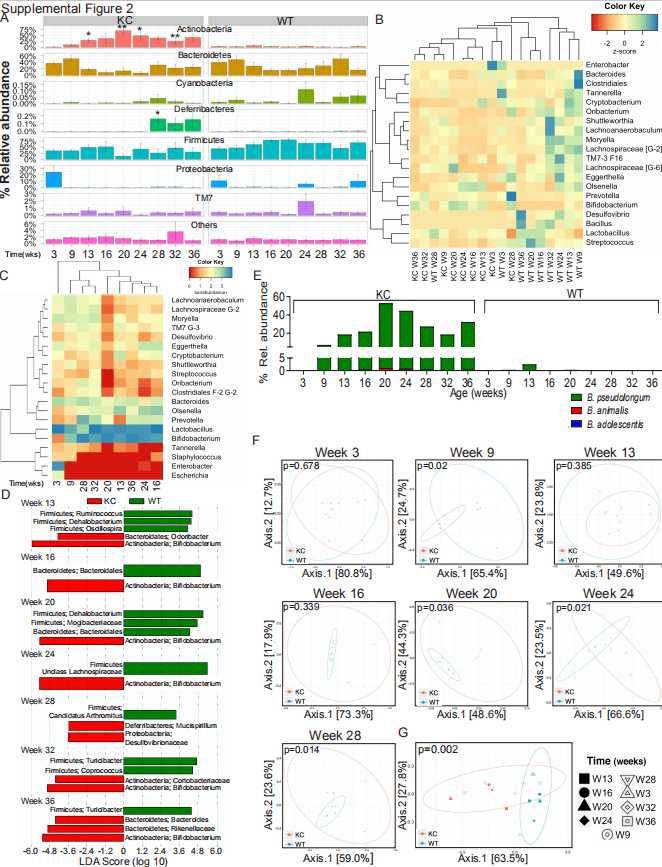
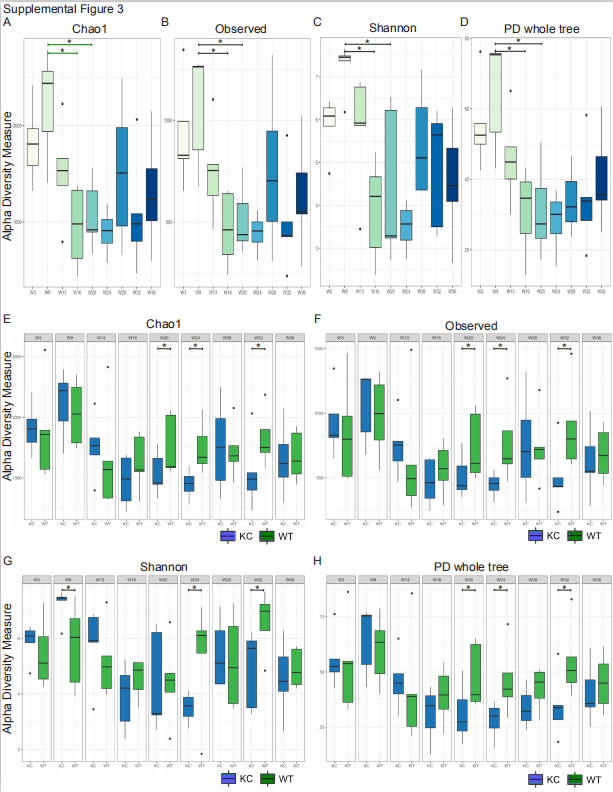
03 有哪些与胰腺发育进展相关的微生物? 在小鼠生命早期,KC组和WT组的肠道细菌群落结构相似。 拟杆菌门( Bacteroidetes )和厚壁菌门( Firmicutes )是优势门,但在队列间未观察到显著差异。然而,尽管放线菌在年轻的WT和KC小鼠中含量较低,但在第20周KC组中含量增加到60%。相反,放线菌在WT组中没有扩张。除铁菌在KC小鼠中也在28至36周突然增加(S2A)。在属水平上,第13周后KC的肠道微生物组与WT单独成簇(S2B)。对KC小鼠肠道微生物群落的纵向比较表明,在随后的时间点双歧杆菌富集(S2C)。线性判别分析(LDA)同样显示,与WT相比,在第13至36周,双歧杆菌在KC队列中逐渐富集(S2D)。我们发现在KC小鼠中,pseudolongum双歧杆菌是数量最多的双歧杆菌(S2E)。使用加权UniFrac距离度量计算的主坐标分析(PCoA)证实了WT和KC队列在选定时间点的肠道微生物群落存在显著差异(S2F和S2G)。Alpha多样性分析进一步表明,进展性肿瘤发生的KC队列在基于分类的丰富度(Chao1)、可观察分类单元(OTU)、Shannon多样性指数和基于系统发育的多样性(PD)方面存在显著差异(S3A,S3D)。肠道微生物群落的Alpha多样性在WT和KC队列中也不同(S3E,S3H)。
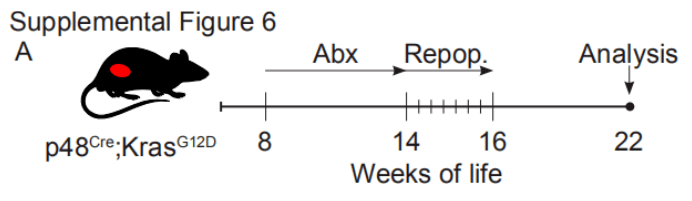
04 致病菌是否会促进遗传易感宿主的胰腺癌发生? 用口服抗生素对KC小鼠的肠道细菌进行了消除,然后在22周死亡前使用WT小鼠或KPC小鼠的粪便选择性地重新填充队列。
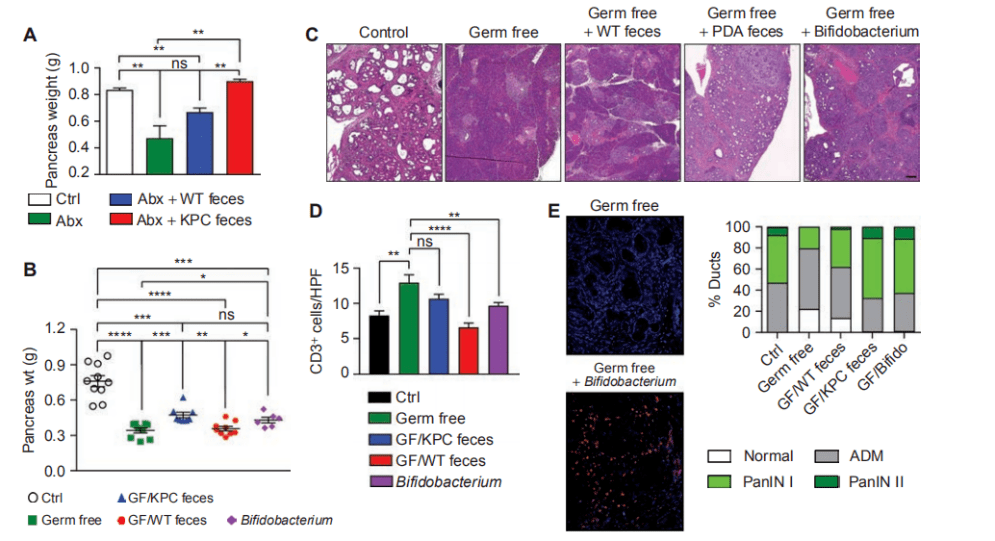
与之前的结果一致,细菌消融对疾病进展有保护作用。此外,使用KPC来源的粪便再种群加速肿瘤生长至基线水平,而使用年龄匹配的WT小鼠粪便再种群未能显著加速肿瘤发生(图2A)。同样,在无菌KC模型中,使用携带PDA的KPC小鼠(而不是野生型小鼠)粪便的再种群,加速了疾病进展,并减轻了无菌条件下T细胞浸润(S6B;图2B-D),使用B.pseudolongum同样加速了肿瘤的发生。FISH证实了使用B.pseudolongum肠道细菌向胰腺移位(图2E)。
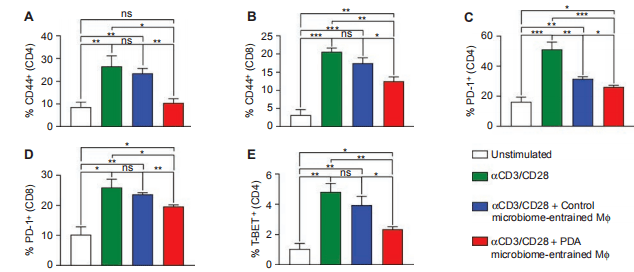
05 微生物携带的巨噬细胞是否介导了PDA中的T细胞抑制? 我们使用CD3/CD28或来自WT小鼠或KC小鼠肠道细菌的无细胞提取物处理的脾巨噬细胞来刺激CD4+和CD8+T细胞。携带PDA宿主的肠道细菌提取物携带的巨噬细胞抑制了CD4+和CD8+T细胞的激活,通过降低CD44和PD-1的表达,并通过T-bet的表达来阻止CD4+T细胞的TH1分化(图3A,E)。
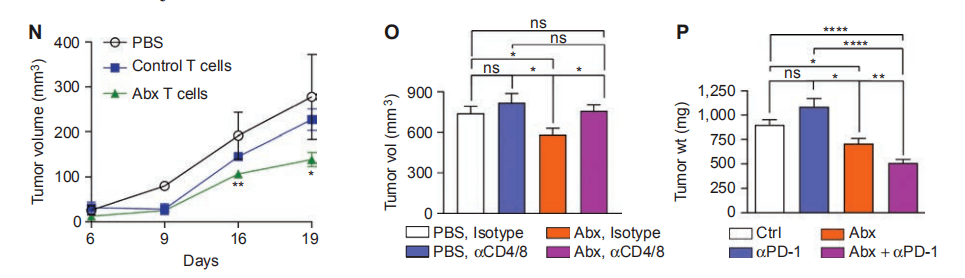
06 有哪些与微生物消融相关的肿瘤保护增强适应性免疫? 我们从对照或抗生素治疗的小鼠原位KPC肿瘤中获取T细胞,并将T细胞过从皮下KPC肿瘤小鼠群中转移。对照组小鼠转移PDA浸润T细胞未能起到保护作用;然而,来自抗生素治疗小鼠的肿瘤浸润T细胞可将肿瘤负荷降低50%。
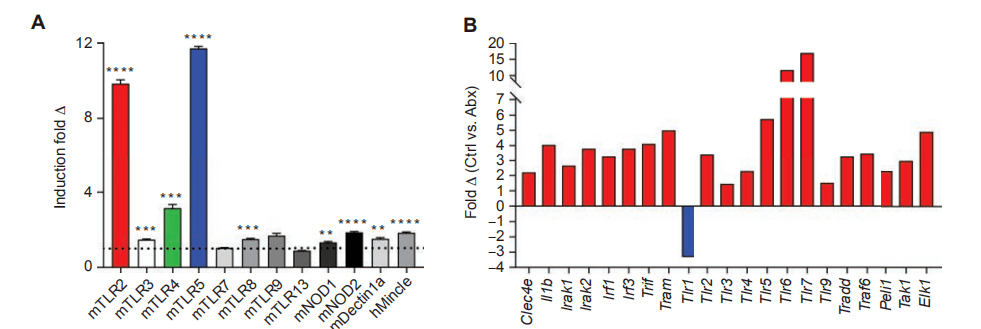
我们之前曾报道过多种PRRs,包括TLR3、TLR4、TLR7、TLR9、NLRP3、Dectin-1和Mincle,在PDA中上调,它们的激活通过诱导先天和适应性免疫抑制加速肿瘤发生。我们推测,PDA微生物促进的免疫耐受是肿瘤微环境中更高的PRR激活的结果。与假设一致,我们发现来自KC小鼠肠道细菌的无细胞提取液比来自WT小鼠的肠道细菌提取液更能诱导多种PRR报告细胞系的激活,最显著的是TLR2、TLR4和TLR5(图4A)。
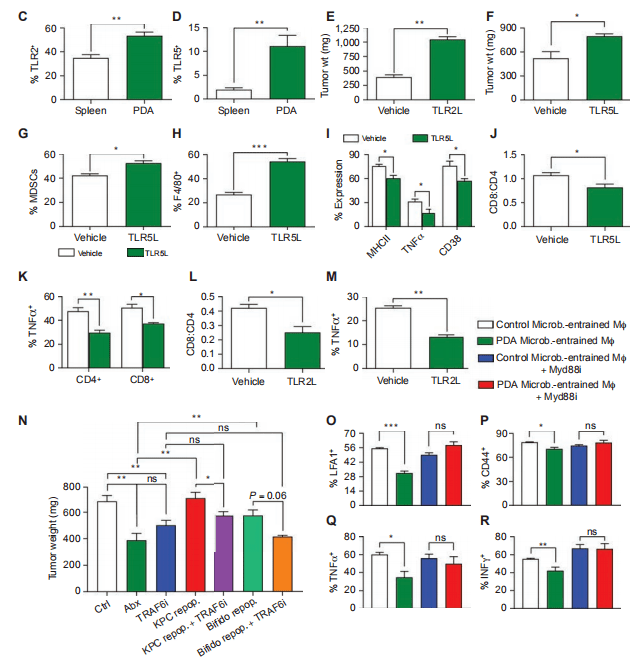
与对照小鼠的PDA肿瘤相比,经抗生素切除宿主的PDA肿瘤中PRRs及其相关信号分子的表达显著降低(图4B)。我们确认,类似于我们以前研究的PRRs,表达TLR2和TLR5调节巨噬细胞在PDA通过流式细胞术(图4C和D),和他们的结扎加速肿瘤的生长(图4E号通路,可以消除KPC粪便或KPC粪便重建抗生素消融小鼠的PDA促进作用(图4N)。在TLR信号被抑制的情况下,PDA微生物组携带的巨噬细胞未能抑制T细胞免疫原性,这表明PDA微生物组通过TLR信号引导TAMs诱导免疫耐受(图4O,R)。
结论 我们的研究阐明了一种与小鼠进行性胰腺肿瘤发生相关的独特肠道微生物组的存在。我们发现,胰腺拥有自己的微生物群,这与老鼠和人类的疾病阶段有关。我们还详细介绍了由微生物组诱导的胰腺内免疫编程。调节PDA微生物群以增强免疫治疗是实验性治疗的一个有吸引力的途径。此外,有必要进行前瞻性研究来鉴别具有肿瘤特异性的微生物特征,这可能具有早期诊断和风险分层的潜力。 编者说 众所周知,原核生物研究进展相比真核生物还是有相当一段差距,要想缩小这个差距,大量的测序来充实数据库是第一步,没有足够的数据支撑,前期得到的微生物类型的种类都不完善,何谈后期的精准的湿实验?按照目前形势来看,如果说肠道微生物的研究是一片待开采的金矿,组织微环境就更可谓是一片钻石矿,目前借助二代测序,研究门槛大大降低,加上常规的免疫组化,粪菌移植等实验,还怕没有大的发现? 对“ 肿瘤组织微生物组”研究感兴趣的老师们,欢迎咨询与讨论。 参考文献 Pushalkar Smruti,Hundeyin Mautin,Daley Donnele et al. The Pancreatic Cancer Microbiome Promotes Oncogenesis by Induction of Innate and Adaptive Immune Suppression.[J] .Cancer Discov, 2018, 8: 403-416返回搜狐,查看更多 |
【本文地址】