邱萌教授:微卫星稳定型(MSS)肠癌免疫治疗进展 |
您所在的位置:网站首页 › 必是什么意思文言文 › 邱萌教授:微卫星稳定型(MSS)肠癌免疫治疗进展 |
邱萌教授:微卫星稳定型(MSS)肠癌免疫治疗进展
|
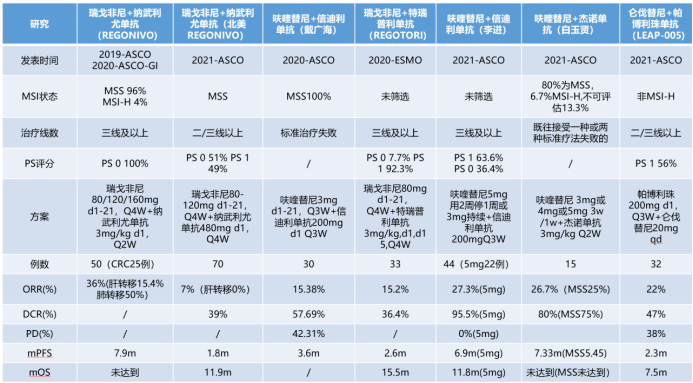
日本 REGONIVO 研究是第一个采用纳武利尤单抗联合瑞戈非尼治疗难治性 MSS 型肠癌和胃癌的探索性Ⅰb 期研究,,在 MSS 型 mCRC 中 ORR 达 33.3%,1 年 PFS 率为 41.8%,1 年 OS 率为 68.0%。然而后续北美 REGNIVO II 期研究中未能重复出日本研究,ORR 为 7%,PFS 1.8 月,OS 11.9 月。总体来看,目前免疫联合抗血管生成 TKI 作为 mCRC 三线治疗的 ORR 约为 7~33%,DCR 39%~80%,OS 7.5~15.5 月,交叉与既往三线治疗 TKI 研究比较疗效还是有一定程度的提高,我们更期待有前瞻性对照研究的高级别证据足以来支持这种联合策略最终进入临床指南。 在北美 REGNIVO 及中肿 REGOTORI 等多个研究中基于转移器官的亚组分析发现,伴肝转移的患者疗效明显差于非肝转移者,REGOTORI 研究还发现肠道菌群可能影响 MSS 型肠癌的免疫治疗疗效。
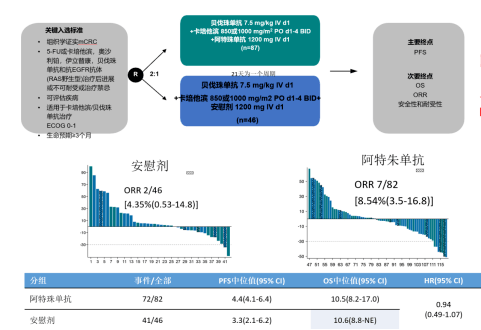
研究数量虽少,但均为 RCT 研究。2019 年 ESMO 报道的 At533PD 研究旨在评估卡培他滨和贝伐珠单抗联合阿特珠单抗或安慰剂作为三线治疗难治性晚期 CRC 患者的疗效,结果显示,阿特珠单抗组与安慰剂组的 ORR 分别为 8.54%、4.35%,中位 PFS 分别为 4.4、3.3 个月,中位 OS 分别为 10.5、10.6 个月。
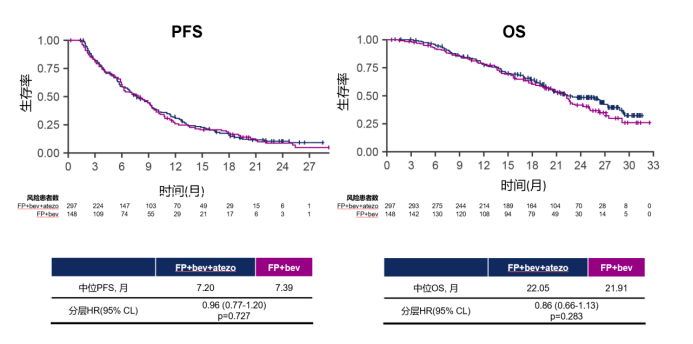
而 III 期 RCT 的 MODUL 研究是针对一线治疗后稳定的患者采用 5-FU+贝伐珠单抗或联合阿特珠单抗作为维持治疗,结果增加免疫治疗并不改善 PFS 及 OS。
2 免疫联合抗 EGFR 治疗 既往有研究表明西妥昔单抗本身有直接杀伤肿瘤作用,作为 IgG1 单克隆抗体还具有 ADCC 免疫效应,可招募 anti-EGFR T 细胞及 CD8+/CD3+T 细胞,而另一方面西妥昔单抗也可增加肿瘤细胞的 PD-L1 表达,诱导免疫抑制,因此与 PD-1 单抗可能存在协同作用。 一线治疗:初尝尚浅AVETUX 研究是一项单臂、多中心、Ⅱ期研究,旨在探索阿维鲁单抗+西妥昔单抗+化疗(FOLFOX)用于先前未接受过治疗的 RAS/BRAF 野生型 mCRC 患者的疗效与安全性。结果显示,1 年 PFS 率为 40%,中位 PFS 为 11.1 个月,早期缩瘤率(ETS)为 81%。参与安全性评估的 38 例患者中,23 例发生 52 起严重不良反应(SAEs)(61%),平均每名患者发生 SAEs 1.37 次。
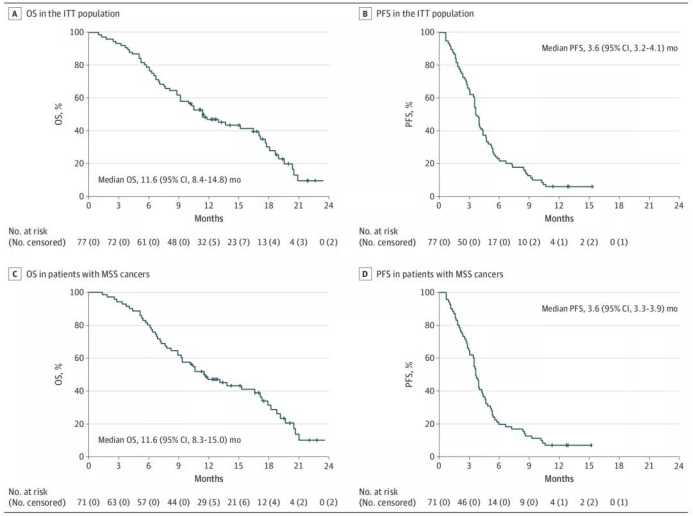
CAVE 研究是一项单臂、多中心的Ⅱ期研究,旨在评估后线应用西妥昔单抗联合阿维鲁单抗在先前接受过至少两线标准治疗失败的 RAS 野生型 mCRC 患者中的疗效。今年 ASCO 中更新的中位 OS 为 11.6 个月,中位 PFS 为 3.6 个月,ORR 为 6%,DCR 为 65%。在 71 例 MSS 患者中,中位 OS 为 11.6 个月,中位 PFS 3.6 个月,ORR 为 8.5%。
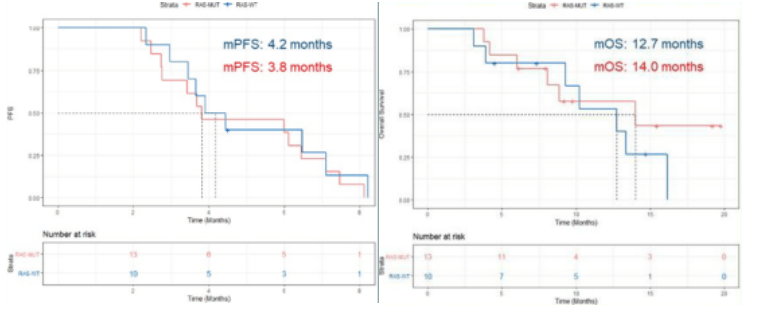
此外,AVETUXIRI 研究也采取了相同策略,对于既往标准治疗失败的难治性 MSS mCRC 患者采用阿维鲁单抗联合西妥昔单抗和伊立替康治疗。该研究按 RAS 突变状态分为队列 A(RAS WT)和队列 B (RAS MUT),且患者 BRAF V600E WT 及 MSS。初期研究结果显示 RAS WT 组 ORR 为 30%,达到预先设定的阈值,继续进行第二阶段研究;RAS MUT 组中没有观察到 PR,但 RAS WT 和 RAS MUT 两组的 DCR 分别为 60% 和 61.5%,PFS 分别为 4.2 个月和 3.8 个月,OS 分别为 12.7 个月和 14.0 个月。6 个月 PFS 率分别为 40.0% 和 38.5%。
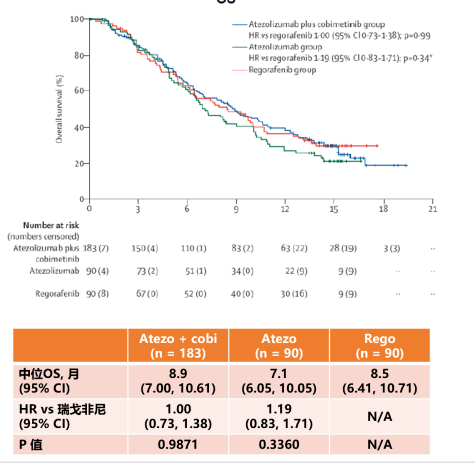
3 免疫联合 MEK 抑制剂治疗:前景不佳 IMblaze370 是一项多中心、开放标签的随机对照临床试验,探索了 PD-L1 抑制剂联合 MEK 抑制剂方案(阿替利珠单抗联合考比替尼)与瑞戈非尼标准三线治疗的效果。Ⅰb 期结果显示阿替利珠单抗联合考比替尼有一定的有效率(8%)和疾病控制率(31%);2018 年 ASCO-GI 上公布的后续结果显示,6 个月的 OS 率为 71%,12 个月的 OS 率为 50%;但是 2019 年公布的结果显示,阿替利珠单抗联合考比替尼中位 OS 为 8.87 个月,阿替利珠单抗单药组为 7.10 个月,瑞戈非尼组为 8.51 个月,各治疗组 OS 没有显著差异,而且会增加不良反应。
4 BRAF V600E 突变 mCRC:靶向联合免疫 MSI-H CRC 中有约 1/4~1/3 伴有 BRAFv600E 突变, 此类患者适合直接选择免疫治疗,BRAF 突变的 MSS 型肠癌的标准二线及后线治疗为 BARF 抑制剂联合抗 EGFR 单抗及 MEK 抑制剂,能否也从免疫治疗中获益尚不清楚。2020 年 ESMO 报道了一项丹娜法伯中心开展的研究,针对 BRAF V600E 突变 mCRC 患者采用BRAF 抑制剂(达拉菲尼)+MEK 抑制剂(曲美替尼)+PD-1 单抗(PDR001)治疗。结果显示 21 例患者的 ORR 为 35%,DCR 为 75%;其中 12 例未接受过 BRAF 治疗的 MSS 患者的 ORR 达 45%,显示了双靶联合免疫治疗非常有前景。 5 免疫联合一线化疗 KEYNOTE-651 研究是一项多中心、开放标签、非随机 Ib 期研究,旨在评估帕博利珠单抗联合 mFOLFOX7 或 FOLFIRI 治疗 mCRC 的疗效与毒性,主要研究终点为安全性、耐受性,次要终点为 ORR。结果显示,队列 B(帕博利珠单抗联合 mFOLFOX7)组 ORR 为 58%,队列 D(帕博利珠单抗联合 FOLFIRI)组 ORR 为 16%。 METIMMOX 研究假设以奥沙利铂为基础的短程治疗 (FLOX) 可使 MSS mCRC 转化为具免疫原性状态,从而使不可切除的、既往未经治疗的转移性患者在加入免疫检查点抑制剂(ICB)后获得持久的疾病控制。该研究采用重复序贯奥沙利铂为基础的化疗(FLOX) 联合纳武利尤单抗治疗对比 FLOX 方案一线治疗 MSS mCRC。结果显示,FLOX 联合纳武利尤单抗组与 FLOX 化疗组的 mPFS 分别为 6.6 个月、5.6 个月。
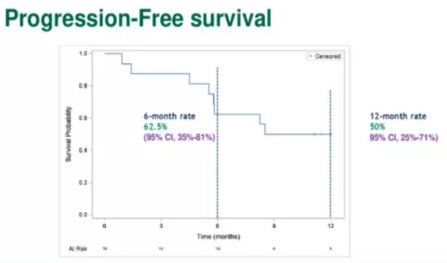
MEDETREME 试验是一项单臂探索性试验,纳入 57 名 RAS 突变、微卫星稳定 MSS、未经治疗的 mCRC 患者,接受 FOLFOX 联合度伐利尤单抗和 Tremelimumab 一线治疗。结果显示,6 个月 PFS 率为 62.5%,1 年 PFS 率为 50%;DCR 为 87.5%,ORR 为 62.5%,CR 为 25%。
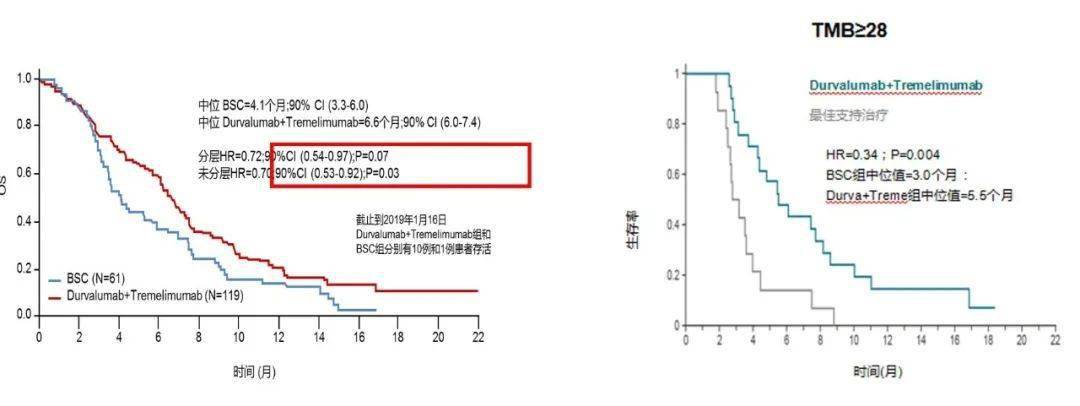
个人观点,以上研究结果与既往一线或二线化疗联合靶向药物研究疗效比较,似未看到明显优势,未来可能更多的探索在于化疗联合靶向、免疫的三联疗法,比如浙江大学第二附属医院袁瑛教授团队正在开展 XELOX+贝伐联合免疫治疗的 III 期 RCT 研究。 6 双免疫检查点抑制剂联合 CCTG CO.26 研究则对双免联合方案作为 mCRC 后线治疗进行了评估,试验组采取度伐利尤单抗+Tremelimumab 双免疫治疗,与最佳支持治疗组对照。结果显示,双免疫组 OS 显著延长(6.6m vs 4.1m),但 PFS 未见延长,有效率仅 1%。后续分析显示,该研究中中位 TMB 高达 20.4mt/Mb,肿瘤突变负荷>28mts/Mb 的患者更获益。
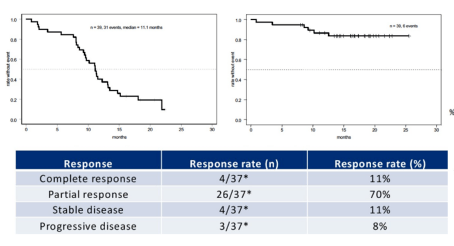
7 免疫治疗在 MSS 局晚期肠癌围手术期的探索 局晚期结肠癌的免疫新辅助治疗NICHE 研究:术前双免疫治疗 pMMR 型病理缓解率达 27% NICHE 研究探索 6 周免疫治疗(纳武利尤单抗联合低剂量伊匹木单抗)在 I~III 期结肠癌作为新辅助治疗的疗效。研究共入组 40 例患者,其中 dMMR 21 例,pMMR 19 例,经影像学评估,81% 的 dMMR 肿瘤患者和 40% 的 pMMR 肿瘤患者均为 III 期。患者在治疗结束 6 周内接受手术,主要研究目标是安全性和可行性。 结果显示,安全性可接受,dMMR 肿瘤患者 100% 获得病理缓解,60% 达完全病理缓解 (pCR)。在 15 例可评估病理的 pMMR 患者中, 4 例 (27%) 表现出病理反应,其中 3 例达 MPR(重大病理缓解,残留肿瘤 70% 患者观察到明显降期,与对照队列相比,NICOLE 队列肿瘤的 CD8 和 CD8 非抑制 T 细胞水平显著更高。 局晚期直肠癌的免疫新辅助治疗VOLTAGE 研究:术前放化疗后纳武利尤单抗单药治疗 VOLTAGE-A 研究是首个探索放化疗序贯免疫治疗在 MSS 直肠癌新辅助治疗中价值的研究。该研究纳入局部进展期直肠癌患者接受新辅助放化疗 (放疗 50.4 Gy,同期口服卡培他滨 1650 mg/m2),放化疗结束后经影像学评估无远处转移的患者,14 天之内开始纳武利尤单抗治疗,3 周期后如果确认无疾病进展则继续用药 2 周期。末次治疗结束后 14 天内进行根治性切除和术后辅助化疗。 VOLTAGE-A 研究分为 2 个队列,A1 为 37 例 MSS 患者和 A2 为 5 例 MSI-H 患者。研究的主要终点为 pCR 率,次要终点为 ORR、纳武单抗用药及手术的安全性、试验方案完成率、根治性切除率。 结果显示,队列 A1 的 37 例中 11 例达到了 pCR(30%);另外还有 3 例为肿瘤退缩分级 1 级 (TRG1 级),即 14 例 (38%) 取得了重大病理缓解 (TRG0-1);另有 1 例患者达到 cCR,进行等待观察,未行手术。队列 A2 的 5 例中,3 例达到了 pCR(60%)。 AVANA 研究:术前放化疗联合阿维鲁单抗 AVANA 研究是一项多中心 II 期研究,探索术前放化疗联合阿维鲁单抗治疗局部进展期直肠癌(LARC)的疗效。结果显示,在 96 例可评估病理反应的患者中,22 例 (23%) 患者达到了 pCR,59 例 (61.5%) 患者达到了主要病理反应。。 同济大学协和医院张涛教授研究:短程 5x5 放疗序贯 CAPOX 联合卡瑞利珠单抗 2 周期新辅助治疗的 II 期研究,主要终点为 pCR 率,入组 29 例,初步报道了的 10 例手术患者病理缓解情况非常亮眼,pCR 达 60%,MSS 型 9 例,5 例 pCR。非常期待最终全组人群数据的报道。 8 MSS 晚期肠癌免疫治疗疗效相关生物标记物探索 肿瘤 PD-L1 表达: 在肠癌中阳性表达与免疫治疗疗效无相关性。 POLE/POLD 基因突变:为 DNA 损伤修复相关基因,在肠癌的发生率为 7% 左右,晚期中约为 1-3%,携 POLE/POLD 基因突变肠癌基本为 MSS 型,具有高肿瘤突变负荷的特征。中肿王峰教授等研究显示 POLE 突变/MSS 型肠癌对免疫治疗有效。美国一研究进一步显示具有 POLE 基因致病突变者才对免疫治疗有效。 肿瘤突变负荷(TMB):潜在有意义的生物标志物,CCTG CO.26 研究后续分析显示 TMB 与双免治疗疗效相关,TMB>28mts/Mb 的患者更获益;而 TAPUR 研究显示帕博利珠单抗治疗 TMB>9mts/Mb MSS mCRC ,ORR 11%,1 年生存率 45%。不同研究基于不同检测平台和 panel,如何确定最佳 cut-off 值是难题。 ✩ 本文仅供医疗卫生等专业人士参考 参考文献: [1] Shota F, Hiroki H, Naoki T, et al. Regorafenib plus nivolumab in patients with advanced gastric (GC) or colorectal cancer (CRC): An open-label, dose-finding, and dose-expansion phase 1b trial (REGONIVO, EPOC1603)[R]. ASCO 2019, abstract 2522. [2] Eng C, Kim T W, Bendell J, et al. Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer (IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial[J]. Lancet Oncol, 2019,20(6):e293. [3] Eric X Chen, Derek J J, Hagen F K, et al. CCTG CO.26 trial: A phase II randomized study of durvalumab (D) plus tremelimumab (T) and best supportive care (BSC) versus BSC alone in patients (pts) with advanced refractory colorectal carcinoma (rCRC)[R]. ASCO GI 2019, abstract 481. [4] Chalabi M, Fanchi LF, Dijkstra KK, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers[J]. Nat Med, 2020, 26(4): 566-576. DOI:10.1038/s41591-020-0805-8. [5] Eng C, Kim TW, Bendell J, et al. Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer (IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2019. 20(6): 849-861. [6] Grothey A TJ, Arnold D, et al. Fluoropyrimidine (FP) + bevacizumab (BEV) + atezolizumab vs FP/BEV in BRAFwt metastatic colorectal cancer (mCRC): Findings from Cohort 2 of MODUL – a multicentre, randomized trial of biomarker-driven maintenance treatment following first-line induction therapy. EMSO 2018, Abstract LBA19. [7] Martinelli E, Martini G, Famiglietti V, et al. Cetuximab Rechallenge Plus Avelumab in Pretreated Patients With RAS Wild-type Metastatic Colorectal Cancer: The Phase 2 Single-Arm Clinical CAVE Trial. JAMA Oncol. 2021 Aug 12. doi: 10.1001/jamaoncol.2021.2915. Epub ahead of print. PMID: 34382998. [8] Marc Van Den Eynde, et al. Interim analysis of the AVETUXIRI Trial: Avelumab combined with cetuximab and irinotecan for treatment of refractory microsatellite stable (MSS) metastatic colorectal cancer (mCRC)—A proof of concept, open-label, nonrandomized phase IIa study. 2021 ASCO-GI. Abstract 80. [9] Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer (IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol.2019. [10] LisaSalvatore, Oncologia Medica,Comprehensive Cancer Center, Fondazione PoliclinicoUniversitario Agostino Gemelli–IRCCS, Universita Cattolica del Sacro Cuore,Rome, Italy. [11] Diana Miao, Claire A. Margolis, Natalie I. Vokes, et al. Genomic correlates of response to immune checkpoint blockade in microsatellite-stable solid tumors. Nature Genetics 50, 1271–1281 (2018).返回搜狐,查看更多 |
【本文地址】