【标准·方案·指南】儿童血液系统疾病二代测序技术临床应用中国专家共识(2022) |
您所在的位置:网站首页 › 幼儿基因疾病 › 【标准·方案·指南】儿童血液系统疾病二代测序技术临床应用中国专家共识(2022) |
【标准·方案·指南】儿童血液系统疾病二代测序技术临床应用中国专家共识(2022)
|
三、儿童血液系统疾病NGS检测临床送检流程 1.病史采集:需详细客观地询问并记录患儿基本信息、病史、家族史(必要时绘制家系图)以及母亲孕产史等情况。同时需要对患儿进行全面体格检查,由于先天性骨髓衰竭等疾病易合并其他系统发育异常,尤其应注意患儿生长发育及畸形情况,必要时完善影像学检查,并注意保存有临床意义的畸形部位的照片。 2.明确送检指征:根据详细病史及病例特点明确送检指征,进而合理选择送检项目。 3.送检前谈话:送检前应同患儿家长进行谈话并签署知情同意书。向患儿家长交代送检目的、费用、报告周期、预期结果及意义等,并解释检测项目的局限性。 4.申请单填写:除常规信息外,尤其需注意提供详细的患儿疾病表型信息,应按照中文人类表型标准术语进行表述,同时提供临床诊断信息。送检家系标本时应分别描述每个标本对应的个体表型。 四、测序标本要求与管理 1.样本采集:血液病患儿初诊时应同时留存骨髓、外周血或组织样本,以备进行NGS检测及变异位点验证。胚系突变验证标本可选择口腔上皮细胞、毛囊组织及指甲等,应注意避免外周血污染。怀疑遗传性疾病时,应同时采集父母样本用于验证。具体的标本送检要求及其优缺点见表2,除所列各项以外的病变组织也可作为检测样本,对于肿瘤性疾病进行初诊时基因突变检测时,样本中肿瘤细胞不低于10%。
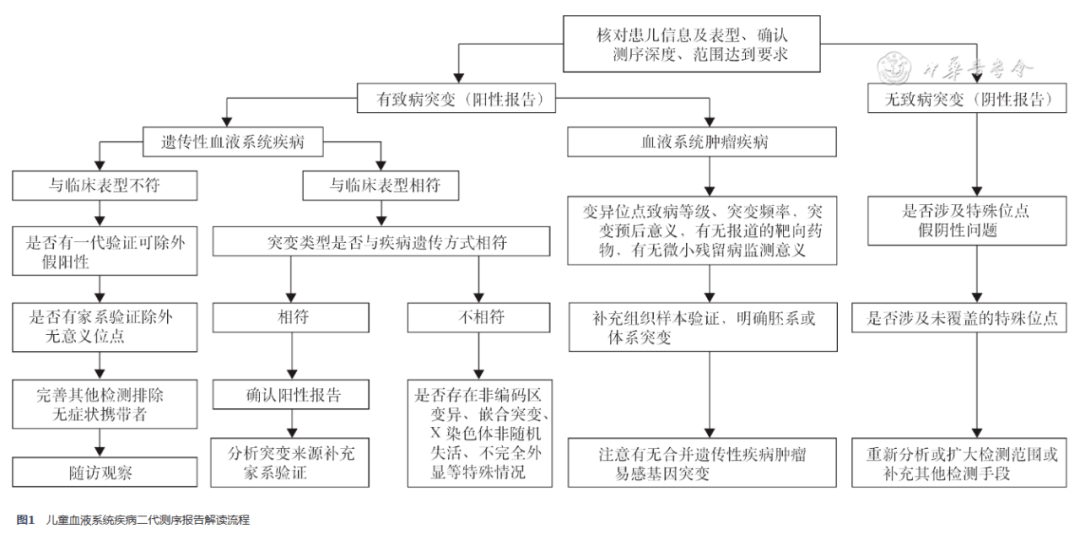
2.样本保存与管理:NGS检测标本运输与保存可参考“遗传病二代测序临床检测全流程规范化共识探讨(2)——样品采集处理及检测”。剩余标本应严格按照相关规定管理并长期保存,以便进行复检。 五、儿童血液系统疾病NGS检测报告内容要求 临床NGS检测报告分为报告正文与附录两部分,可参考“临床基因检测报告规范与基因检测行业共识探讨”。重点应详细报告检测到的有或者可能有致病意义的位点并进行致病性解读,具有诊断价值的与遗传性疾病有关的异常位点,建议尽量补充家系标本或体细胞标本验证。 1.基因组测序:肿瘤性疾病检测的基因突变可按“二代测序技术在血液肿瘤中的应用中国专家共识(2018年版)”进行描述及分级报告。遗传性疾病的基因变异应根据美国医学遗传学与基因组学学会指南进行描述及分级报告。对于致病或可能致病的变异位点,需要注意鉴别是胚系还是体细胞突变,不能单纯根据变异位点的突变频率,而是应采集对照组织细胞标本进行Sanger测序验证,同时尽量取家系标本进行验证。 2. RNA-Seq:RNA-Seq中针对融合基因的报告应当包括发生融合双方基因的名称、两侧断裂点的物理坐标和基因转录方向、测序丰度等基本信息。融合基因的致病性判读和说明需要依据各类疾病的诊疗指南、专家共识以及重要参考文献,并紧密结合疾病发病机制、融合基因序列可能的翻译产物。推荐按照以下方式进行分级:(1)与疾病密切相关:具有明确疾病诊断分型、预后或治疗指导意义,或是有权威文献或大规模报道在血液系统疾病中具有诊疗意义的融合基因;(2)与疾病可能相关:有过2次以上仅在相同类型疾病中报道但未能阐明临床诊疗意义,或是与疾病发病机制相符的融合基因;(3)临床意义未明:与文献报道的疾病类型存在一定差异,或不能完全解释疾病发病机制的融合基因。对于可能具有重要临床意义的融合基因,如无其他遗传学检查结果支持或是尚无文献报道,可以通过Sanger测序进行定性试验,或是通过实时荧光定量PCR或数字PCR进行定量试验,其中定量试验在肿瘤相关疾病中具有潜在的MRD监测价值。 3. IR-Seq:检测报告应包括DNA上样总量、初诊标本检测重排类型及比例、MRD检测重排类型及比例、当次检测方法的灵敏度等基本信息,肿瘤细胞克隆性重排及重排MRD标准建议参考“多发性骨髓瘤应用二代测序监测微小残留病的实验室标准化技术规范专家共识(2021年版)”相关标准进行判定。缓解期骨髓标本中检测到的所有序列均需与初诊标本中的肿瘤细胞克隆性重排序列进行比对,推荐在报告中体现历次MRD监测的时间点及变化曲线。对于在缓解期标本中检测到新出现的、满足肿瘤细胞克隆性重排序列定义标准的序列,建议应复查随访进一步确认其临床病理意义。 六、儿童血液系统疾病NGS检测报告解读流程 临床医生应熟悉各类儿童血液系统疾病的遗传学特点,收到检测报告后应核对患儿基本信息及表型是否正确,查看测序范围及深度是否达到要求。可参考“二代测序临床报告解读指引”及以下流程图(图1),详细阅读理解检测报告细节,必要时需要通过复习文献资料协助报告结果解读,并建议邀请遗传学专家协助评估。
首先,对于与临床表型不相符的阴性报告,应注意大片段缺失或非编码区突变所造成的假阴性可能,尤其地中海贫血、血友病等突变方式较为复杂的疾病,不能单纯根据阴性NGS报告排除该诊断。对于与临床表型不相符的阳性报告,应注意Sanger测序验证结果,除外假阳性可能,关注正常人群中携带率、父母基因型以除外非致病性位点,必要时补充相关检查除外无症状携带者,注意继续随访观察。建议完善我国儿童血液系统疾病测序数据库,汇总意义未明的变异位点及相应临床表型,结合基础研究手段,逐步补充完善变异位点的临床意义。 遗传性疾病的可疑致病位点,应关注该位点突变类型与疾病遗传方式是否相符。隐性遗传病检出单个杂合致病突变时应注意有无嵌合突变、X染色体非随机失活或未检出的非编码区突变等情况的影响。其次,要关注突变位点来源(父母来源或自发突变),是否可以确定为胚系突变。必要时增加其他家族成员的检验以便发现变异携带者或非典型患儿。 对于肿瘤性疾病的阳性位点,应关注变异位点的致病等级、突变频率以及预后意义,有无报道的靶向药物,有无MRD监测意义等。建议加做正常组织标本验证以鉴别胚系或体细胞突变,尤其幼年型粒单核细胞白血病,同一基因的胚系或体细胞突变可能有不同的诊断与预后意义。多次NGS报告应注意比较基因变异的个数变化及同一变异的突变频率改变,以便监测克隆演变及疗效评估。针对有特殊畸形、肿瘤家族史、既往造血或免疫系统异常的血液肿瘤患儿,应注意有无遗传易感基因或先天性疾病继发血液肿瘤,尤其应注意遗传易感性肿瘤相关基因胚系突变,必要时完善家系基因筛查。 七、NGS项目的局限性与补充检测 1.NGS检测具有以下局限性:(1)碱基序列读长较短(100~300 bp),对长片段缺失或插入检测准确率低;(2)建库时容易发生信息丢失或引入错配碱基;(3)检测费用较高,报告周期较长;(4)基因组非编码区一般不在常规检测范围,此类区域发生的致病基因变异可能遗漏,而包含非编码区的全基因组测序数据庞大,结果分析困难;(5)对于存在假基因等高度同源序列的基因发生的变异,分析判读和补充验证较为困难。 2.非NGS检测项目补充:由于NGS技术的局限性,应注意结合遗传学特点,完善其他检测手段以协助诊断。例如对于大片段缺失突变,可采用多重连接探针扩增、实时荧光定量PCR等技术;对于地中海贫血复杂的基因变异类型,可采用跨越断裂点PCR、反向斑点杂交PCR等技术;对于重型血友病A中的F8基因的内含子1倒位和内含子22倒位,可采用针对倒位产物的双管PCR方法协助诊断。此外,对于有明确融合基因或特定突变位点的肿瘤性疾病进行MRD检测时,实时荧光定量PCR或数字PCR技术在检测成本及报告周期上有显著优势,对于幼年型粒单核细胞白血病还可完善DNA甲基化程度检测协助预后判断。 NGS技术在临床中的广泛应用为儿童血液系统疾病的诊治提供了重要依据,也给临床医生提出了更高的要求。NGS的临床应用还存在检测范围、检测精度和位点分析与判读方面的局限性。临床医师在NGS的应用中首先应熟悉病情,有针对性地选择合适的送检项目,对于与临床不符合的结果,应积极寻找可能的原因进行补充检测。未来儿童血液学领域NGS技术的临床应用将朝单细胞、多组学等方向继续发展,在此基础上建立多中心儿童血液病大数据组学数据库并进行深入分析,将为儿童血液病的临床诊疗带来新的突破。 (万扬 张冬雷 徐晓军 执笔) 参加本共识制定单位及人员(按单位及姓名拼音排序):重庆医科大学附属儿童医院(于洁);福建医科大学附属协和医院(李健);复旦大学附属儿科医院(翟晓文);广州市妇女儿童医疗中心(江华);国家儿童医学中心首都医科大学附属北京儿童医院(王天有、张蕊、张瑞东);哈尔滨血液病肿瘤研究所(郝文鹏);华中科技大学同济医学院附属同济医院(胡群);华中科技大学同济医学院附属协和医院(金润铭);吉林大学白求恩第一医院(李春怀);青岛大学附属医院(孙立荣);山东大学齐鲁医院(鞠秀丽);上海交通大学医学院附属上海儿童医学中心(陈静、沈树红);上海交通大学医学院附属儿童医院(蒋慧);四川大学华西第二医院(高举);苏州大学附属儿童医院(胡绍燕);新疆医科大学第一附属医院(严媚);浙江大学医学院附属儿童医院(汤永民、徐晓军);郑州大学第一附属医院(刘玉峰);中国医科大学附属盛京医院(郝良纯);中国医学科学院血液病医院(中国医学科学院血液学研究所)[肖志坚、万扬、王慧君、杨文钰、张冬雷(现单位为武汉大学中南医院)、竺晓凡];中华儿科杂志编辑部(李伟);中山大学附属第一医院(罗学群);中山大学孙逸仙纪念医院(方建培);遵义医科大学附属医院贵州省儿童医院(陈艳、何志旭) 参考文献(略)返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |