CHO细胞培养过程动态代谢通量分析 |
您所在的位置:网站首页 › 幻想生活link › CHO细胞培养过程动态代谢通量分析 |
CHO细胞培养过程动态代谢通量分析
|
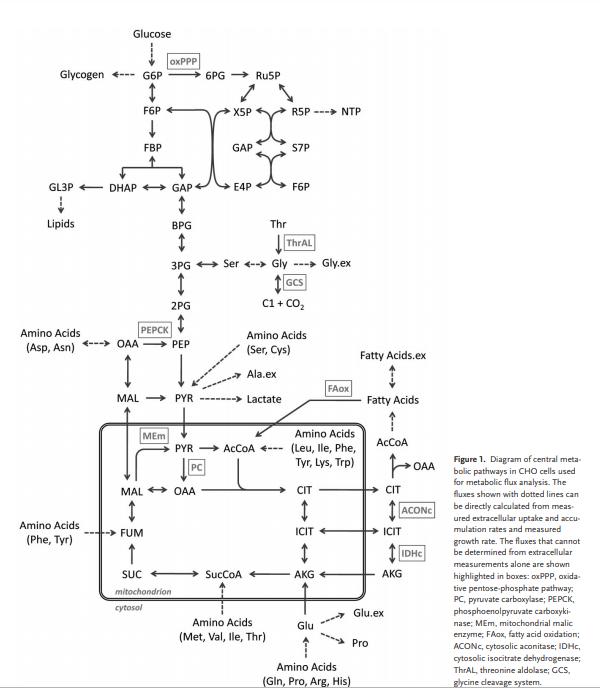
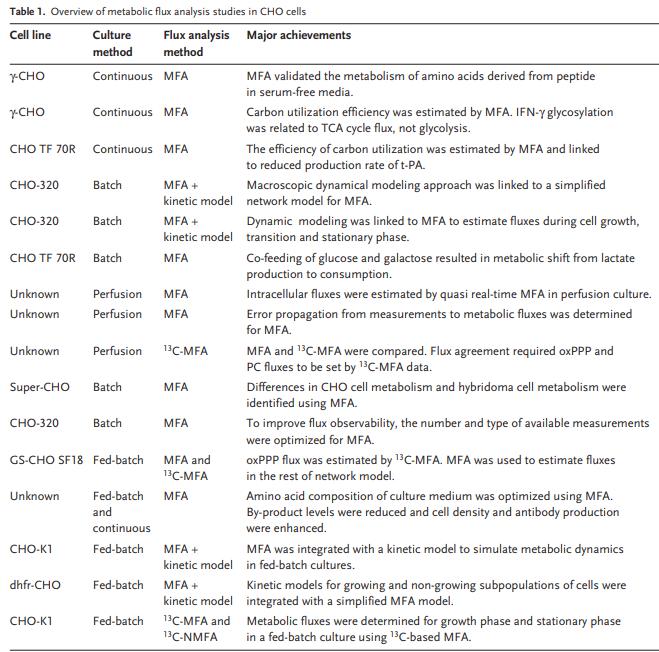
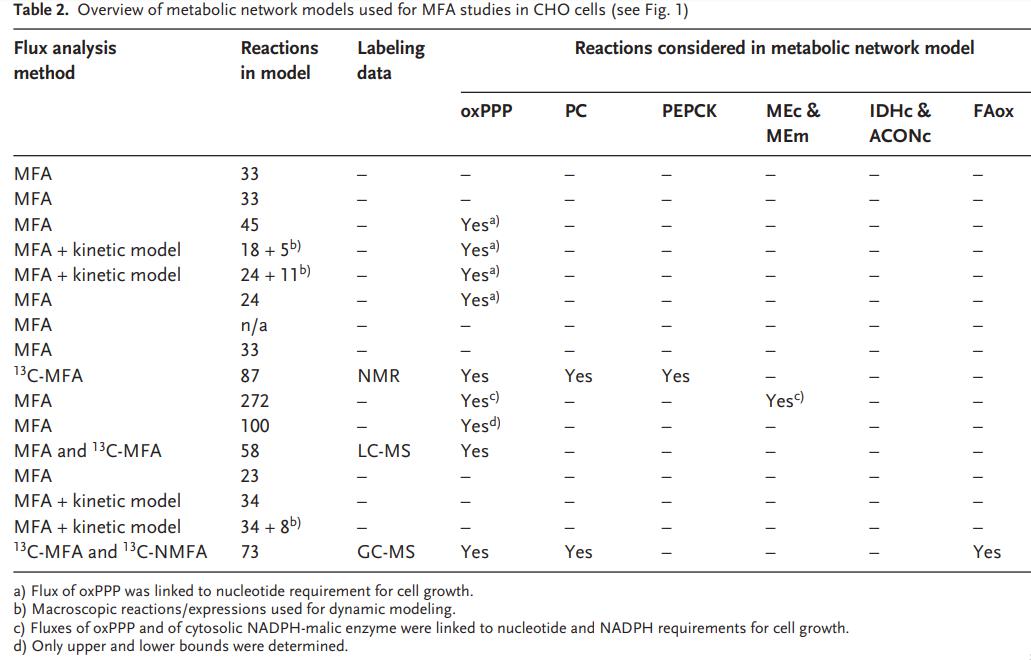
2.1糖酵解和乳酸生产 哺乳动物细胞可以利用糖酵解,TCA循环和氧化磷酸化作用从葡萄糖中产生能量,每摩尔葡萄糖可产生高达36摩尔ATP。在低氧条件下,丙酮酸下游的碳流可以转移到乳酸的产生,因为葡萄糖到乳酸的转化是氧化还原中性的,即没有净产生或消耗的NAD(P)H。但是,大多数哺乳动物生产细胞系,包括CHO细胞,都会将葡萄糖代谢为乳酸,而与氧气供应的水平无关,这被称为“沃伯格效应”或有氧糖酵解。有氧糖酵解是一种无效的代谢表型,因为在葡萄糖向乳酸的转化中每摩尔葡萄糖仅产生4摩尔ATP。VanderHeiden等人假设增殖细胞利用过量的乳酸产生作为在营养丰富的条件下快速生长的更有效的手段。在人,仓鼠肾,杂交瘤和CHO细胞中,葡萄糖在乳酸上的典型产量范围为1-2(mol/mol)。培养基中高浓度的葡萄糖会增加葡萄糖的消耗并导致乳酸的产生增加。在细胞培养物中,高水平的乳酸积累会抑制细胞生长和产物形成。据报道,乳酸的抑制与培养基的酸化和渗透压升高有关。为了减少乳酸的形成,已采用限制葡萄糖的培养策略。据报道,通过实时测量摄氧速率来控制葡萄糖补给,补料分批培养的细胞代谢得到改善。葡萄糖上的乳酸产率(ΔL/ΔG)从1.16 mol/ mol降低至0.16 mol/mol,这大大减少了副产物的积累并改善了工艺性能。在转录和翻译水平检测到相似的代谢变化。高和低ΔL/ΔG条件的比较显示,当乳酸产量低时,葡萄糖相关基因被下调。结论是,代谢变化可能是通过未知的调节机制使细胞代谢适应新的环境条件。 糖酵解的速度还取决于其他环境因素。例如,生长因子的刺激可以通过PI3K / AKT激活来调节葡萄糖转运蛋白,己糖激酶和磷酸果糖激酶的活性。己糖激酶是葡萄糖转化为6-磷酸葡萄糖的第一步,这是糖酵解,戊糖-磷酸途径和糖原存储的关键分支点。由于细胞内葡萄糖和乳酸的浓度,在糖酵解的两个起点,比中间体葡萄糖6磷酸,果糖6磷酸,磷酸烯醇丙酮酸和丙酮酸高得多,己糖激酶被认为是在糖酵解中限速步骤之一。最近,己糖激酶2被确定为有氧糖酵解的关键介质。在癌细胞中,Warburg效应会使丙酮酸激酶M2-PK的另一种剪接异构体有活性。 2.2连接糖酵解和TCA循环的反应 Neermann和Wagner测定了BHK-21,CHO-K1和杂交瘤细胞系中葡萄糖代谢的细胞特异性酶活性,Pitzpatrick等人在杂交瘤细胞的分批培养中测量了代谢活性。没有细胞系显示连接糖酵解和TCA循环的磷酸烯醇丙酮酸羧激酶(PEPCK),丙酮酸羧化酶(PC)和丙酮酸脱氢酶(PDH)的活性。这三种酶在大多数哺乳动物生产细胞系中具有低活性。由于大多数葡萄糖碳通过乳酸脱氢酶(LDH)变成乳酸,而PC的活性较低,因此分解代谢的碳流进入TCA循环,LDH的敲低和PC的过表达是自然的细胞工程的目标。Iran等人将酿酒酵母(PYC2)的胞质丙酮酸羧化酶引入BHK-21细胞系,实现了较高的细胞内ATP水平和较低的葡萄糖乳酸产量,并使人类促红细胞生成素的产量提高了两倍。PYC2基因也被引入人HEK-293和CHO-K1细胞,人PC基因被引入CHO-DG44细胞,所有这些都改善了细胞培养性能。为了减少乳酸分泌,LDH-A基因在杂交瘤细胞中被破坏,并在CHO细胞中使用RNAi技术被部分抑制。 2.3 磷酸戊糖途径 磷酸戊糖途径有两个不同的分支,氧化分支(oxPPP)和非氧化分支(noxPPP)。在oxPPP中,6-磷酸葡萄糖通过6-磷酸葡萄糖脱氢酶(G6PD)和磷酸葡萄糖酸酯脱氢酶转化为5-磷酸核糖,生成二氧化碳和2 NADPH。在noxPPP中,通过转酮醇酶和转醛醇酶合成5磷酸核糖,不会产生CO2或NADPH。 代谢中间体5-磷酸核糖磷酸酯是核苷酸合成的关键前体。因此,G6PD和转酮醇酶是增生位于oxPPP和noxPPP之间分支点的细胞的重要酶。G6PD是oxPPP的限速酶,受NADPH氧化还原状态控制。塔特尔等报道,缺乏G6PD的CHO细胞易于凋亡,Fico表明,具有G6PD缺陷的胚胎干细胞对氧化应激更为敏感。因此,oxPPP被证明不仅对生物合成很重要,而且对应对氧化应激也很重要。有趣的是,p53调控基因有两个相关的作用:对细胞凋亡和对氧化应激的反应。为了减少活性氧,它通过TIGAR表达刺激oxPPP分流,以产生NADPH,通过抑制磷酸果糖激酶来激活oxPPP。产生的NADPH用于将氧化型谷胱甘肽(GSSH)还原为谷胱甘肽(GSH),以去除活性氧。同时,转酮酶在增殖细胞中也被上调。使用转酮醇酶抑制剂羟硫胺和[1,2- 13C]葡萄糖示踪剂,通过GC-MS分析了胰腺腺癌细胞RNA中分离出的核糖。结果表明,从头合成核糖的85%来自noxPPP。最近,也有报道说转酮醇酶样基因1在通过noxPPP进行核酸合成中具有重要作用。总而言之,这些研究表明oxPPP和noxPPP在增生的哺乳动物细胞的代谢中都起着重要作用。 2.4 谷氨酰胺分解和TCA循环 除糖酵解外,谷氨酰胺分解在哺乳动物细胞系中在能量产生和回补中起着重要作用。谷氨酰胺分解定义为通过TCA循环,苹果酸-天冬氨酸穿梭和苹果酸酶将谷氨酰胺转化为丙酮酸。谷氨酰胺分解的第一步是通过谷氨酰胺酶将谷氨酰胺转化为谷氨酸。然后通过脱氨基或转氨基将谷氨酸转化为α-酮戊二酸酯。丙氨酸氨基转移酶将谷氨酸的胺基转移至丙酮酸以形成α-酮戊二酸和丙氨酸,而天冬氨酸氨基转移酶催化谷氨酸和草酰乙酸转化为α-酮戊二酸和天冬氨酸。谷氨酰胺代谢为α-酮戊二酸可产生一到两个铵分子。Street表明,HeLa和CHO细胞产生的几乎所有铵盐都是从谷氨酰胺的酰胺基团中释放出来的,大多数丙氨酸和谷氨酸盐是由谷氨酰胺的胺基团标记的,使用带有15N标记酰胺或胺基的谷氨酰胺示踪剂。这些发现表明,谷氨酰胺分解和谷氨酰胺酶反应会产生大量的累积铵,大多数α-酮戊二酸是通过氨基转移而不是通过谷氨酸脱氢酶(GDH)产生的。相反,Martinelle报道,在葡萄糖缺乏的条件下,使用1H / 15N NMR和15N标记的谷氨酰胺,杂交瘤培养物中GDH的代谢增加了5到8倍,这表明谷氨酰胺酶和GDH的调节对葡萄糖的可用性敏感。谷氨酰胺是一种不稳定的介质组分,在其中容易分解为吡咯烷酮羧酸和铵。分解速率取决于pH值,温度和磷酸盐浓度。例如,Ozturk和Palsson指出,杂交瘤细胞培养物中谷氨酰胺的实际摄入量比表观摄入量低三倍。通过谷氨酰胺分解和谷氨酰胺分解释放的铵是哺乳动物细胞培养物中的有毒副产物。铵盐在分批培养中可以积累到2–10 mM的水平,并且可能对细胞生长,蛋白质生产和蛋白质糖基化产生负面影响。Schneider等。[8]认为丙氨酸氨基转移酶和天冬氨酸氨基转移酶反应是去除铵的解毒过程。支持这一点的是,观察到在铵盐胁迫条件下,谷氨酸和天冬氨酸转氨酶的通量增加,脯氨酸的产量增加,谷氨酸的产量减少。为通过细胞工程努力减少铵盐的积累,谷氨酰胺合成酶(GS)基因已在CHO(GS-CHO)和NS0(GS-NS0)细胞中过表达。在CHO,杂交瘤,BHK和HeLa细胞系中,GS活性通常相对较低。可以在无谷氨酰胺的培养基中成功培养过表达GS的细胞系。 2.5 氨基酸代谢 哺乳动物细胞依赖于必需氨基酸的摄取来进行蛋白质的生物合成和细胞生长,并且理论上可以利用所有氨基酸进行分解代谢。通过直接测量摄取和生产率以及结合 13C标记实验,可以获得对氨基酸代谢的深入了解。假设已知哺乳动物细胞系的生物量组成,就可以轻松计算分别用于分解代谢和合成代谢的氨基酸分数。最近,我们使用[U- 13C]葡萄糖和[U- 13C]谷氨酰胺示踪剂研究了CHO-K1细胞中的氨基酸代谢。通过 13C标记测量细胞内和细胞外氨基酸,我们发现了几种获得 13C标记的氨基酸,包括丙氨酸,丝氨酸,甘氨酸,天冬氨酸,谷氨酸,谷氨酰胺和脯氨酸。在TCA循环中间体中使用 13C-MFA和其他 13C标记测量,可以建立CHO细胞中氨基酸代谢的详细通量图。氨基酸对生物量合成,分解代谢的不同贡献副产物的形成为介质优化提供了实用的见识。 03 CHO细胞中的代谢通量分析 3.1 用于代谢通量分析的CHO细胞模型 图1显示了用于通量分析研究的CHO细胞中的主要代谢途径图,这些途径包括糖酵解,氧化和非氧化戊糖磷酸途径,TCA循环,集中的氨基酸途径用于生物质前体的生物合成。虚线所示的通量可以直接由测量的细胞外摄取和累积速率,测量的生长速率以及已知的生物量组成计算得出。以这些测量为约束条件,网络模型剩下一些未知通量,使用 13C进行估算示踪剂,在图1的方框中以高亮显示。直到最近,大多数关于CHO细胞的流量分析研究都是基于经典的代谢物平衡(即没有 13C示踪剂),并且在大多数情况下,仅考虑一种特定的代谢表型,例如表1列出了近年来对CHO细胞的重要通量分析研究。第三列显示了所采用的通量分析方法的类型。表1列出的16项研究中,有9项使用了稳定MFA,4项使用了带有动力学模型的稳定MFA,还有3项使用了基于 13C的MFA。表2显示了用于通量分析的代谢网络模型的范围。对于稳定MFA,使用简化的网络模型来确保系统是可观察的。
通常的假设是消除图1中突出显示的未知自由通量,即基本上假定这些反应携带的通量很少或没有。一些研究在模型中包括了oxPPP。但是,oxPPP途径通量与核苷酸的生物合成和/或NADPH平衡有关。因此,这些研究仅提供了通过oxPPP的实际通量的较低估计。在接下来的部分中,我们简要回顾了从表1列出的研究中获得的关键结果,并重点介绍了估计哺乳动物细胞系中代谢通量仍然存在的一些挑战。
3.2稳定MFA在CHO细胞中的应用 稳定MFA已在CHO细胞中用于多种应用,包括培养基优化,定量肽消耗率,重组蛋白产生率,共底物代谢,通量研究中误差传播的分析。使用不同浓度的培养基成分,通过MFA优化了氨基酸的培养基组成。Nyberg等人证明MFA可用作验证细胞外测量结果一致性的工具。结果表明,通量建模中应包括复杂介质中的肽消耗量,以获得统计学上可接受的结果。Altamirano等人在一系列葡萄糖受限的连续培养中,呼吸商的模拟值和估计值(CO2产生与O2消耗的比率)之间取得了良好的一致性。经典MFA还用于提供洞察重组蛋白糖基化的细胞途径的不同贡献。例如,Nyberg等人报道干扰素-γ中糖基化位点的占用与TCA效率密切相关,但对糖酵解通量不敏感。Altamirano等人评估了使用多种底物(包括葡萄糖,半乳糖和谷氨酸)来减少副产物如乳酸,丙氨酸和甘氨酸的积累。CHO细胞的分批培养显示出乳酸产生和消耗两个不同的阶段,据报道,使用MFA模拟低估了乳酸消耗阶段TCA循环的氧化活性。最近,Goudar等人描述了一种确定通量分析中从细胞外代谢物测量到估计通量的误差传播的程序。在另一项研究中,Goudar等人还描述了使用在线测量的实时MFA的应用。为了估计待定系统中的通量,提出了对经典MFA的扩展,用于计算未解析通量的上限和下限。扩展的MFA技术被称为通量谱分析。最近,Quek等人应用了类似的策略来估计CHO细胞代谢的大规模模型中的通量,该模型由272个反应和228个代谢产物组成,用于比较CHO细胞和杂交瘤细胞的代谢。尽管不是所有的通量都可以使用MFA唯一确定,但可以使用类似于通量谱分析的技术来确定中央代谢关键分支点的上限和下限。
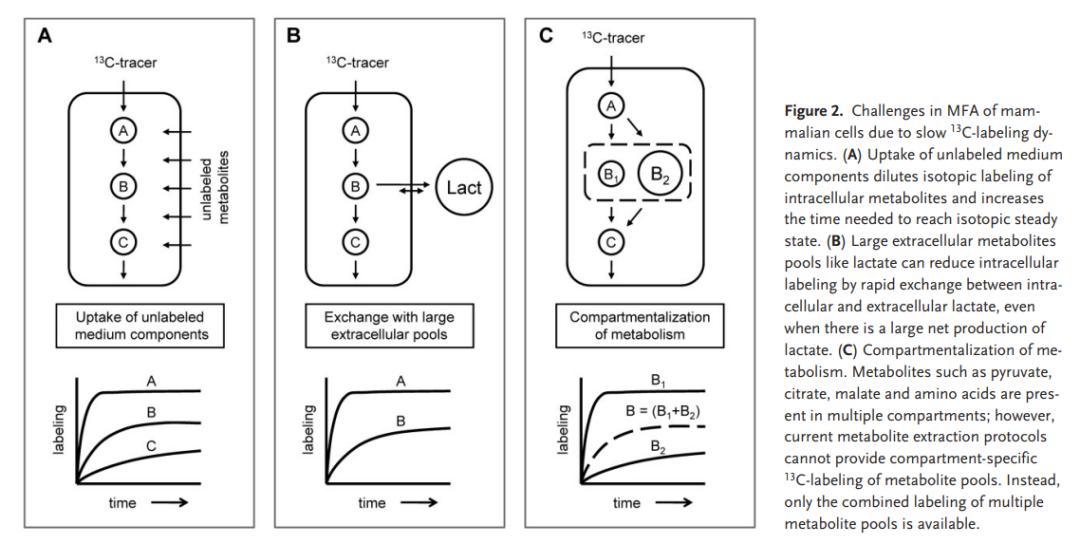
3.3 MFA结合动力学模型的应用 近年来,出现了几项研究,其中将稳定MFA与动力学模型结合起来描述CHO细胞的分批和补料分批培养的代谢通量动态。最初的动力学建模框架基于Provost和Bastin从CHO细胞模型获得的集总网络模型。最近,Nolan和Lee使用相似的动力学建模方法来追踪CHO细胞补料分批培养中细胞内和细胞外代谢通量的变化。 3.4 13C示踪剂在CHO细胞通量分析中的应用 据我们所知,目前只有三项研究将 13C示踪剂用于CHO细胞的代谢通量分析。Goudar等人使用[1- 13C]葡萄糖和[U- 13C]葡萄糖的混合物,使用2D [ 13C,1H] NMR测定了水解生物质中氨基酸的 13C-标记,和使用LC在培养基中测定了乳酸盐的 13C-标记-MS用于通量分析。这项研究的主要发现是oxPPP和PC在CHO细胞中均具有活性。约40%的葡萄糖通过oxPPP代谢(剩余的60%通过糖酵解),并且10%的丙酮酸通过PC转化为草酰乙酸(剩余的90%通过PDH转化为乙酰-CoA)。Goudar等人证明,当从 13C-MFA分析获得的结果固定在oxPPP和PC反应的通量,使用经典MFA获得的结果仅与 13C-MFA结果吻合得很好。Sengupta等人还使用了[1- 13C]葡萄糖和[U- 13C]葡萄糖示踪剂的混合物,LC-MS测定了戊糖-磷酸途径的四种代谢产物中的 13C标记。Sengupta等人发现在稳态后期,在CHO细胞培养中可使用 13C-MFA估计oxPPP通量。由于在其他细胞内代谢产物中未检测到明显的 13C标记,因此将经典MFA应用于估算代谢网络其余部分的代谢通量。这项研究的主要发现是,oxPPP在静止后期在CHO细胞中具有很高的活性。 最近,Ahn和Antoniewicz在分批补料培养的两个代谢阶段,指数生长期和静止初期确定了一组CHO细胞的代谢通量图。在这项研究中,Ahn和Antoniewicz使用[1,2- 13C]葡萄糖,并使用GC-MS测定了糖酵解途径和TCA循环中13种细胞内代谢产物的 13C标记动力学。使用 13C-MFA估算oxPPP通量,使用非稳定 13C-NMFA估算模型中的其余通量。这项研究的主要发现是PC在指数生长期活跃(而不是在稳定期),而oxPPP在早期生长期活跃(而不在指数生长期)。上面讨论的所有三个基于 13C的MFA研究得出的结论是,以前在CHO细胞MFA研究中采用的假设(例如oxPPP和PC通量可忽略不计)是无效的。这对于未来使用MFA方法研究CHO细胞代谢具有重大影响。由于MFA模型中包含oxPPP和PC反应会导致系统不确定,因此MFA研究无法提供独特的解决方案。在这些待定模型中,可以使用诸如通量谱分析(在第3.2节中讨论)之类的方法来估计通量的上限和下限,通量的置信区间通常为太大而无法得出任何具有统计意义的结论。因此,CHO细胞代谢的研究未来应大量使用 13C标记数据来帮助限制溶液流量。 04 估算哺乳动物细胞流量的挑战 4.1由于缓慢的标记动力学,在通量预估上面临的挑战 与细菌细胞不同,在几分钟内细胞内代谢物的标记接近同位素稳定状态,哺乳动物细胞通常显示出缓慢掺入细胞内代谢物的标记,大约数小时左右。实际上,这意味着在哺乳动物细胞中基于 13C的通量分析需要更严格的实验和计算工作。代替应用相对完善的 13C-MFA,必须执行计算量大得多的非稳态 13C-NMFA,并包括必须估计的其他模型参数(即代谢物库大小)。此外,必须在一段时间内收集多个样本,以获取 13C标记动力学的准确概况,而不是在同位素稳态下收集单个样本。这些研究中的关键问题是确保在标记实验过程中维持代谢稳态。例如,Sengupta等人在CHO细胞中放置6 h后,未检测到 13C-葡萄糖中TCA代谢产物的任何显着标记,Ahn和Antoniewicz报告至少需要24 h才能在TCA循环代谢物中累积10%标记。CHO细胞的分批补料培养。长时间保持代谢稳态可能是一项挑战。如果在标记实验过程中代谢通量发生变化,则必须使用 13C-动态MFA代替 13C-NMFA进行数据分析。 哺乳动物细胞中标记动力学缓慢的原因有很多。原因之一是在哺乳动物细胞培养物中使用了复杂的培养基,即含有葡萄糖,谷氨酰胺,其他氨基酸,脂肪酸和有机酸的事实。在某些研究中,向培养基中添加了5-10%的血清,而行业中通常使用包含非动物来源水解产物的无血清培养基。如Nyberg等人所示,MFA建模应包括从复杂介质中消耗肽。多种非富集碳源的代谢可能会稀释细胞内代谢物的标记并减慢标记的掺入。此外,大量的细胞外代谢物库可以充当标记掺入的缓冲液(即与中等体积相比,细胞体积较小),尤其是如果细胞内和细胞外代谢物之间存在显着交换。培养基中的乳酸可与细胞内的乳酸交换,减慢丙酮酸的标记动力学,即使在乳酸的净产量很高的条件下,例如在CHO细胞的指数生长过程中。
4.2代谢分区导致的通量估算面临的挑战 确定哺乳动物细胞代谢通量的最终复杂因素,也可能减慢标记的掺入,与代谢的分区有关。为了分析CHO细胞中的中心代谢通量,必须考虑:细胞质和线粒体。虽然某些代谢途径仅限于一个位置,例如,细胞质中的戊糖-磷酸途径,其他途径跨越多个隔间。例如,糖异生途径取决于细胞质和线粒体中的反应。哺乳动物细胞具有许多可以催化多个区室中类似反应的同工酶,例如胞质和线粒体苹果酸酶。在MFA研究中,同工酶的存在会产生平行的途径和代谢循环,仅使用代谢物平衡无法解决,而且在许多情况下甚至很难使用 13C-MFA技术来解决。但是,有强有力的证据表明,平行途径和代谢循环(如丙酮酸循环)在调节哺乳动物细胞中的重要事件中起着关键作用,因此应进行更详细的研究。例如,Jensen等人确定了胰腺细胞中三个潜在的丙酮酸循环,这些循环被认为在胰岛素分泌中起作用。最后,只有特定数量的存在特定转运蛋白的代谢物才可能穿过线粒体膜运输。由于辅因子NADH和NADPH不能穿过线粒体膜,因此这些转运必须由多个代谢途径共享,此外,转运减少了跨线粒体膜的当量。 已经假设,在体内,胞质和线粒体池可能被不同地标记并且具有不同的标记时间尺度。例如,Munger等人使用[U- 13C]葡萄糖和[U- 13C]谷氨酰胺示踪剂显示了代谢相关代谢物的差异标记模式。该结果提供了有力证据证明成纤维细胞中的区室代谢。Lu等人还根据INS-1β细胞中的 13C NMR测量结果,提出了两个丙酮酸盐库的存在。理想情况下,我们希望获得针对 13C-MFA的特定于隔室的标记图案的准确测量值。然而,目前的提取技术不适用于分离没有代谢物泄漏的不同细胞内代谢物库。因此,只能测量丙酮酸,苹果酸,柠檬酸和氨基酸的线粒体和胞质库的组合。代谢物提取技术的进步将极大地提高使用 13C-MFA解析哺乳动物细胞中特定区室通量的潜力。 05 结论 在本文中,我们回顾了与CHO细胞代谢有关的代谢通量分析的研究。常规MFA已广泛用于研究CHO细胞代谢和其他哺乳动物细胞系的代谢。使用简化的网络模型和细胞外代谢物测量建立初始通量图。最近,基于 13C的技术对CHO细胞的代谢进行了更详细的研究。这些新的研究表明,以前的MFA工作中使用的几个关键假设可能对CHO细胞无效,尤其是关于氧化戊糖磷酸途径的活性和来自于MFP的回补反应,丙酮酸为草酰乙酸。因此,对CHO细胞的未来研究应更多地使用 13C示踪剂,以更好地约束通量解并验证其他建模假设。 原文来源: Woo Suk Ahn and Maciek R. Antoniewicz.Towards dynamic metabolic flux analysis in CHO cell culturesBiotechnol. J. 2012, 7, 61–74 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |