考点梳理 |
您所在的位置:网站首页 › 常见物质的溶解度曲线 › 考点梳理 |
考点梳理
|
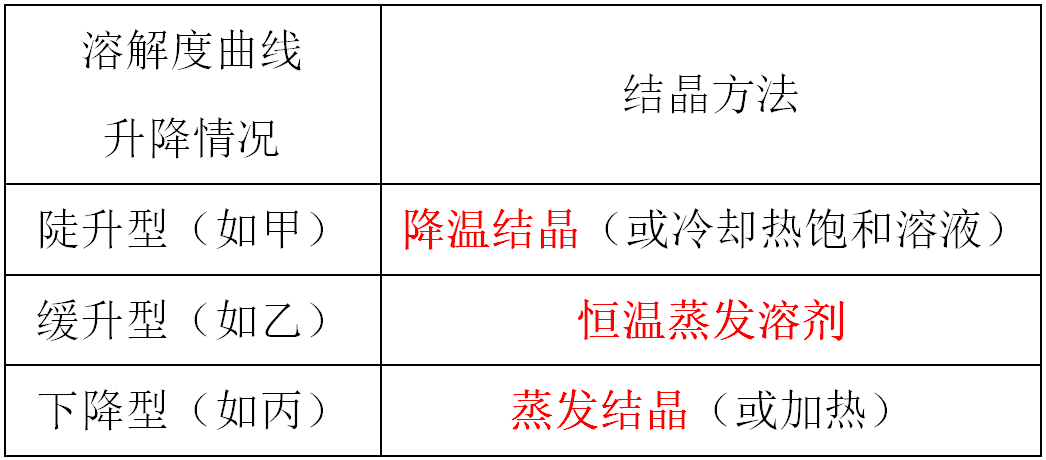
5.溶液溶质质量分数的计算与比较 t 1 ℃时,将40g丙加入到100g水中,充分溶解,所得溶液的溶质质量分数为28.6%;t 2 ℃时,甲的饱和溶液的溶质质量分数为20%。 计算公式:溶质质量分数=溶质质量/溶液质量×100% 6.判断物质结晶的方法
7.温度改变时,溶液中各种量的变化情况 t 3 ℃时,将相同质量的甲、乙、丙的饱和溶液同时降温到t 1 ℃,则有乙溶质质量>丙溶质质量。 饱和溶液温度变化时,当物质的溶解度随温度的升高而增大时(即曲线为上升型)。若将饱和溶液降低温度,由于析出晶体,溶液中溶质质量减小,溶剂质量不变,溶液质量减小,因此溶质质量分数变小。若将饱和溶液升高温度,饱和溶液变为不饱和溶液,溶液中溶质、溶剂质量均不变,因此溶质质量分数也不变。当物质的溶解度随温度升高而减小时(即曲线为下降型)。改变温度时,溶液中溶质、溶剂、溶液的质量,溶质质量分数变化情况与上述分析相反。 二、溶解度表
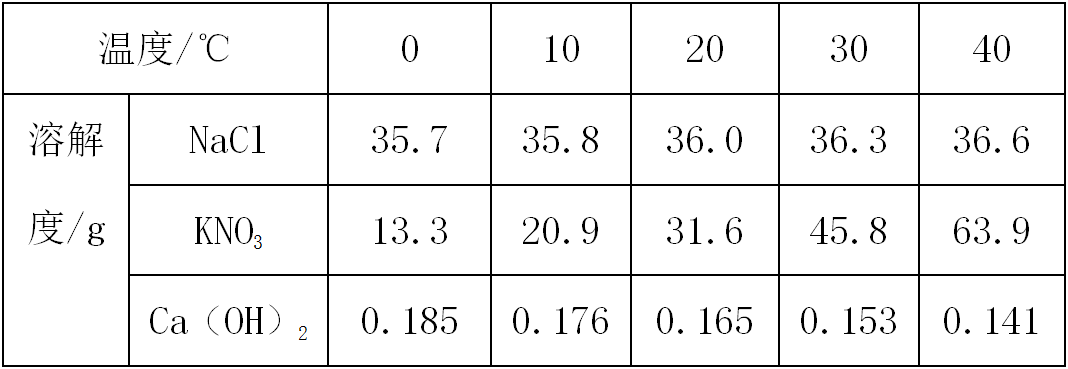
1.从表中直接读取信息 ①同一物质在不同温度下的溶解度。 如氯化钠在10℃时溶解度为35.8g,在30℃时溶解度为36.3g。 ②不同物质在同一温度下的溶解度。 如20℃时,氯化钠的溶解度为36.0g,硝酸钾的溶解度为31.6g,氢氧化钙的溶解度为0.165g。 ③根据不同温度下溶解度的变化情况,判断物质的溶解度随温度的变化趋势。如氯化钠的溶解度变化趋势为随温度升高,溶解度增大,但是幅度较小;硝酸钾的溶解度变化趋势为随温度升高增长幅度较大;氢氧化钙的溶解度变化趋势为随温度增大而减小。(仅变化趋势、不做数据对比) 2.溶解度表的应用 以表格数据形式考查两种物质(如NaCl和KNO 3 )溶解度相等的温度范围为20℃至 30℃。 方法指导:根据溶解度表,通过对比两种物质的溶解度,20℃以前,NaCl的溶解度大于KNO 3 ,30℃以后,NaCl的溶解度小于KNO 3 ,则NaCl和KNO 3 溶解度相等的温度范围一定在20℃至30℃之间。 声明:本文转自初三研究中心,以上图文,贵在分享,版权归原作者及原出处所有,若涉及版权等问题请联系删除。 知识归纳 | 化学:初中考试能用到的元素符号与化学式 考点梳理 | 化学:新冠疫情时事热点整理 考点梳理 | 化学:空气、氧气中考真题汇编 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |