吴树坤┃山葡萄酒发酵动力学及抗氧化活性研究 |
您所在的位置:网站首页 › 山葡萄原产 › 吴树坤┃山葡萄酒发酵动力学及抗氧化活性研究 |
吴树坤┃山葡萄酒发酵动力学及抗氧化活性研究
|
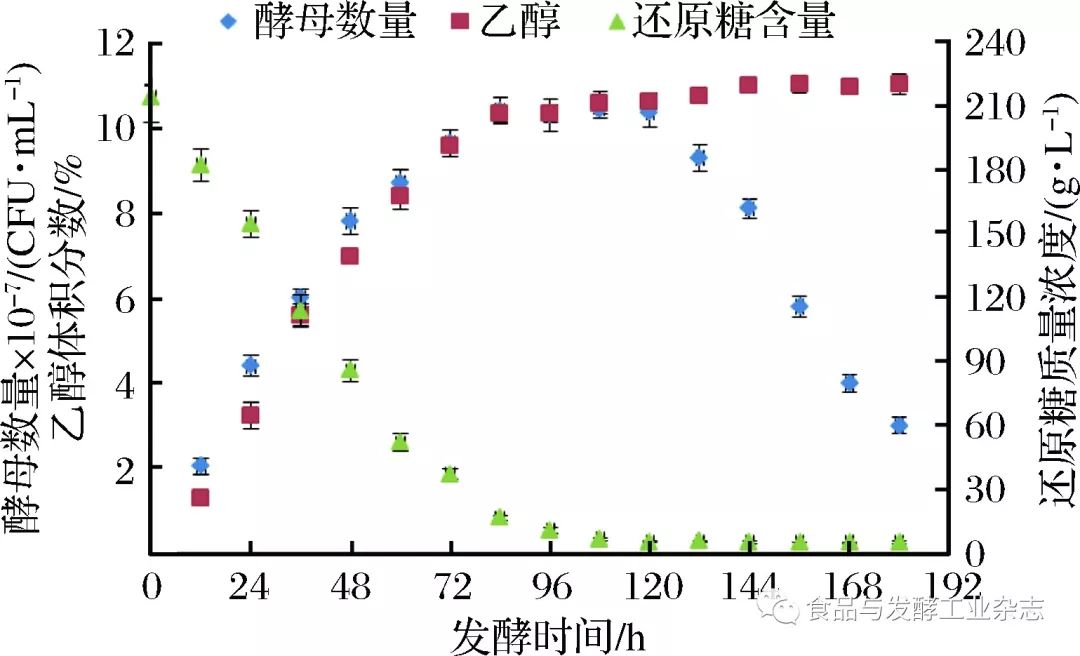
HWS-12恒温水浴锅,上海一恒科学仪器有限公司;Lynx6000高速落地离心机,赛默飞世尔科技有限公司;SPX-250生化培养箱,常州普天仪器制造有限公司;UV-1200紫外可见分光光度计,上海美谱达仪器有限公司;高精度数显酒精浓度计,上海点将精密仪器有限公司。 1. 3 方法 1.3.1 山葡萄酒发酵流程[11] 二氧化硫、果胶酶 加糖 接种酵母 ↓ ↓ ↓ 山葡萄→除梗→破碎→葡萄浆→浸渍→调整成分→发酵→倒灌→后发酵 按m(果胶酶)∶m(葡萄)=1∶25 000的比例于葡萄浆中加入果胶酶;调硫片加入量以二氧化硫在葡萄浆的终质量浓度为50 mg/L为准;浸渍时间24 h后,加白砂糖调整糖度至20°Brix,接种酵母后,28 ℃恒温发酵7 d后,倒灌进行后发酵。 1.3.2 样液的采集与处理 葡萄破碎后采集葡萄浆及接入酵母发酵后每12 h采取1次,将发酵液离心,取上层清液作样液。 1.3.3 发酵动力学数据的测定 酵母数量:将发酵液稀释数倍滴于血球计数板上,在光学显微镜下直接计数;还原糖含量和酒精度的测定:均采用GB/T15038—2006葡萄酒、果酒通用分析方法,采用斐林试剂法测定山葡萄发酵液中还原糖含量并用酒精计法测定山葡萄酒的酒精度[12]。 1.3.4 总酚含量的测定 采用福林-肖卡(Folin-Ciocalteau)法测定山葡萄酒液中的总酚[13],总酚含量以没食子酸质量浓度等价值表示。 1.3.5 ****酮含量的测定 采用NaNO2-Al(NO3)3-NaOH比色法[14],****酮含量以芦丁质量浓度等价值表示。 1.3.6 抗氧化性试验 1.3.6.1 DPPH自由基清除能力的测定 参照文献[15]中方法对DPPH自由基和ABTS·+清除率进行测定。 1.3.6.2 Fe3+还原能力测定[16] 参照文献[16]中方法对Fe3+还原能力测定进行测定,并计算1 mL样品相当于VC对Fe3+还原能力的质量(mg)。 1. 4 数据处理与分析 每组试验做3次平行,试验结果均以x±sd表示,应用Origin8.0软件对浸渍前山葡萄浆和不同发酵时间的发酵液试验结果进行作图分析。 菌体生长、还原糖消耗、酒精生成情况发酵动力学模型的建立,应用Origin8.0软件[17-18]选取合适的模型,对酵母数量、还原糖含量和酒精度数据进行非线性拟合,判定系数R2越大,拟合度越高,选取拟合度最高的模型对其进行定量描述。 应用SPSS 20软件对样品总酚、****酮含量与其抗氧化能力进行相关性分析;并对葡萄浆(浸渍前)、浸渍后(发酵0 h)及发酵后(180 h)样品中总酚、****酮含量及其抗氧化能力进行差异显著性分析。 2 结果与分析 2. 1 山葡萄酒发酵过程中酵母数量、 酒精度、 还原糖含量的变化趋势 由图1所示,酵母菌在0~84 h为快速生长期,随后进入平稳期,120 h后进入衰亡期,发酵阶段较为典型,酵母数量最高达1.045×108CFU/mL。酒精在0~84 h期间快速积累,84 h后酒精积累速度较缓慢,最大酒精度达11.03%vol。发酵前108 h还原糖含量快速消耗,随后还原糖含量无明显变化。由于0~84 h酵母快速生长,利用还原糖代谢生成酒精,因而还原糖快速消耗,酒精含量以较快速度上升;随后,酵母在较高酒精浓度的胁迫下和较低还原糖浓度下进入平稳期进而衰亡,从而酒精度缓慢增长,还原糖维持在较低水平,还原糖的消耗和酒精的生成几乎是对应的。由此可判断所得结果是合理的。
图1 山葡萄酒发酵过程中酵母数量、酒精度、还原糖含量的变化趋势 Fig.1 The trends of yeast number, alcohol content and reducing sugar content in the fermentation process of vitisamurensis wine 2. 2 山葡萄酒发酵动力学模型的建立 2.2.1 酵母菌生长动力学模型 由图1可得,由于酵母菌在120 h后开始进入衰亡期,而在0~120 h时酵母处于生长期和平稳期,故本研究拟对发酵0~120 h时期酵母生长情况进行非线性回归。通过不同模型进行拟合,由表1可得,SGompertz模型对酵母生长情况拟合效果最好,拟合优度R2=0.997 07,能较好地说明酵母生长情况,故选用SGompertz模型对山葡萄酒发酵过程酵母生长情况进行定量描述。拟合曲线由图2所示。 表1酵母数量的拟合方程及其拟合优度 Table1Fittingequationofyeastnumberandits goodnessoffit
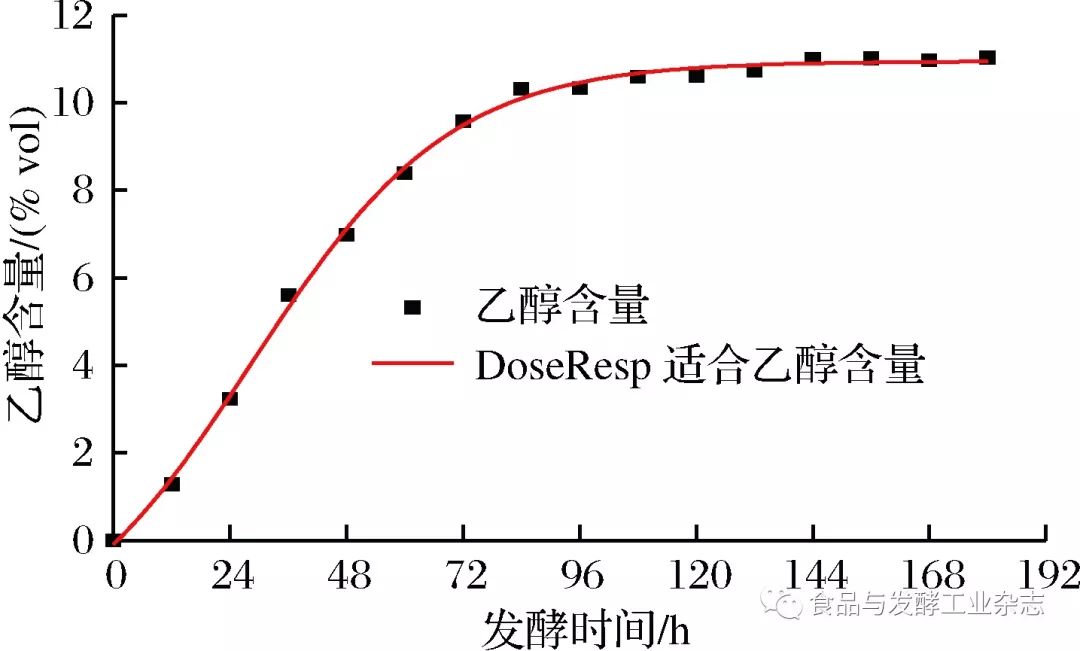
图2 SGompertz模型酵母菌生长拟合曲线 Fig.2 Fitting curve of yeast growth in SGompertz model 2.2.2 酒精生成动力学模型 由表2可得,3种模型对酒精生成情况进行拟合,DoseResp模型的拟合效果最好,判定系数R2=0.998 16,能较好反应酒精的生成情况,故选用DoseResp模型对山葡萄酒发酵过程酒精生成情况进行定量描述。拟合曲线由图3所示。 表2酒精生成的拟合方程及其拟合优度 Table2Fittingequationofalcoholformationanditsgoodnessoffit
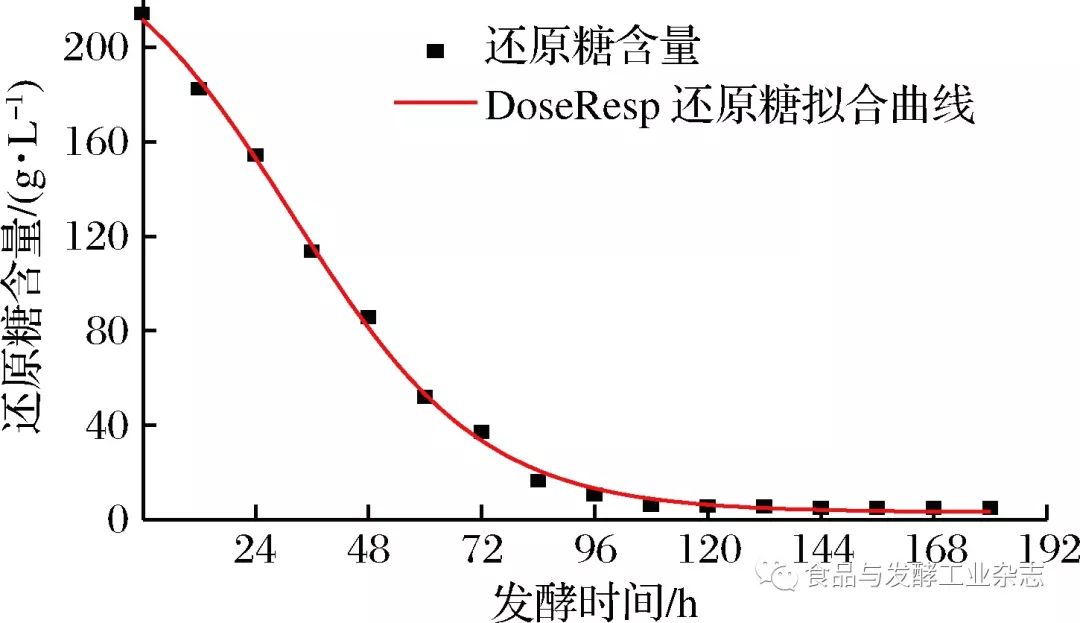
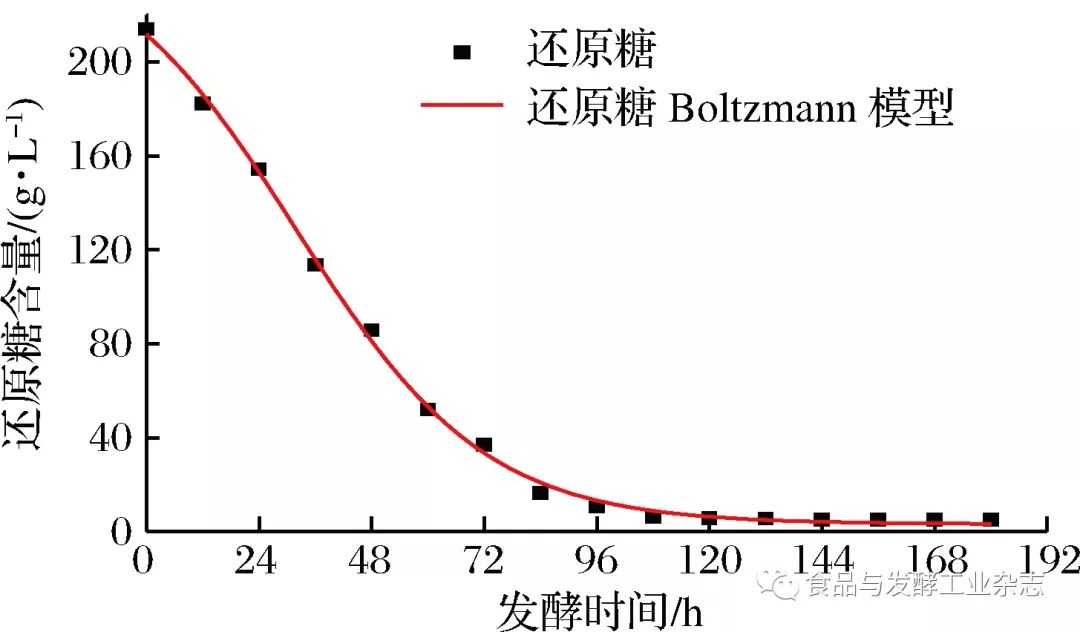
图3 DoseResp模型酒精生成拟合曲线 Fig.3 Fitting curve of alcohol formation in DoseResp model 2.3.3 基质(还原糖)消耗动力学模型 由表3可得,3种模型对还原糖消耗情况进行拟合,DoseResp模型和Boltzmanm模型均能较好说明还原糖消耗情况,判定系数均为R2=0.998 3。故选用DoseResp模型和Boltzmanm模型对山葡萄酒发酵过程还原糖消耗情况进行定量描述。拟合曲线由图4和图5所示。 表3还原糖消耗的拟合方程及其拟合优度 Table3Fittingequationofreducingsugarconsumptionanditsgoodnessoffit
图4 DoseResp模型还原糖消耗拟合曲线 Fig.4 Fitting curve of reducing sugar consumption in DoseResp model
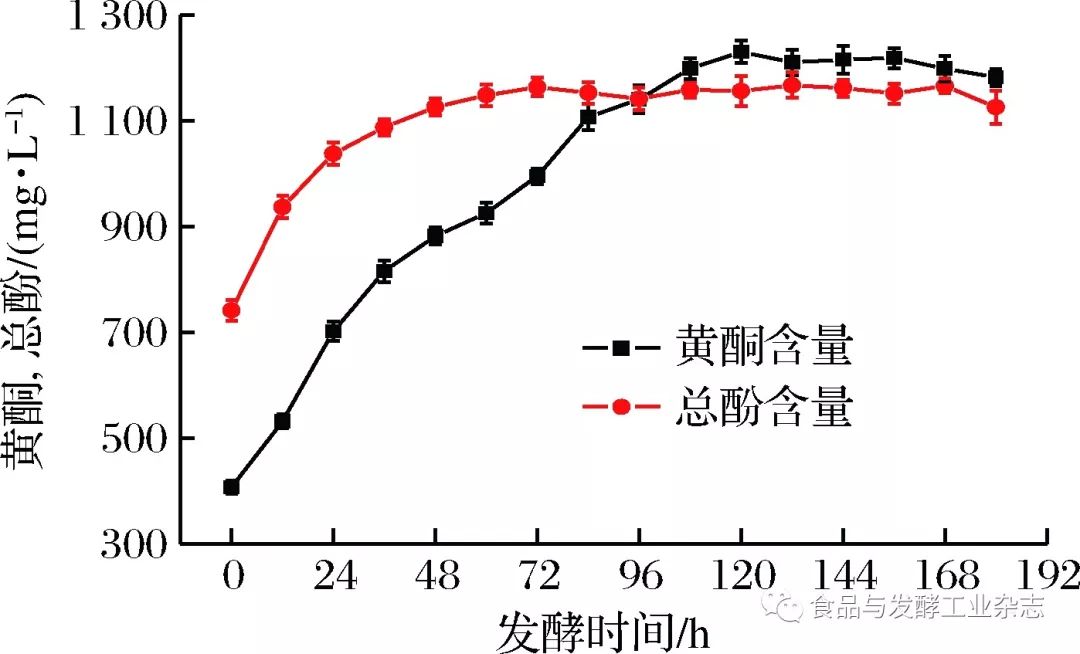
图5 Boltzmanm模型还原糖消耗拟合曲线 Fig.5 Fitting curve of reducing sugar consumption in Boltzmanm model 2. 4 山葡萄酒发酵过程总酚及****酮含量的变化 2.4.1 山葡萄酒发酵过程总酚含量的变化 没食子酸标准曲线方程为:y=0.008 9x+0.034 3,R2=0.998 8。根据标准曲线及所测样品吸光度,换算为样品总酚含量。 如图6所示,山葡萄酒发酵过程中总酚含量呈先上升后平稳的趋势。发酵0~72 h期间,总酚含量不断上升,因为此阶段山葡萄酒发酵剧烈,酒精含量快速增加,促进了葡萄皮和籽中的酚类物质不断浸出,使得总酚含量迅速增加,而此后酚类物质几乎浸出完全,总酚含量大致呈现平稳的趋势。
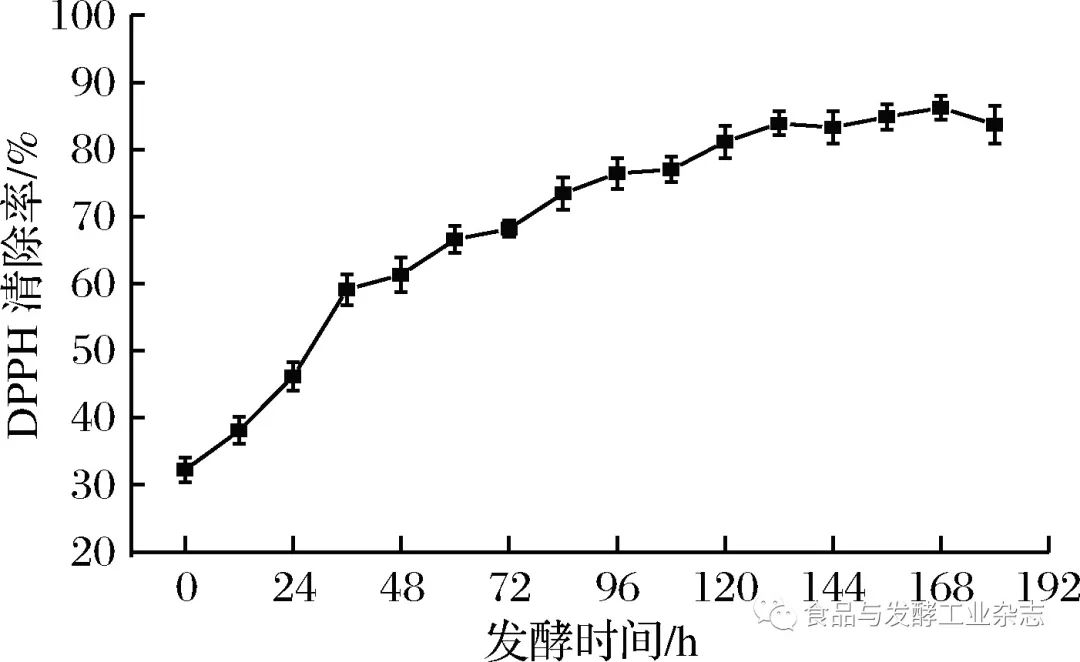
图6 总酚、****酮含量的变化 Fig.6 The change of total phenols and flavonoids content 2.4.2 山葡萄酒发酵过程****酮含量的变化 芦丁标准曲线方程为:y=0.001 2x+0.002 9,R2=0.998 7。根据标准曲线及所测样品吸光度,换算为样品****酮含量。 如图6所示,山葡萄酒发酵过程中****酮含量呈先上升后略微降低的趋势。发酵0~120 h期间,****酮含量不断上升,因为此阶段山葡萄酒发酵剧烈,酒精度增加,使葡萄皮和籽中的****酮类物质更易浸出,使得****酮含量不断增加,而此后****酮含量略微呈现下降的趋势,这可能是由于酵母生长受限,发酵罐类氧气含量增加,导致一些****酮类物质被氧化。 通过分析山葡萄酒发酵过程中总酚与****酮含量的变化可知,葡萄酒发酵过程有利于酚类及****酮类等功能物质的浸出,从而提高酒液中功效物质的含量,故喝葡萄酒比吃葡萄更能充分地汲取葡萄的有效成分。此外,发酵后期总酚和****酮含量趋于平稳,说明发酵过程中酵母菌的生长代谢对其含量变化并无太大影响,不会出现李雪[19]等人的研究中酵母菌和原始菌群生长会分解总酚的情况和****酮类物质含量在发酵后期大量减少的情况,说明山葡萄发酵中酚类物质和****酮类物质具有一定的稳定性。本试验中山葡萄酒功能物质的含量相较于其他品种葡萄酒的含量并不突出[20-22],但葡萄酒中的组分和含量是和葡萄品种[23]、产地[24-25]、气候[26]、工艺[27]等多方面原因[28-29]有关的。 2. 5 山葡萄酒发酵过程抗氧化能力的变化 2.5.1 DPPH自由基清除率的变化 由图7可得,山葡萄酒发酵过程中发酵液的DPPH自由基清除能力总体呈增加趋势,这是由于山葡萄随发酵时间的增加自身的抗氧化物质不断浸出,DPPH自由基清除能力得以加强,尤其是0~120 h增长较快,此后缓慢增加。这与总酚和****酮含量变化趋势总体保持一致。而山葡萄浆发酵后(180 h)比发酵前(0 h)的DPPH自由基清除率高出161.5%。
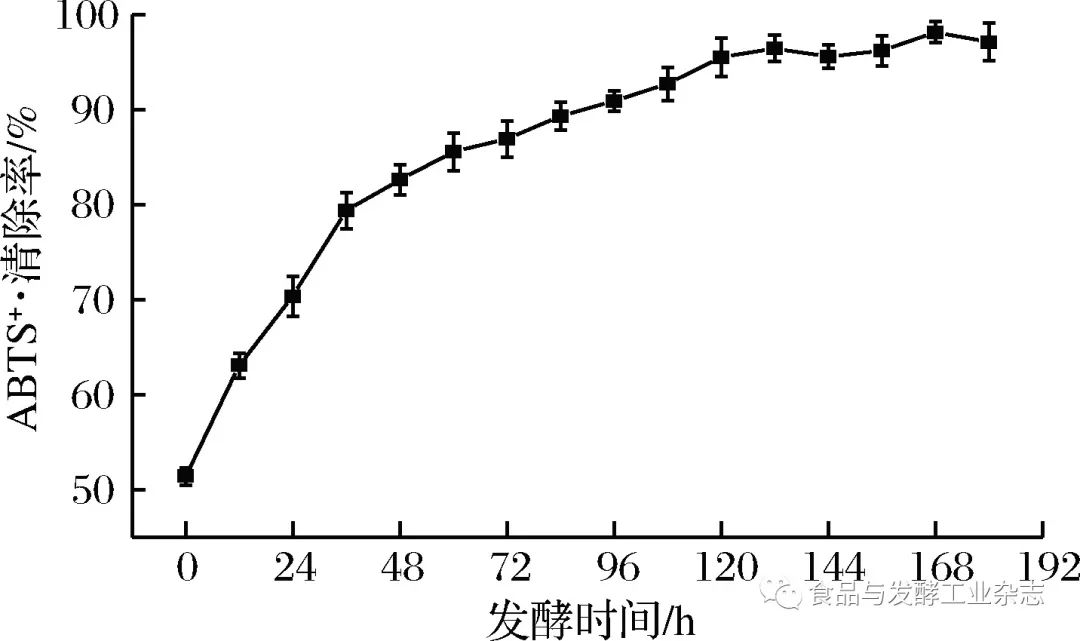
图7 DPPH清除率的变化 Fig.7 The change of DPPH-scavenging ratio 2.5.2 ABTS+·清除率的变化 由图8可得,山葡萄酒发酵过程酒液的ABTS+·清除能力总体呈增加趋势,这是由于山葡萄随发酵时间的增加自身的抗氧化物质不断浸出,样品酒液ABTS+·清除能力随时间增长而加强,尤其是0~120 h增长较快,此后相对趋于平稳。这与总酚和****酮含量变化趋势总体保持一致。而山葡萄浆发酵后(180 h)比发酵前(0 h)的ABTS+·清除率高出88.9%。
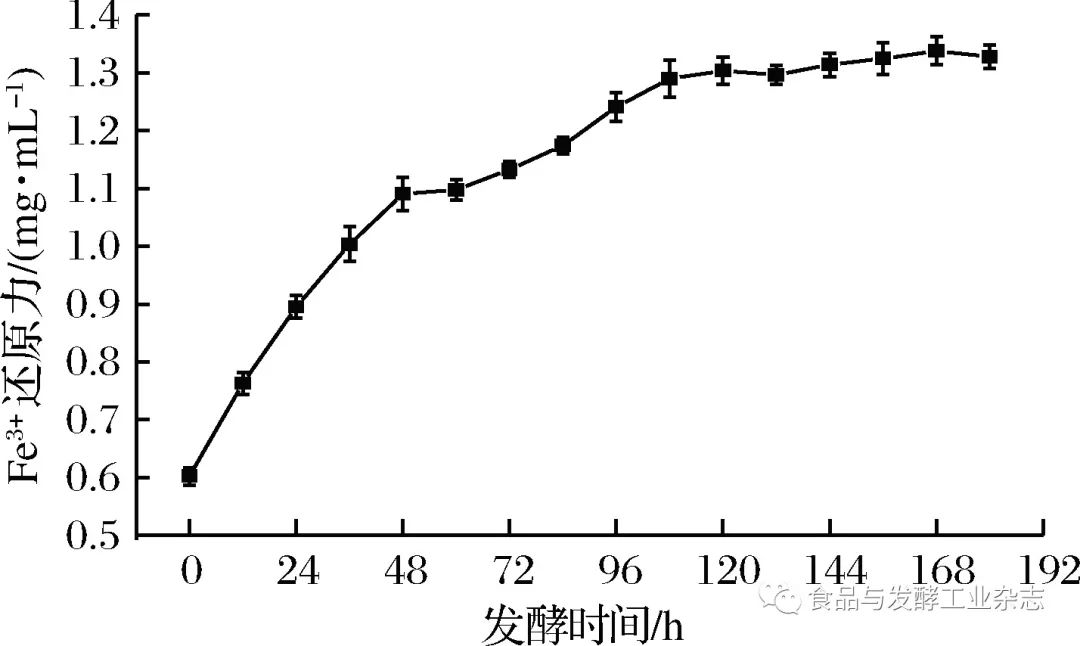
图8 ABTS+·清除率的变化 Fig.8 The change of ABTS+· scavenging ratio 2.5.3 Fe3+还原能力的变化 如图9所示,山葡萄酒发酵过程酒液的Fe3+还原能力总体呈增加趋势,Fe3+还原能力随着发酵时间的增长而增强,尤其是0~48 h期间Fe3+还原能力增强至较高水平,此后缓慢增强。而山葡萄浆发酵后(180 h)比发酵前(0 h)的Fe3+还原能力高出120.5%。
图9 Fe3+还原能力的变化 Fig.9 The change of Fe3+reducing capacity 通过抗氧化试验结果发现,山葡萄发酵后(180 h)的DPPH清除能力、ABTS+·清除能力及Fe3+还原能力较发酵前(0 h)样品分别高出161.5%、88.9%和120.5%,分别比葡萄浆(浸渍前)高出200.0%、198.8%和260.4%;并结合2.4中山葡萄酒发酵过程总酚及****酮含量的变化情况发现,发酵120 h后总酚和****酮含量均趋于稳定,但抗氧化活性还在缓慢增加,说明了山葡萄中除总酚和****酮类物质外还有一些其他的抗氧化活性物质在起作用,充分表明了山葡萄酒的功效性和保健性。对于适量葡萄酒有益于人体健康等说法提供的有力的论据。 2. 6 浸渍前、 浸渍后( 发酵0 h) 及发酵后( 180 h) 总酚、 ****酮含量及抗氧化能力差异显著性分析 如图10和图11所示,浸渍前(葡萄浆)、浸渍后(发酵0 h)及发酵后(180 h)的样品液中总酚、****酮含量及抗氧化能力均具有显著性差异(p |
【本文地址】
今日新闻 |
推荐新闻 |