质量管理系列文章 |
您所在的位置:网站首页 › 对药物进行临床研究药品生产具有审批权限的机构是 › 质量管理系列文章 |
质量管理系列文章
|
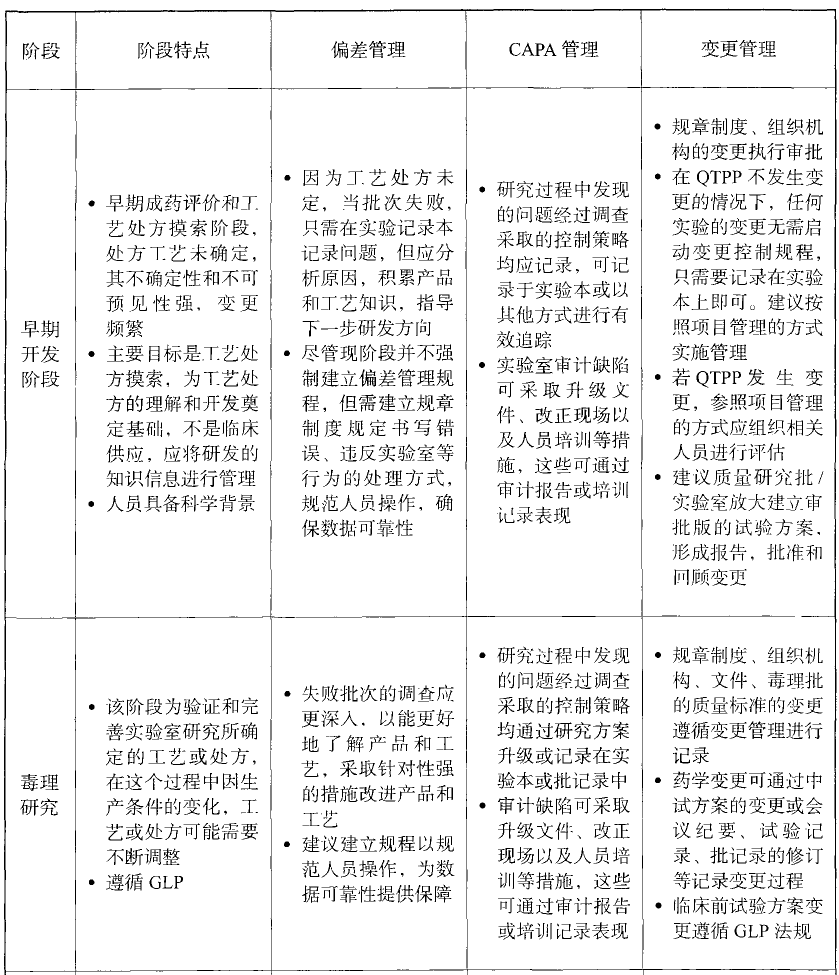
图1:质量源于设计QbD(来源:网络) 2、组织机构和人员 (1)有明确的岗位职责,由指定具备资格的人员担任,并设立独立的临床前研发质量管理归口部门或专员,提供包含人员、场地、仪器在内的基础设施,负责企业内部临床前研发质量管理体系编制及质量核查工作,以此避免人员分工和权限上的交叉。 (2)加强科研人员质量体系培训。为避免科研人员难以识别药品研发过程中存在的质量风险,应加强对其的质量体系培训。培训包括但不限于入职培训、岗前培训和在职员工的持续培训,培训类目包含但不限于基础培训、文件管理、项目管理、仪器设备管理、物料管理、质量管理、法律法规知识等。 3、研究场所和仪器设备 实验场所需保证环境条件满足所开展研究项目的要求,如温湿度、日常物料储存/转运、空间隔离、安全措施、危废处置等条件。并注意设置日常出入清洁标准,避免(交叉)污染。 仪器设备要进行分类管理,并建立可操作性的标准操作规范(SOP),包括对相应的检定或校准、验证、维护、清洁工作进行规定,专设负责人对设备的运行和日常维护进行监督,保障设备的正常运行。 全面规范化的设备档案管理涵盖设备购买到淘汰的全过程,其包括使用、维护、借出、维修等各个环节,旨在确保研究活动的可追溯性。另外,档案保管设施应设有接触权限、有效控制并监测各种危害因素。电子档案存储的组件应确保电子档案访问和存储安全。 4、实验系统和实验材料 实验系统包括GLP中的动物、植物、微生物 以及器官、组织、细胞、基因等;实验材料包括广泛的样品或受试品、对照品、对照制剂及其他物料等。这两者统称物料。 对于物料,需要指定专人进行保管并记录使用情况。管理内容主要包括管理相关的资料信息、保证标签准确清晰、保证储存条件、保证各种过程中的稳定以及足够的留样量。对于试制样品、对照品、对照制剂、受试品等关键物料,其保存期限应保证审评的需要。 如在药理毒理研究的实验动物管理中,应注重动物福利、健康状况、所处环境卫生及营养状态等方面。这些因素应被详细记录并妥善归档,以确保实验系统的质量与适用性。 5、确认与验证 确认或验证的目的是确保药品生产关键要素可控,以保证持续产出符合要求的产品。如一般厂房、设施、设备和仪器需确认,生产工艺、操作规程、检验方法和清洁方法则需保持持续验证状态。具体内容要经过风险评估来确定。 6、文件及档案 档案管理基本包括体系文件、原始记录、各种设备记录、台账、项目资料、试验异常或失败记录、实验变更记录、研发相关文献、支持申报材料等。 文件是体系完善和有效落实的依据,是质量管理体系的核心。文件分为3个层次,依次为质量手册;管理标准(SMP)、技术标准(STP)、操作标准(SOP);记录类。原始记录是指实验数据、文字、声像等原始资料,需格式统一、编号唯一,确保真实、准确、完整。 对于临床前研发阶段的档案,应按重要性分级并由不同职级人员负责管理保存。 7、质量管理 质量管理包括质量保证、质量控制、数据完整性、偏差管理和变更管理。 质量保证被认为是贯彻执行GLP精神、确保研究质量的关键环节。其一般通过质量审计的形式体现,在日常中的具体活动为研发记录、方案和报告的审计;体系运行过程中研究人员对问题的反馈;质管人员的审查评估。 质量控制在药学生产阶段属历年现场检查缺陷的高发项,其特殊项主要包括取样人员需经授权;检验方法需经验证或确认;所有的检查检验标准都必须经过批准;检验记录应包含依据的质量标准和检验操作规程;完整规范的留样管理等。 数据完整性目前主要需注意规范性问题,如数据与记录无缺失、有效控制操作系统与软件管理、计算机系统管理等。可从制定适宜的数据管理规定及对相关人员进行定期、循环培训考核这两方面着手。 偏差管理的形式和要求依据研发阶段和性质的不同而不同,如若在研发初期则简单记录异常即可,若在研发后期则需走偏差处理单。另外,只要涉及数据可靠性的偏差,就需特别关注。 变更管理:据GMP指南建议,在早期开发阶段,在QTPP不发生变更的情况下,任何实验的变更无需启动变更控制规程,只需要记录在实验本上即可。建议按照项目管理的方式实施管理。若QTPP发生变更,参照项目管理的方式应组织相关人员进行评估。临床前试验方案 变更需遵循GLP法规。
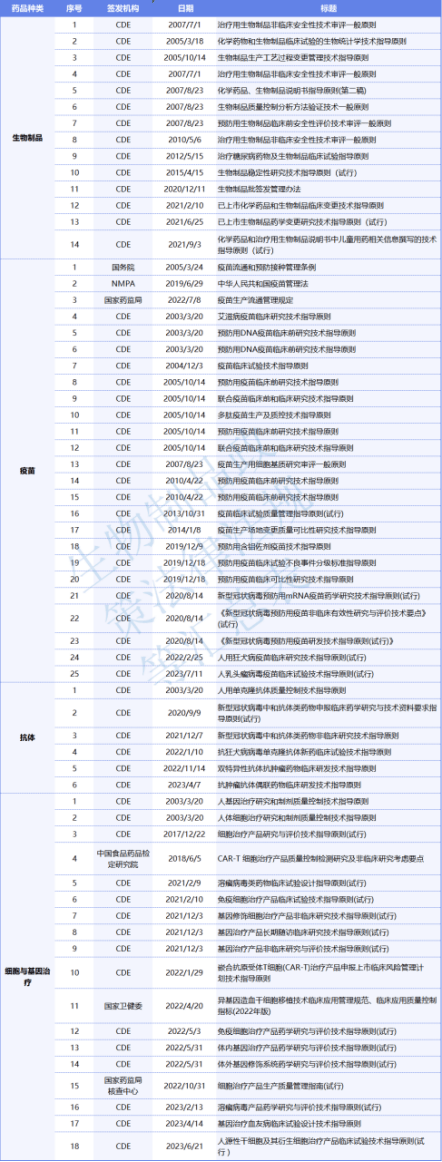
图1:药品研发阶段的质量系统建立建议(来源:药品GMP指南,第二版) 8、工作实施 药学生产中的工作实施部分为“生产管理” 的内容,不同于其他实验室的方案报告,实施的依据是批准的规程文件和记录模板,并完全执行,一旦出现偏差,应进行全面的调查评估;生产管理中注重对清洁的要求,防止污染。 总结:随着药物研发监管的不断发展成熟,临床前研发阶段的质量管理必将成为国家药监局未来法律法规体系完善的一个重点。而建立完善的质量管理体系,是企业在开展研发生产质量管理工作中最重要的一点。药品研发企业提前在此进行规划部署,有利于规避合规风险,保障药物质量,提升药物注册申报成功率,促进企业的长远发展。 参考资料: [1]陈一飞,唐黎明,李刚.中国药物非临床安全性评价研究机构现场检查类型与常见问题讨论[J].中国医药工业杂志,2021,52(05):709-713.DOI:10.16522/j.cnki.cjph.2021.05.019. [2]梅妮,张皖晋,陈一飞.美国FDA发布的药物非临床研究警告信分析[J].中国新药与临床杂志,2023,42(06):406-410.DOI:10.14109/j.cnki.xyylc.2023.06.13. [3]程英,汪飞,黄丽晶等.药物研发全过程质量管理体系的构建和运行[J].中国药事,2021,35(06):631-640.DOI:10.16153/j.1002-7777.2021.06.004. [4]赵静.浅谈新监管环境下药物研发的质量管理[J].化工管理,2020(02):27-28. [5]药物研发管理第一道防线——创新药企药物临床前研发质量管理体系的建立与完善. 安永EY.2023-06-06. 为推动我国生物制品全生命周期质量管理体系的建立,进一步提升生物制品的安全性和有效性,“2023生物制品全生命周期质量管理峰会”将于2023年9月22-23日在上海举办,主题为“质量为先、精益求精”。组委会将力邀知名制药企业质量专家、行业协会和监管部门领导、学术专家做精彩报告。将重点围绕抗体、ADC药物、疫苗、细胞和基因治疗药物、重组蛋白药物等领域的质量管理策略及要点进行探讨。扫码下方二维码报名参会,提交信息后即可邮件获取生物制品法规合集! 会议内容 时间:2023年9月22-23日(周五-周六) 地点:上海(酒店定向通知) 指导单位:上海市医药质量协会 主办单位:四叶草会展、生物制品圈 协办单位:奥星集团 会议费用:为药企质量专家提供参会福利,报名FREE!(仅收取50元定金,含茶歇、会议资料等,定金概不退还)(如需用餐,2天午餐加收150元),先到先得,报完即止!请提前锁定! 报名方式:扫描下方二维码或点击文章最底部“阅读原文”→ 填写表格 → 报名成功(报名志愿者,承担一定工作,请慎重考虑,免交定金)! 组委会获得报名信息后,根据报名信息进行初筛,并进一步与报名者沟通确认,实现精准邀请。最终有机会进入大会微信群(严格审核通过)。 生物制品领域的相关法律法规资料合集内容如下: 1、我国生物制品政策法规汇总表(领取后可查看高清表格)
2、部分政策文件截图
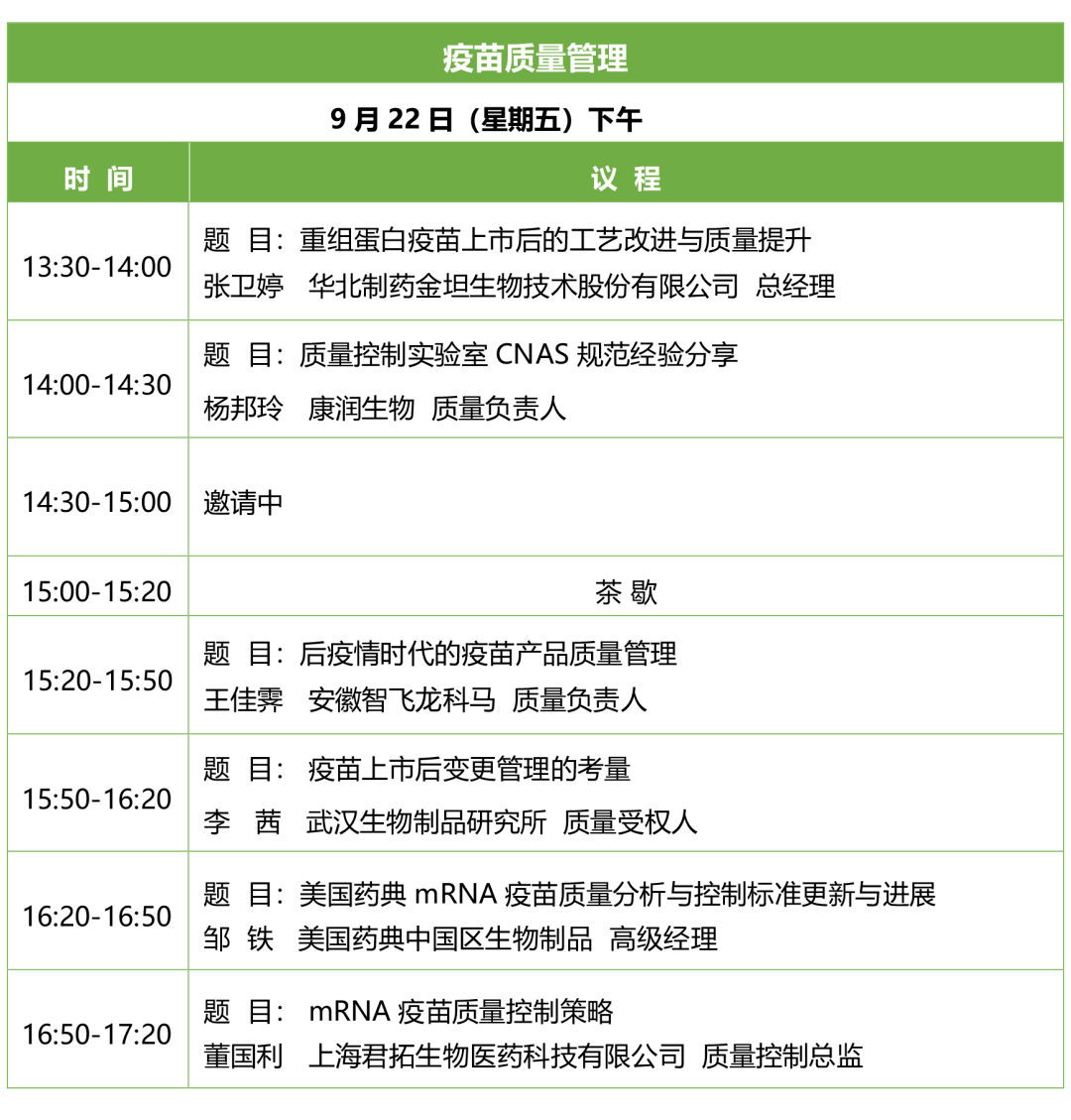
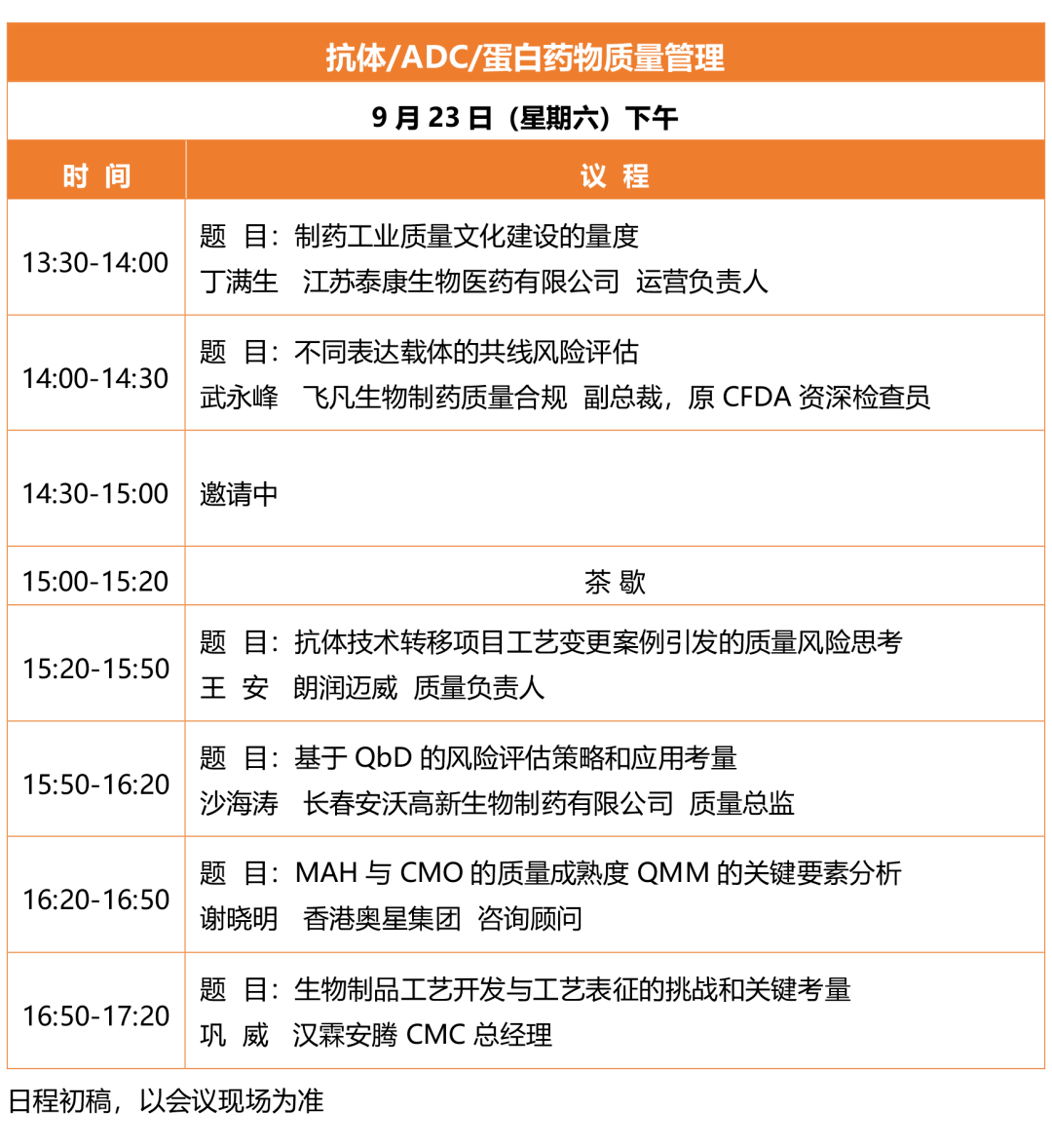
会议议程
生物制品微信群! 请注明:姓名+研究方向! 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |