重磅!环状RNA研究实验流程详解 |
您所在的位置:网站首页 › 实验检测仪器上市流程详解图片 › 重磅!环状RNA研究实验流程详解 |
重磅!环状RNA研究实验流程详解
|
图1 环状RNA分析常规实验流程(来自(Zhang et al., 2016)) 环状RNA分析的样品如何制备和预处理? 首先需要制备去除核糖体RNA,再进一步制备不含Poly-A的RNA样品。主要使用Invitrogen的核糖体RNA去除试剂盒:RiboMinus™ Human/Mouse Transc riptome Isolation Kit(货号K1550-01)进行制备工作。进一步通过磁珠法结合Poly (A)的RNA后剩余的RNA即为Poly (A)- RNA样品。
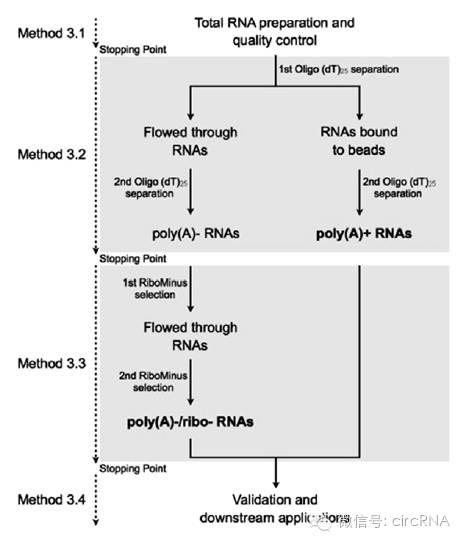
图2 去除核糖体RNA及不含Poly(A)的RNA制备流程(来自(Yin et al., 2015)) 然后进行RNase R消化:获得的RNA样品用52μL DEPC水重悬,一分为二,其中一份进行RNase R消化,另一份做对照。RNase R消化组加3μL 10×RNase R Reaction Buffer,1μL RNase R (20 U/μl),(不消化的组加1μLDEPC水),37 °C for 1–2 h。消化结束后加30μL 酚-氯仿-异戊醇,震荡混匀以终止消化,13000× g, 4 °C 离心 5 min。弃上清,沉淀用6μL 4 M氯化锂,1μL糖原,90μL预冷无水乙醇颠倒重悬,−80 °C沉淀1h,也可以直接放置在−80 °C,直到准备下一步实验时。实验前用13000× g, 4 °C 离心 20 min,用75%预冷乙醇洗涤两次,风干后20μLDEPC水溶解即可用于下一步的实验。 PS:RNase R消化时间比较重要,时间太短容易导致部分线性的RNA没法彻底消化干净,而时间过长又有可能导致部分RNase R敏感的环状RNA损失。作者根据经验,推荐用于Nothern杂交的样品处理1h足够了。此外,不同来源的RNase R的活力单位也需要注意。 环状RNA样品进行测序分析的主要流程 上述获得的RNA样品可直接用于RNA-seq的建库分析。关于仅包含内含子序列的ciRA以及反向拼接(back-spliced)的circRNA的分析主要通过测序Reads的mapping结果进行分析,后面我们将专门针对环状RNA二代测序数据分析技术进行一次专题介绍,敬请关注。 如何进行环状RNA的Northern杂交分析实验? 首先制备尿素-丙烯酰胺变性胶,2×尿素上样Buffer预混RNA样品(总体积小于10μL),100℃煮沸5min充分变性,迅速置冰上。点样,1×TBE电泳液体系120 V电压电泳3 h。1×转膜液转膜至尼龙膜上,100V转膜90min。254nm紫外180 mJ/cm2交联。 探针制备:利用RiboMAX™ Large Scale RNA Production Systems(Promega)试剂盒进行探针制备,概括而言步骤包括将DNA模板,10×Dig labeling mixture,5×转录Buffer,T7或SP6转录酶与DEPC水混合好(具体体系依据说明书),37 °C反应 2–3 h。1μL DNase I 37°C反应15min消化DNA模板。RNA探针通过氯化锂-乙醇体系沉淀浓缩(4μL 4M氯化锂,100μLDEPC水,300μL预冷无水乙醇,颠倒混匀,−20 °C 沉淀1 h)。继续用预冷75%乙醇洗涤两次,晾干后用40μL DEPC水重悬。 杂交实验:先用DIG Easy Hyb (3 ml/100 cm2 ) 68 °C预杂交30 min,缓慢摇动。探针变性:100 °C处理5min后迅速置冰上。DIG Easy Hyb混合RNA探针 (100 ng/mL),孵育过夜,轻轻摇动。洗涤:2×SSC, 0.1 % SDS,5min洗两次,0.2×SSC, 0.1 % SDS 68 °C,30min洗两次。1×Washing buffer漂洗一下,在1×Blocking solution中封闭30min,抗体孵育30min,1× Washing buffer 20min洗3次,Detection buffer 孵育5 min,加 CDP- Star ready-to-use solution (100 cm 2膜加 1ml),孵育2-5min。压片显影。 PS:尿素变性电泳往往用于检测小于500nt的RNA分子。环状RNA的特殊结构导致在该体系中泳动速度远低于同样大小的线性RNA。 如何进行环状RNA的反转录PCR鉴定实验? RNase R消化后的RNA样品利用随机引物反转录后可以直接用于定量PCR等分析。还可以基于RNA-seq或数据库检索中初步获得环状RNA的环化位点,专门设计针对特定环状RNA(某环化位点或外显子序列)的反转录和QPCR检测体系。后面我们将专门针对环状RNA反转录及定量PCR分析技术进行一次专题介绍,敬请关注。 环状RNA分析需要准备哪些试剂? Rnase R:Epicentre,货号RNR07250 酚-氯仿-异戊醇(体积比25:24:1):Life Technology,货号15593-031 4 M 氯化锂:称取3.3912 g 氯化锂(Sigma,货号L9650-500 G)于15ml RNase-Free的离心管中,加10 mlDEPC水溶解,充分溶解后用0.22μm孔径的Millex-GP 针头滤器过滤,分装,-20°C保存。 糖原(RNA级):Thermo,货号R0551 75 %乙醇:无水乙醇用DEPC水稀释至75%体积比浓度,-20°C保存。 尿素:AMRESCO,货号037-1 KG 30%丙烯酰胺:Sangon Biotech,货号SD6017 10×TBE电泳Buffer:108 g Tris base(Sigma,货号15456-3),55 g 硼酸(Sigma,货号B6768-500 G),40ml 0.5M EDTA(pH8.0),加DEPC水定容至1L。0.22μm孔径的Millex-GP滤器过滤,室温保存。使用时用DEPC水稀释至1× 0.5 M EDTA, pH 8.0:186.1 g Na2 EDTA • 2H2 O((Sigma,货号E5134-250 G),500mL DEPC水溶解,用NaOH调pH至8.0,DEPC水定容至1L,0.22μm孔径的Millex-GP滤器过滤,室温保存。 10 % (w/v) 过硫酸铵: 0.1 g 过硫酸铵(Sigma,货号A3678-25 G)溶解至1mLDEPC水中,4 °C保存。 TEMED:BIORED,货号161-0801 2×尿素上样Buffer:8M尿素,90%甲酰胺(Sigma,货号F9037-100 mL),20 mM EDTA,0.1 % (w/v) 二甲苯青, 溴酚蓝。4 °C保存。 50×转膜Buffer:30.285g Tris碱,17.02 g 三水合乙酸钠(Sigma,货号236500-500 G), 9.306 g EDTA,10mL乙酸,溶解于500mL DEPC水中,0.22μm孔径的Millex-GP滤器过滤,室温保存。使用时用DEPC水溶解至1× RiboMAX™ Large Scale RNA Production Systems:Promega,货号P1280 (SP6), P1300 (T7) 用于合成RNA探针。 Dig RNA Labeling Mix:Roche,货号11277073910 DNA-free™ Kit, DNase Treatment and Removal Reagents:Ambion,货号AM1906 Dig Easy Hyb Granules:Roche,货号11796895001, 20× SSC:175 g NaCl(Sigma,货号S9625-1 KG),88 g柠檬酸钠二水合物(Sigma,货号W302600),500mL DEPC水,调pH至7.0,DEPC水定容至1L。0.22μm孔径的Millex-GP滤器过滤,室温保存。2×SSC和0.2×SSC用DEPC水稀释获得。 10 % (w/v) SDS:100 g SDS (Sigma,货号L3771-1KG) 用1L DEPC水溶解,0.22μm孔径的Millex-GP滤器过滤,室温保存。0.1 % SDS 用DEPC水稀释获得。 DIG Wash and Block Buffer Set:Roche,货号11585762001 Anti-Digoxigenin-AP, Fab fragments:Roche,货号11093274910 CDP- Star , ready-to-use solution:Roche,货号12041677001 Supersc ript™ III Reverse Transc riptase反转录酶:Invitrogen,货号18080 Random hexamers随机引物:TaKaRa,货号RR037A dNTP:TaKaRa,货号T4030 Recombinant RNasin ® Ribonuclease Inhibitor:Promega,货号N2511 参考文献: Yin, Q.F., Chen, L.L., and Yang, L. (2015). Fractionation of non-polyadenylated and ribosomal-free RNAs from mammalian cells. Methods Mol Biol 1206, 69-80. Zhang, Y., Yang, L., and Chen, L.L. (2016). Characterization of Circular RNAs. Methods Mol Biol 1402, 215-227. Yin, Q.F., Chen, L.L., and Yang, L. (2015). Fractionation of non-polyadenylated and ribosomal-free RNAs from mammalian cells. Methods Mol Biol 1206, 69-80. Zhang, Y., Yang, L., and Chen, L.L. (2016). Characterization of Circular RNAs. Methods Mol Biol 1402, 215-227. 文 | circRNA 吉赛生物 本文为作者授权肽度时界发布 仅为作者观点,不代表肽度时界立场,转载请注明来源肽度时界 推荐阅读: 医学科研干货免费下载,请关注“肽度时界”公众号,关注后回复“指定数字”获取: 1.医学科研实验常用protocol--回复“001”领取 2.质粒图谱大全--回复“002”领取 3. 医生晋升方法/执业医生题库/晋升程序与制度/考试口诀等--回复“003”领取 4.中国互联网预约挂号服务市场专题研究报告2016--回复“004”领取 5. 科研必备软件(12大分类50款)免费下载 --回复“005”领取 6. 2016年全球二代基因测序行业投研报告 --回复“006”领取 7. lncRNA超级干货(68篇文献免费阅读) --回复“007“领取 8. SCI论文超级干货合集(SCI论文写作技巧+配图软件+施一公大咖经验+文献检索+SCI经验书籍) --回复“008” 领取 9. 中国移动医疗市场年度研究报告2016 --回复“009”领取 10.信号通路与信号转导系列文件+Cell网站细胞信号通路图(超多干货)--回复“010”领取返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |